基于临界半衰期的连续流反应热安全风险评估方法
2024-03-27田均均王芳芳李玮晔吴展华
盛 敏,田均均,王芳芳,李玮晔,吴展华
(1.华东理工大学反应安全中心, 上海 200237; 2.中国工程物理研究院化工材料研究所, 四川 绵阳 621999)
0 引 言
连续流反应技术,凭借其高效的传热性能、相对精确的温度控制能力、不显著的放大效应、以及出色的可操作性,越来越广泛地应用于各类化学合成反应工艺中[1-4]。特别是在高能化学品合成中的硝化反应等高危反应工艺应用中,连续流反应器以其在线物料少、容易实现工艺自动化和人机隔离、事故发生的后果相对较小等安全性优点而受到各界越来越多的认可[5-7]。因此,我国政府相关部门已推出多项政策以推广这一技术。国家安监管总局在2017 年发布的关于《加强精细化工反应安全风险评估工作的指导意见》[8]中强调了在高风险工艺中优先采用连续流技术的必要性。中国石油和化学工业联合会发布的《石化绿色工艺名录》[9-10]中也提到了微通道自动化生产工艺。2021 年工信部正式公布了第一批石化化工行业鼓励推广应用的技术和产品目录[11],更是将新型微通道反应器装备及连续流工艺技术列为首位。
连续流反应器相对于传统的釜式反应器具有更高的传热效率[12-14],这主要归因于以下两个方面:(1)连续流反应器的表面积与体积比较传统釜式反应器高1~3 个数量级;(2)其流体体积小,具有通道内增强的湍流传热效应。因此,利用连续流反应器进行反应速率快、放热量大的化学反应时,能够及时移除反应热,从而保持反应器内部温度的稳定,避免了局部热点和强放热分解反应的发生,实现热风险的有效控制[15-17]。然而,也有研究报道了在连续流反应器内发生绝热温升反应的飞温现象。例如,Gelhausen 等[18]在内径0.38 mm 的微通道反应器内进行过氧化氢氧化硫代硫酸钠反应时观察到,随着进口浓度从0.3 mol·L-1增加到1.3 mol·L-1时,反应器内外温差从5 ℃迅速增加到160 ℃,在距离进口端的25 cm 内出现了类似釜式反应器的飞温现象。Schwolow 等[19]的研究报道,在内径1 mm 的通道式反应器内也发生了绝热温升反应。这表明连续流反应在特定情况下仍然有热安全风险,而目前对于导致热安全风险的具体条件的研究较少,更加缺少相应控制措施的科学理论指导。
本研究聚焦于连续流反应的热安全风险,以通道式反应器为例,通过建立反应器的传热量与反应的放热量平衡仿真模型,深入探讨了该类反应器的实际传热情况,快反应的绝热温升反应现象,并提出连续流反应热安全风险评估方法。
1 模拟与仿真
1.1 传统计算模型
传热速率:传热速率的快慢直接影响反应器内部温度的控制。如果传热速率过慢,热量无法及时散失,反应器内部温度可能会上升过快,超出设计范围,从而导致反应失控。釜式反应器或连续流反应器,其传热速率表达式为式(1):
时间常数和传热长度常数:由于物料在反应器内的实际传热总量除了取决于传热速率之外,还取决于传热时间。一般情况,反应体系的传热量可用热物料的冷却速率来量化。对于釜式反应器,可假设温度为T0的高温物料加入容器内,反应釜的冷却夹套内冷却液温度恒定在Tc,根据热量衡算获得的温度变化方程为式(2):
将式(2)直接积分获得温度随时间的变化关系如式(3)所示:
根据式(3),可定义该反应釜的时间常数τ,即温度差(T-Tc)降到1/e(36.8%)所需的时间。时间常数由反应釜的大小(V)、总传热系数(U)、传热面积(A)、物料密度(ρ)和物料热容(Cp)所决定,如式(4)所示:
虽然通道式反应器管道自身材质(惰性物质)可以吸收大量热量,但基于管道内部的总传热系数(U)一定时,当传热时间趋近为零,管道对于物料的吸热量也趋近为零。而通道式反应器传热时间为流体滞留时间,该时间可通过调节管长或流速来控制。当通道式反应器体系的流速一定时,滞留时间由管长决定,因此可将通道式反应器内的温度变化方程修正为式(5):
式(5)直接积分获得温度随管长的变化关系如式(6)所示:
根据式(6)可定义通道式反应器的传热长度常数τL,即温度差(T-Tc)降到36.8%(1/e)所需的管长。传热长度常数由时间常数和长度流速所决定,如式(7)所示:
1.2 仿真模型建立
1.2.1 实际传热量的仿真模型
当通道式反应体系内的物料有热量产生时,需结合体系的热平衡方程(式(8))[20]进行仿真计算:
本研究建立图1所示的简化模型,利用Runge-Kutta数值解法和Python 编程开展其仿真计算[21]。其中,内径 为10 mm 管 道,总 传 热 系 数 为500 W·m-2·K-1[20],外部冷却液温度为30 ℃,流过5 L·min-1的浓硫酸物料。

图1 通道式反应器实际传热的仿真计算模型Fig.1 Simulation and calculation model of actual heat transfer in channel reactor
1.2.2 化学反应的仿真模型
当通道式反应体系内的物料有单个的n级化学反应发生时,体系的反应速率方程可简化为式(9):
根据热量衡算获得的温度随管长变化的关系式如式(10):
2 连续流反应体系的模拟
2.1 参数的确定
(1)影响热安全性的传热速率
为分析通道式反应器的传热速率,将以工业应用釜式反应器的相关参数作为参比,其中釜式反应器单位体积的表面积(A/V)数据基于球型几何体,如表1 所示。在工业应用中,釜式反应器单位体积的表面积相对较低,并且随着总体积的增大而减小。实验室规模的容器单位体积的表面积约为48~225 m-1,而工业级别的釜式容器则显著降低,仅为3.55~6.09 m-1。在实际工业环境中,配备冷却夹套的釜式反应器通常具有200~300 W·m-2·K-1的总传热系数[22],然而,对于没有冷却夹套的储罐,其总传热系数则大幅降低至约11 W·m-2·K-1[22]。本研究利用传热速率方程式(1)计算得到釜式容器做为反应器和储罐时的散热速率如表1 所示。可见假设储罐物料意外触发分解反应或聚合反应产生热量,若产热速率达到40 W·kg-1,则这种物料只能安全地存储在容量不超过128 mL 的实验室级别容器内。超出这一容量限制,可能发生反应热累积,最终导致反应失控甚至引发爆炸的安全事故。

表1 釜式容器做为反应器和储罐时的传热速率Table 1 Heat dissipation rate in tanks as reactors and storage vessels
此外,在反应安全风险评估中常用的量热仪,其检测下限很可能高于大型工业储罐的实际散热速率。以绝热加速量热仪(ARC)为例,其检测下限一般为0.02 ℃·min-1。当ARC 的惰性因子为2.5 时,物料在量热仪起始温度(检测下限对应温度)下的产热速率为0.05 ℃·min-1,这超过了大部分工业储罐的散热能力,因此,为了确保安全,通常需要将绝热加速量热仪起始温度再降低50 ℃,以此作为安全操作的温度限制[23]。
通道式反应器常被视为微通道反应器(10 µm~1 mm)的工业应用版本,其反应器管径范围一般为1~30 mm,其单位体积的表面积也相对较大。常见的通道式反应器的单位体积的表面积介于133~4000 m-1。本研究采用基于管道内壁的总传热系数为500 W·m-2·K-1[20]计算得到通道式反应器的传热速率如表2 所示。可见通道式反应器能够实现高达2000~60000 W·kg-1的散热速率。与工业用釜式反应器(其散热速率通常在20~40 W·kg-1范围内)相比,通道式反应器的散热速率提升了整整2 到3 个数量级,能较大程度降低反应热安全风险
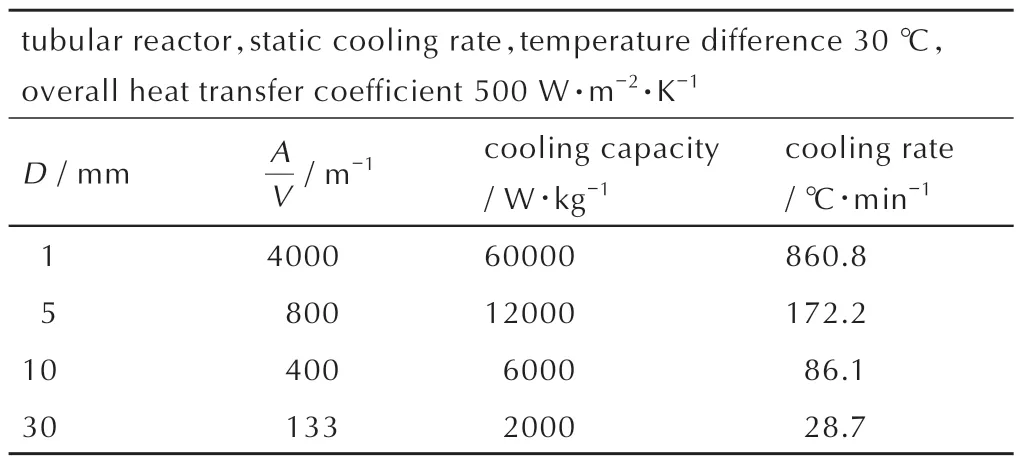
表2 通道式反应器的传热速率Table 2 Heat dissipation rate of channel reactors
(2)影响热安全性的时间常数(传热长度常数)
本研究根据式(3)和式(6)计算得出釜式反应器和通道式反应器内热物料的冷却曲线,如图2 所示。可见,不管是釜式反应器还是通道式反应器,将热物料完全冷却(温差降到2%)都需要4 个时间常数(τ)。只是在通道式反应器内传热时间由管长所决定,所以通道式反应器实现有效传热需要4 个传热长度常数(τL)。
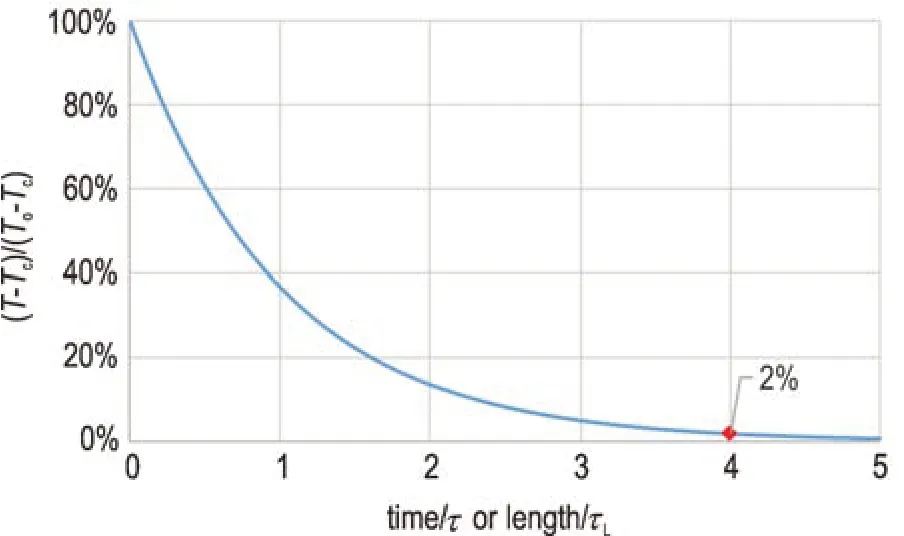
图2 釜式反应器或通道式反应器内热物料的冷却曲线Fig.2 Cooling curve within a batch reactor or a tubular reactor
对比两类反应器冷却浓硫酸时,根据式(3)计算得出500 L 釜式反应器的时间常数为37 min。而选用内径为10 mm 的通道式反应器,在体积流速为5 L·min-1(长度流速1.1 m·s-1)的条件下,根据式(6)计算得出的时间常数τ为15 s。这个时间常数是500 L釜式反应器的时间常数的1/148,可见,通道式反应器比釜式反应器具有更高的散热速率。
同时根据式(7),进一步计算出传热长度常数τL为16.5 m。这意味着,如果将60 ℃的浓硫酸,通过30 ℃的冷却水完全冷却到30.6 ℃,理论需要4 个τL的管长,即66 m 管长。然而,在实际工业应用中,这种长度的管道可能难以实现。当管道长度不足时,实际传热时间减少,这导致通道式反应器的实际传热量受到限制。
显然,时间常数或传热长度常数越小,说明反应器的传热速率越高,有利于移除反应产生的热量和控制体系温度,从而降低反应体系的热安全风险。
2.2 实际传热量的仿真计算
为了考核通道式反应器模型的准确性和实用性,本研究通过模型仿真计算与传统常数计算方法数据进行对比,假设工况一:物料无产热(Q=0),进口温度为60 ℃,通道式反应器对热物料做冷却。根据式(8)和图1 的模型,该过程的温度变化仿真计算结果如图3所示,当流速为5 L·min-1,物料从初始的60 ℃完全冷却到30.6 ℃,所需的理论管长为66 m。这一计算结果与传热长度常数方法得到的数据相吻合,验证了模型的准确性。

图3 微通道反应器对热物理的冷却过程的温度变化仿真计算结果Fig.3 Simulation results of temperature change in thermophysical cooling process of microchannel reactor
进一步分析发现,流速的变化对物料冷却所需管长有显著影响。随着流速的降低,物料完全冷却所需的理论管长也相应减少。但即使在流速降至1 L·min-1(0.22 m·s-1)的情况下,仍然需要13.2 m 的管长才能实现物料的完全冷却。
本研究同时进行仿真计算工况二:进口温度30 ℃,物料具有恒定产热速率(范围设定在40~4000 W·kg-1),该过程的温度变化仿真计算结果如图4 所示。当物料产热速率达到4000 W·kg-1的高值时,可以观察到,自物料进入反应器开始,其温度便持续上升。在管道长度达到66 m 后,物料的内外温差稳定在30 ℃,这表明在此之后,物料产热速率等于管道散热速率。这一发现揭示了一个重要事实:当管长足够长(>66 m)且内外温差保持在30 ℃时,该通道式反应器能处理的物料产热速率高达4000 W·kg-1(表2中6000 W·kg-1基于水介质),这一数值是传统的500 L 釜式反应器所能处理的产热速率(40 W·kg-1)的100 倍,突显了足够长的通道式反应器在高效散热方面的显著优势。对于产热速率为40 W·kg-1和400 W·kg-1的物料,其温度变化趋势与4000 W·kg-1的情况类似,但内外温差按比例减少,在达到稳定状态后,它们的温差分别为0.3 ℃和3 ℃。值得注意的是,无论物料的产热速率如何,达到温度基本稳定状态所需的管道长度均为66 m。因此,为了充分利用通道式反应器的散热效果,通常所需的管道长度一般不低于4 个传热长度常数。
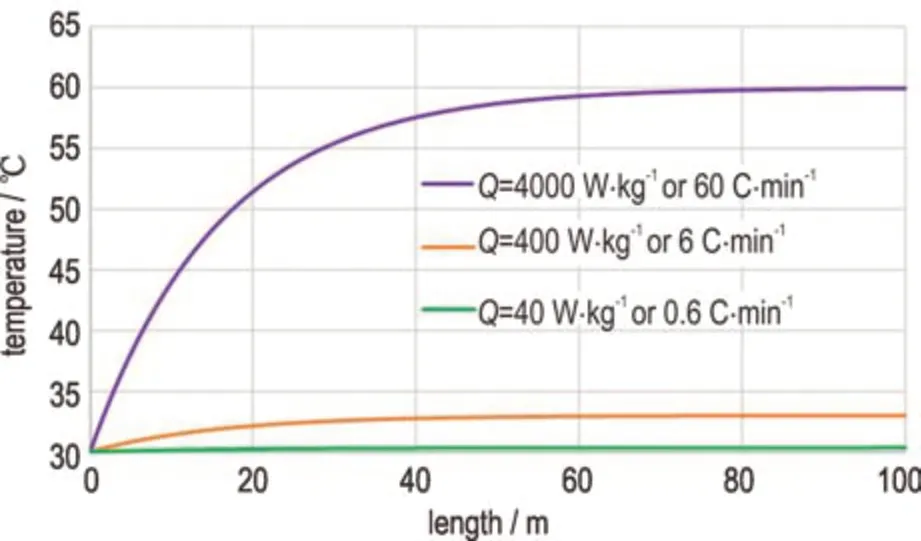
图4 微通道反应器对物理恒定产热的移热过程仿真计算结果Fig.4 Simulation results of heat transfer process for physical constant heat production in a microchannel reactor
由此两种工况的模拟结果可见,当管长不足时,物料在管道内的滞留时间缩短,导致传热时间不足,实际传热量将相应降低。特别是当通道式反应器管长只有数米时,传热时间仅有几秒,导致真实传热量非常有限。这一现象清晰地揭示了通道式反应器传热效率高并不等同于实际传热量大这一重要概念。因此,在设计通道式反应器时,需要综合考虑流速、管长以及传热时间等因素,以实现更高效的传热效果。
另外,当反应在反应器进行并产生大量反应热时,在釜式反应器内可采用半间歇过程完成反应,根据需要可调整滴加时间,既可根据反应釜散热速率来调整反应体系的产热速率,从而实现有效的温度控制,降低反应过程的热安全风险。但在通道式反应器则无法轻易实现反应产热速率的调控,可能会导致针对反应阶段降温的有效管长低,从而出现相应的热安全风险。
2.3 化学反应的仿真结果
化学反应的速率可通过反应的半衰期来评估,即物料消耗至一半所需要的时间长度。基于反应半衰期的 不 同,Roberge 等[20]将 化 学 反 应 分 为 三 类:A 类 反应,其半衰期小于1 s,属于快反应;B 类反应,半衰期在1 s~10 min,属于较快反应;C 类反应,半衰期大于10 min,属于慢反应。Frede 等[24]报道了适合连续流反应器的反应半衰期如图5 所示,A 类和B 类均适宜在连续流反应过程(微通道、通道式反应器等)中进行,还指出,半衰期小于1 min 的反应非常适合在连续流量热仪内测量。可见适合在连续流反应器的反应大部分为半衰期都小于10 min 的快反应。根据前面散热速率的分析,部分快反应可能会导致在局部管长内反应产热速率大大高于散热速率,从而出现相应的热安全风险(如绝热温升反应)。为防范这种热安全问题,需要建立相应的热安全风险评估方法。
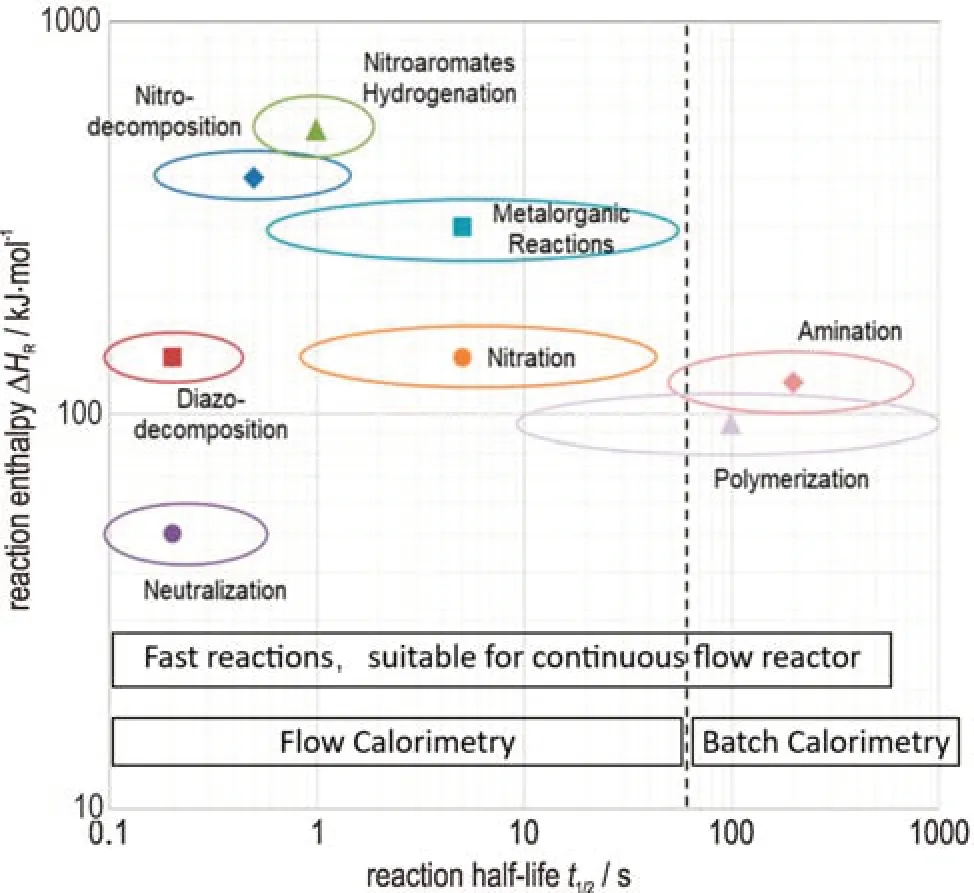
图5 适合连续流反应器的反应半衰期(应小于10 min)[24]Fig.5 Half-life of a reaction suitable for a continuous flow reactor(should be less than 10 min)[24]
然而,根据本研究实际传热的仿真计算结果,图1所示的通道式反应体系的时间常数为15 s,传热长度常数为16.5 m,充分传热需要管长不小于66 m,既滞留时间不小于1 min 才能实现有效散热。而图5 所示很多适合通道式反应的反应时间只需几秒到几十秒,这可能导致传热时间太短而出现实际传热量不足。此外,当快反应在通道式反应器内发生时,由于反应迅速完成,可能导致有限的管长内无法实现有效的散热。这种情况下,热量可能会累积,导致反应器内温度急剧升高,从而增加热安全风险。
2.3.1 绝热温升反应的热风险
反应半衰期通常可通过RC-1 仪器获得产热速率曲线后,结合仪器设备的时间常数及传热系数进行去卷积处理,进而获得反应的真实产热速率曲线,并最终通过拟合动力学模型计算得出的。为了更进一步研究快反应的绝热升温,本研究利用通道式反应器模型对乙酸酐(水解反应的半衰期为3 min,反应1),盐酸水溶液跟氢氧化钠水溶液(中和反应的半衰期为1.5 s,RC-1 测试时传质主导反应速率,反应2)进行仿真计算,这两个反应的反应动力学参数如表3 所示。

表3 假设的半衰期分别为1.5 s 和3 min 反应动力学参数Table 3 Reaction kinetics parameters for assumed half-lives of 1.5 s and 3 min
在本研究中,假设这两个反应的反应热均为200 J·g-1,物料热容均为2 J·g-1·K-1,因此它们的绝热温升都为100 ℃。仿真计算的工况假设为:反应物(A)进入通道式反应器,进口温度为50 ℃,在微通道反应器内发生反应,并通过管外50 ℃导热油冷却。计算结果如图6 所示。
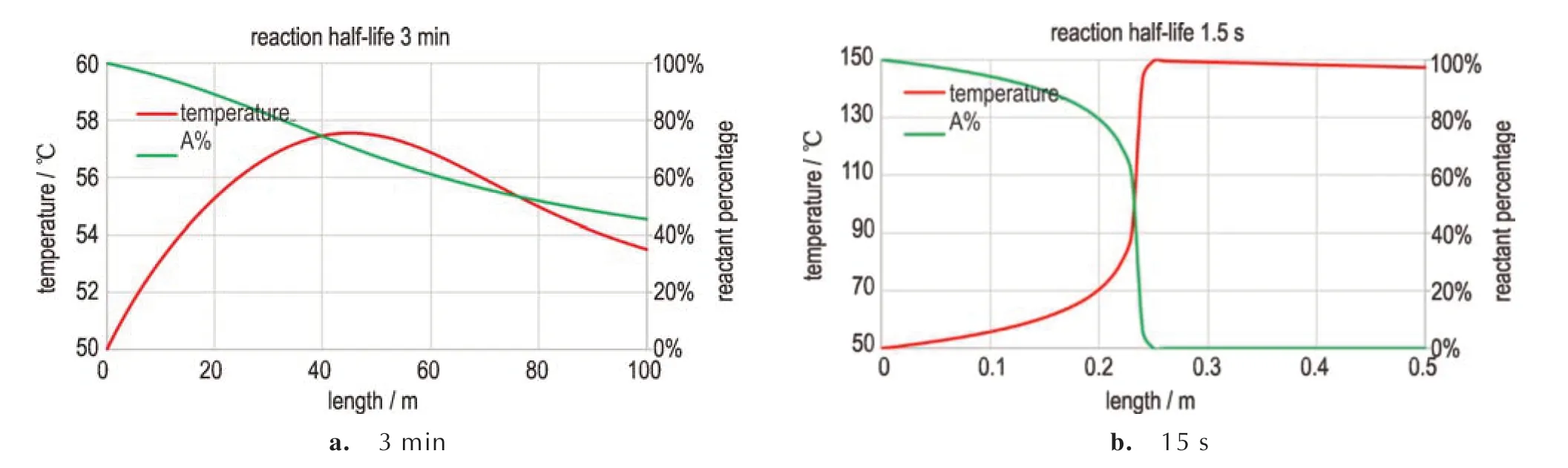
图6 不同半衰期的反应进入通道式反应器的温度和溶度变化(a.半衰期为3 min,b.半衰期为1.5 s)Fig.6 Variation of temperature and solubility of a reaction with different half-lives into a channel reactor (a.half-life of 3 min,b.half-life of 1.5 s)
对于半衰期为3 min 的反应1(图6a),反应产热导致物料温度从50 ℃开始缓慢上升,最高达到57.6 ℃,即管内外温差最大为7.6 ℃,达到最大温差之后,温度开始缓慢降低。在100 m 管长的反应器出口处,反应物A 的含量仍有45.2%,即反应的转化率为54.8%,反应未完全进行。此时增加管长较难实现完全反应,唯有提高温度加快反应速率,但是当反应速率过快时,可能会出现如图6b 所示的绝热温升问题。
对于半衰期为1.5 s 的反应2(图6b),反应产热导致物料温度从50 ℃快速上升到149.6 ℃,即管内外最大温差高达99.6 ℃,这一温度峰值出现在进口端仅0.25 m 处,此时反应物A 的转化率为100%。随后的99.75 m 管道只是用来冷却物料,不再发生任何反应。相比于3 min 半衰期的反应管长不够的情况,此快反应实际有效散热管长只有0.25 m,有效传热时间只有0.23 s,因此实际散热量很小(仅移除了0.4 ℃的热量),导致管内外最大温差几乎等于该反应的绝热温升。此外,热量累积导致实际反应温度不断升高,使反应速率和产热速率呈指数级增长,最终导致类似飞温反应的快速反应现象,直至反应物料被完全消耗掉,在通道式反应器进口端表现为绝热温升反应。
Frede 等[24]指出,对于半衰期小于1 min 的反应,连续流反应是一种非常合适的选择。但这类反应往往伴随着显著的绝热温升现象。因此,在通道式反应器中,通常需要采取一些措施来降低绝热温升反应所达到的最高温度以及相应的热安全风险。目前,常被推荐的策略包括溶剂稀释、物料预冷,以及减少管径或减少流速。为了验证这些策略的有效性,本研究利用图6b所示1.5 s 半衰期模型进行了计算,结果如图7 所示。

图7 常见改进绝热温升反应的温度问题措施的验证Fig.7 Validation of common measures to improve the temperature problem of adiabatic temperature rise reaction
图7 显示,首先,溶剂稀释对降低该绝热温升反应的高温问题有效。如图7a 所示,随着稀释倍数的增加,最高温度逐渐降低。该策略已被广泛应用在连续流反应体系中例如,在通道式反应器中进行浓硝酸浓硫酸的硝化反应时,通过调整浓硝酸与浓硫酸的摩尔比(1∶5~1∶10),可以显著稀释反应物料,从而降低反应的绝热温升。其次,物料预冷对降低该绝热温升反应的高温问题部分有效。如图7b 所示,当初始进料温度从50 ℃降低到25 ℃,最高温度也相应降低,然而,当进料温度从25 ℃再进一步降低时,最高温度基本维持不变。这是因为,刚降低进料温度到25 ℃虽然不改变反应的绝热温升,但降低了反应起始温度。但进一步降低时,当进料温度小于反应的引发温度(约25 ℃)时,前面部分管道内几乎不发生反应,夹套将对物料加热。当物料被夹套加热到引发温度后,物料才开始反应,即反应起始温度保持在引发温度不变,因此进一步降低进料温度对降低该绝热温升反应的高温问题帮助不大。最后,减少管径或降低流速对降低该绝热温升反应的高温问题无效。如图7c 所示,减少管径几乎不降低绝热温升反应的最高温度值,只是使得最高温度值出现位置后移。同样地,如图7d 所示,降低流速也不降低绝热温升反应的最高温度值,但会使最高温度值出现位置前移。
3 通道式反应器的反应安全评估方法
当某些反应具有爆炸风险时,该反应在连续流反应器内发生绝热温升反应很可能导致爆炸安全事故。为了防控这种反应带来的热安全高风险,需要建立一套连续流反应器的反应安全评估方法。本研究将讨论基于临界半衰期的安全评估方法。
3.1 临界半衰期
由于反应速率随反应温度变化较大,在不同温度下很难量化比较反应速率。因此,本研究采用了一种更为直观的方法:利用反应温度下的半衰期来界定通道式反应器体系内发生绝热温升反应的条件。保持其他条件不变考察了半衰期从62 s(较快)逐渐增加到180 s(较慢)的7 个反应,结果如图8 所示。可以看到,这些反应在通道式反应器内进行时,管内外最大温差出现的位置呈现自右往左且减少的趋势。换言之,慢反应的最大温差位置较快反应更迟出现且温差更小。这一现象可归因于慢反应时间更长,有效散热管长的增加,它延长了传热时间,增大了实际传热量和热量移除量,进而导致最大温差在管式反应器内逐步降低。

图8 不同半衰期的反应进入通道式反应器的温度和转化率变化(实线为温度,虚线为转化率)Fig.8 Variation of temperature and conversion rate of the reaction with different half-lives into the channel reactor (the solid line is the temperature and the dashed line is the conversion rate)
在含能材料通道式合成中,尤其需要重视安全问题。出于分解爆炸等安全方面考虑,反应过程中物料应尽量保持在较低温度,避免接近绝热温升温度。从这一角度看,反应的半衰期越长越有利。然而,半衰期太长的反应物料转化率变低,因此,需要在安全性和反应速率之间找到平衡,为了进一步明确可能导致安全问题的反应半衰期判断依据,本研究提出了一个相对保守的标准:以管内外最大温差位置处的转化率远小于1 作为判断依据。如果选择达到最大温差位置处依然有大部分物料未消耗作为标准来防范绝热温升反应时,该体系要求反应在反应温度下的半衰期不小于130 s。
此外,根据管内外最大温差位置处转化率远小于1 的判断依据,可用来推导通道式反应器的安全反应半衰期。在假设反应为一级反应的情况下,其半衰期可根据式(11)进行计算。
当反应不做绝热温升反应时,温度对管长的曲线会出现一个最高温度,结合式(9)~(11),可获得该极值点的温度表达式为式(12),即最高温度的计算公式。
式(12)中的半衰期t1/2为最高温度下的半衰期,而反应温度下的半衰期,由于半衰期跟温度严重耦合,导致最高温度和该半衰期都不能直接计算。
根据前面提出判断依据,即管内外最大温差位置处的转化率远小于1 的反应不太可能出现绝热温升反应,此时适用于式(13):
本研究计算得到图1 所示的通道式反应体系的最高温度下的半衰期为34.7 s。
尽管式(14)可用来直接计算半衰期,但所得结果是基于最高温度的半衰期(34.7 s),通常小于反应温度的半衰期(进口温度或导热油温度,130 s)。而实际应用中,更关注反应温度下的半衰期,因此本研究采用矫正方法如下:每当反应温度降低10 ℃,反应速率减半,从而半衰期翻倍。
已知上述通道式反应体系的绝热温升为100 ℃,前述假设最大温差为绝热温升的20%(即20 ℃),研究得到反应温度下的矫正后半衰期为139 s(原34.7 s的4 倍),该值比较接近于仿真计算(图8)获得的结果(130 s)。由此可以判断,当进入通道式反应器的反应半衰期小于139 s(或基于图8 的130 s)时,该体系可能出现绝热温升反应,或近似绝热温升的反应。
综上所述,本研究将通道式反应器的“临界半衰期”定义为可能引发绝热温升反应的反应半衰期,具体而言,如果某个反应在反应温度下的半衰期小于临界半衰期,那么它在相应的通道式反应器中进行时将可能出现绝热温升现象,随之带来热安全风险。本研究仿真计算的模型为一个较典型的通道式反应器体系,其临界半衰期为130 s。为了提升后续分析的普适性,我们采用了一个更加保守的临界半衰期值,即2 min。这意味着,如果某个反应在反应温度下的半衰期小于2 min,那么它在大多数通道式反应器中都有可能发生绝热温升反应或近似绝热温升的反应,从而可能引发爆炸反应的热安全风险。因此,通过考察通道式反应器的临界半衰期可评估其热安全风险,从而建立这类反应器的热安全风险评估方法。
3.2 评估方法
针对通道式反应器的反应安全风险评估,有学者提议将TD24改进为TDX,并结合《精细化工反应安全风险评估规范》(GB/T 42300-2022)[25]中的5 级反应工艺危险度分级方法来进行评估。其中x为通道式反应体系的滞留时间,如某通道式反应器滞留时间为几秒时,则TDX为TMRad(绝热条件下最大反应速率达到时间)为几秒所对应的温度。值得注意的是,这一国标主要是针对间歇过程在冷却失效工况下的反应风险危害等级评估,它基于4 个重要特征的温度参数:Tp(反应温度)、MTT(技术最高温度,一般指溶剂沸腾时的最小安全温度)、MTSR(工艺反应能够达到的最高温度)与TD24(绝热条件下的最大反应速率达到时间为24 小时对应的温度)[25-27]。
然而,在利用该方法来评估通道式反应体系的反应安全风险时,除了Tp外,其他3 个特征温度参数并不完全适用。首先,MTT不适合通道式反应体系,因为这些体系多为变压体系,反应器内根据汽液平衡关系改变压力,但很少出现溶剂沸腾的情况。其次,TD24或TDX也不适合通道式反应体系,源于管道冷却的夹套或恒温槽内依然存在大量的冷却液,管壁材料在冷却失效时也可以吸收大量的热量,绝热条件在通道式反应体系中出现的概率较低。此外,很多快反应的滞留时间只有几秒,但准确计算几秒钟的TMRad是一项极具挑战的工作。我们团队在之前的研究中发现,当使用ARC 实验测试时,如果温升速率过高(接近最大反应速率),可能会出现非绝热情况和严重的热滞后问题[28],这会导致在接近最大反应速率时的ARC 测量数据存在较大误差。因此使用ARC 数据拟合动力学再计算几秒钟的TMRad的误差很大。
最后,MTSR也不能直接用于通道式反应体系。一般情况下,MTSR是通过RC-1 实验直接测量,而快反应一般只能采用半间歇反应的测量方式,式15 为基于最大热累积度计算MTSR的关系式。
图9 展示了模拟半间歇反应过程的典型RC-1 测试数据。从图中可以看出,由于Xac(最大热累积度)的存在,MTSR实际仅比Tp高出15%的绝热温升。然而,在通道式反应体系中,由于缺少了滴加过程,反应物在进入端口时转化率为0,但当反应为快反应(例如半衰期小于2 min)时,反应可能在进口端的几十厘米内完成,转化率达到100%,并释放全部的反应热。由于快反应无法实现间歇反应的RC-1 测量,因此基于半间歇的RC-1 测量获得的MTSR完全不适用于通道式反应体系。因此,需要对目前常用的MTSR进行修正,去除式(15)中的Xac,并考虑通道式反应体系中100%绝热温升或最大绝热反应温度(TP+ΔTad)。为了与国标GB/T 42300-2022 中的MTSR进行区分,本研究将称其为100%MTSR。当对MTSR进行100%MTSR修正后,许多原本被认为是低风险的反应(1、2、3 级)可能会变为高风险的反应(4、5 级),如图10 所示。
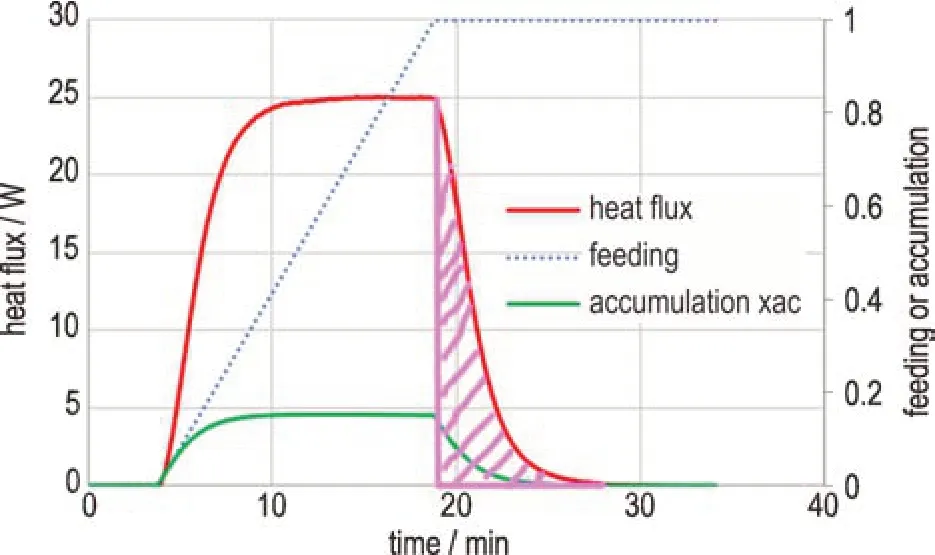
图9 典型的RC-1 测试数据(阴影部分为本测试的最大热累积,Xac为15%)Fig.9 Typical RC-1 test data (shaded portion is the maximum heat accumulation for this test, 15% Xac)

图10 100% MTSR 修正后反应等级变化示意图Fig.10 Schematic diagram of reaction grade change after 100% MTSR modification
鉴于4 个特征温度参数中3 个都不适合直接应用到通道式反应体系中,因此本研究不建议用国标GB/T 42300-2022 中的5 级反应工艺危险度分级方法来评估通道式反应器的反应安全风险,尤其热反应安全性要求较高的含能材料通道式合成。本研究提出一个综合考虑反应总放热量(严重性)和绝热温升反应发生的可能性来评估通道式反应体系反应安全风险的简单评估方法。根据文献[26, 29],当化学反应的总放热量大于800 J·g-1时,该反应具有爆炸潜力,因此以800 J·g-1作为化学爆炸的判断依据。通道式反应器内发生绝热温升反应的条件为反应半衰期小于临界半衰期(如图1 所示的反应器临界半衰期为2 min),临界半衰期可根据本文提出的方法进行计算(式14),可以判断通道式反应器内发生绝热温升反应的可能性。为了降低热安全风险,给出了具有热安全高风险的两大反应条件(由于通道式反应与其它连续流反应的相似性,以下判定标准也适用于其他连续流反应器):
(1)当目标反应产热总量大于800 J·g-1,而且该反应在反应温度下半衰期小于反应器的临界半衰期(如2 min),则该反应不适合在该反应器内做连续流反应(微通道、通道式反应等)。
(2)当分解反应产热总量大于800 J·g-1,且目标反应在反应温度下半衰期小于反应器的临界半衰期,同时分解反应在100% MTSR 下半衰期也小于该临界半衰期,则该反应也不适合在该反应器内做连续流反应(微通道、通道式反应等)。
其中满足第一条的反应一般都有反应活性很强的化学品参与反应,例如高浓度的强氧化剂跟有机物混合(如50%双氧水跟乙二醇),高浓度的强还原剂的氧化还原反应等;满足第二条的反应一般都有高能化学品的参与或直接合成高能化学品(如硝化物的参与或合成硝化物)。
对于不满足上述两条中任何一条的反应,做通道式反应时虽然发生化学爆炸的可能性较低,但发生绝热温升反应时反应温度控制将变得很难。而很多有机反应常常伴随多个副反应,一般温度升高时副反应速率大大增加,从而使得目标产物的收率严重下降。如苯硝化生产一硝基苯,目标产物为一硝基苯,副反应可产生二硝基苯、三硝基苯、或者硝基酚等等化学品。当在通道式反应器内发生绝热温升反应时,实际反应温度将大大升高,此时副反应反应速率增加,虽然不出现安全事故,但生产过程的经济性降低。因此,除了上面两条出于安全考虑的条件之外,另外一个从经济性考虑的不太适合通道式反应体系的反应条件:
(3)当反应目标产物选择性对温度特别敏感的体系,而且该反应在反应温度下半衰期小于反应器的临界半衰期(如2 min),则该反应也可能不适合在该反应器内做连续流反应(微通道、通道式反应等)。
3.3 评估方法应用案例
目前我国在大力推动微通道反应器、通道式反应器等在硝化企业的工业应用,但针对这类反应器在硝化工艺中可能发生的安全问题研究较少。本研究通过WISS 等[30]报道的氯苯二级硝化合成二硝基氯苯的反应为例来建立该类安全操作边界的计算方法。
文献[30]详细描述了氯苯(MCB)二级硝化合成二硝基氯苯(DNCB)的过程,其中涉及四个关键反应步骤(如图11 所示),分别为:反应k1 将MCB 转化为邻硝基氯苯(ONCB);反应k2 将MCB 转化为对硝基氯苯(PNCB);反应k3 将ONCB 转化为产物DNCB;反应k4 将PNCB 转化为产物DNCB。根据文中提供的动力学参数,计算出了反应k1~k4 在相应温度下的半衰期,并列于表4 中。从表中数据可以明显看出,k1和k2 在25 ℃为快反应,可快速将反应物MCB 转化为ONCB 和PNCB。值得注意的是,由于k2 比k1 更快,因此在两个反应竞争的过程中,更多的MCB 将倾向于转化为PNCB。如果k1 和k2 发生绝热温升反应,反应温度将升到85 ℃,在该温度下,k3 也是快反应,即ONCB 将快速转化为DNCB,不会出现ONCB 的累积;相反,在这一温度下,k4 为较慢的反应,导致PNCB会在反应中逐渐累积,并缓慢转化为最终产物DNCB。

表4 氯苯合成二硝基氯苯的四个目标反应的半衰期Table 4 Half-life of four target reactions for chlorobenzene synthesis of dinitrochlorobenzene
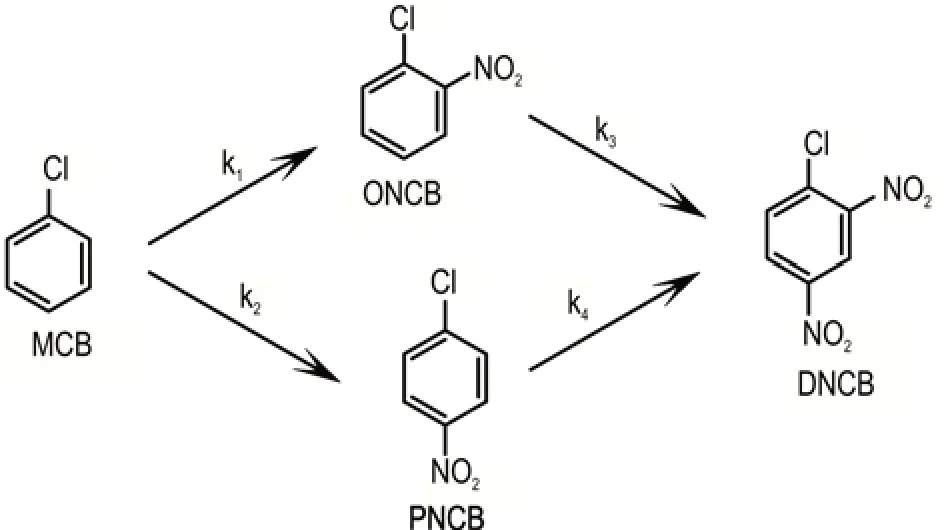
图11 氯苯合成二硝基氯苯的四个目标反应[30]Fig.11 Four target reactions for synthesis of dinitrochlorobenzene from chlorobenzene[30]
另外,文章中还提供了产物DNCB 的DSC 谱图,即DNCB 的热分解曲线,根据该曲线,可拟合出DNCB 的热分解动力学,如式(16)。
可以计算出该反应在176 ℃时半衰期为2 min(假设初始X0=0.01)。
根据文中报导的物料比例(摩尔比HNO3∶H2SO4∶MCB=1∶6.2∶0.5),其中硫酸稀释倍数为6.2,并控制总进料流速为5 L·min-1利用图1 所展示的模型,对该反应在通道式反应器内的温度和物料变化情况进行了详细的仿真计算。计算结果如图12 所示。
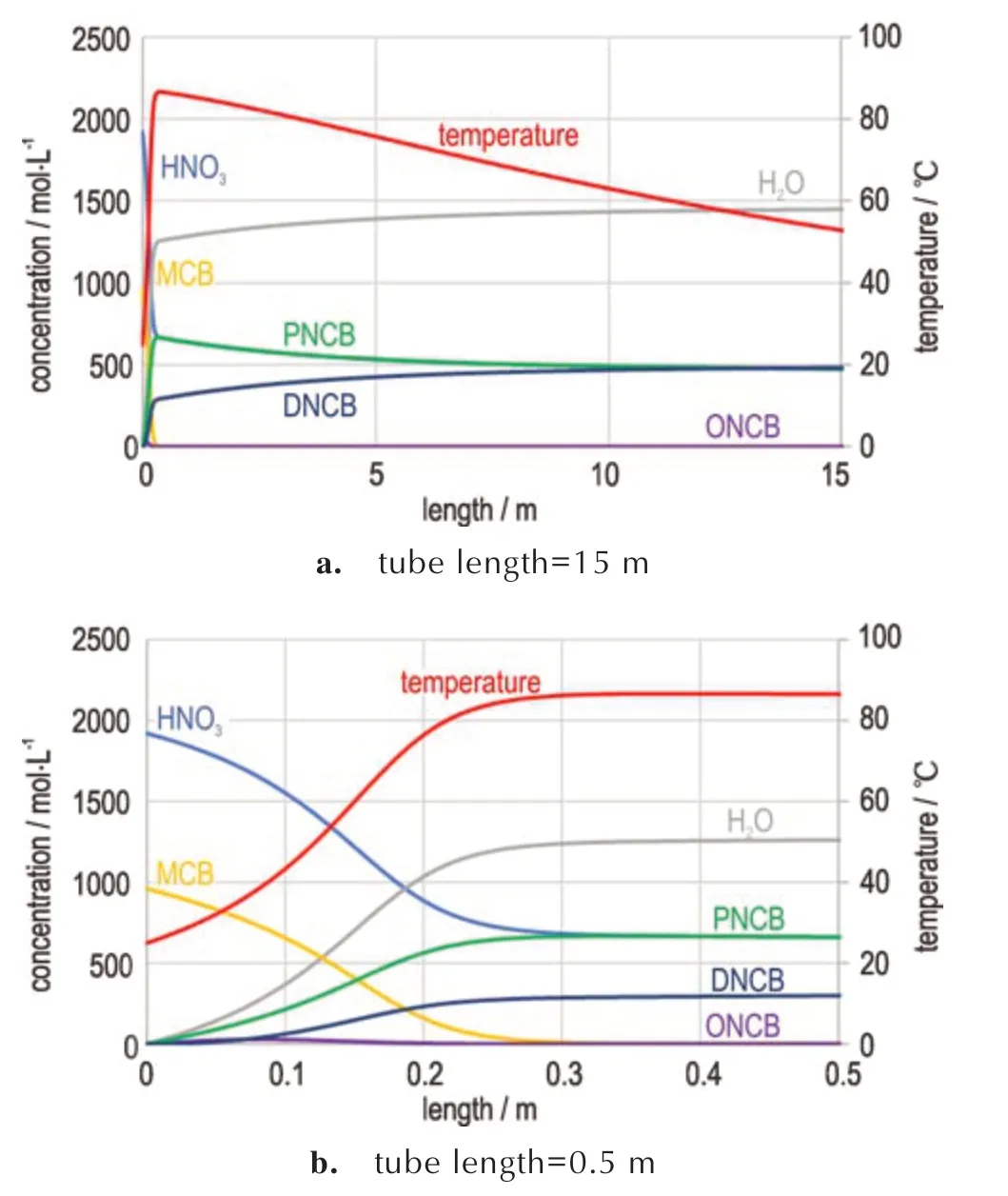
图12 硫酸稀释倍数为6.2 的氯苯二级硝化反应的通道式反应模拟结果Fig.12 Simulation results of the channel-based secondary nitration of chlorobenzene with sulfuric acid dilution of 6.2 times
如图12a 所示,部分目标反应在进口端的25 厘米内发生绝热温升反应,温度从初始的25 ℃急剧跃升至最高的87 ℃。发生反应的管路长度对应的滞留时间只有0.23 s。这意味着对反应散热的有效传热时间非常有限,导致总传热量极小,从而使得该反应近似于绝热温升反应。进一步观察图12b,可以看到物料进入管道后,在进口端的25 厘米范围内迅速发生了多个快反应,MCB 快速消耗掉,主要转化为PNCB 和DNCB。值得注意的是,PNCB 浓度约为DNCB 浓度的2 倍。其中PNCB 是通过k2 反应生成,而DNCB 是通过k1和k3 两个反应共同作用而来。由于k3 为快反应,反应过程中几乎没有ONCB 的累积而是直接转化为DNCB。相反,k4 为慢反应,在绝热温升反应段的转化率较低,因此PNCB 在这一区域累积并在后续的管道内逐渐转化为DNCB。随着反应的进行,管道的散热速率逐渐超过产热速率,导致后面的14.75 m 管道内,物料的温度不断降低。由于物料温度始终远低于DNCB 热分解反应的快反应对应温度(176 ℃),因此该体系并未出现DNCB 分解爆炸的风险。然而,需要注意的是,该通道式反应器的传热长度常数为16.5 m,这意味着实现充分传热需要管道长度达到66 m。因此,在当前15 m 长的管路出口处,物料的温度依然高达53 ℃。这表明,即使使用了15 m 的管道,仍然无法及时有效地冷却物料。
上述硫酸稀释倍数6.2 倍在实际生产中将消耗大量的硫酸,既增加原料成本,又增加了环保压力,因此需要研究降低硫酸稀释倍数。然而,这一调整可能涉及到反应体系热安全风险,另外,新工艺条件优化、实际生产时流量泵的潜在失效、流量控制系统的误差、以及启动过程中的程序失误等,这些都可能导致硫酸稀释倍数减少的工况发生。因此,需要明确硫酸稀释倍数的安全下限,即不发生安全事故的前提下,硫酸所能达到的最小稀释倍数。本研究以DNCB 的分解爆炸作为评估安全事故的关键指标。
将上述物料中的硫酸减半后(摩尔比HNO3∶H2SO4∶MCB=1∶3.1∶0.5),即硫酸稀释倍数降低至3.1倍时,通过同样的仿真计算,得到了如图13 所示的结果。在进口端的约6 厘米范围内,k1、k2 和k3 反应迅速发生绝热温升,由于惰性溶剂的减少,温度从25 ℃急剧上升至130 ℃。随后,k4 反应开始缓慢进行,将PNCB 逐渐转化为DNCB。由于物料温度比硫酸稀释倍数6.1 时高很多(130 ℃ vs.85 ℃),且物料溶度也相对更高,这导致绝热温升反应后管道内k4 反应速率的显著增加。这种增加使得产热速率超过了管道的散热速率,因此在管道长度超过6 cm 后,PNCB 的浓度随着管道长度的增加而降低,而温度则持续上升。在管道长度达到0.29 m 时,物料温度达到176 ℃,这是DNCB 半衰期小于2 min 所对应的温度。此时,DNCB 的分解反应在管道内发生绝热温升,即触发了分解爆炸反应,这最终可能导致管道爆炸的安全事故。基于这一系列的仿真计算和分析,可以得出该体系下硫酸稀释倍数的安全边界为4.07 倍。这意味着在实际生产过程中,必须确保硫酸的稀释倍数不低于该值,否则可能发生管道爆炸的安全事故。此外,微通道反应器、通道式反应器的其它重要操作参数的安全边界也可利用该方法确定。

图13 硫酸稀释倍数为3.1 倍的氯苯二级硝化反应的通道式反应模拟结果Fig.13 Simulation results of the channel-based secondary nitration of chlorobenzene with 3.1 dilution of sulfuric acid
4 结 论
通道式反应器的连续流反应工艺具有传热效率高、在线药量少等安全优点。然而,连续流反应在某些特定条件下仍然潜藏着热安全风险。目前,针对导致热安全风险条件的研究尚不充分,更缺乏有效的控制措施和科学的理论指导。本研究以通道式反应器为例,对连续流反应的热安全风险与控制措施进行探究,得到结论如下:
(1)通过建立反应器的传热量与反应的放热量平衡仿真模型,系统地分析了管道长度、流量流速以及反应放热对反应体系温度的影响,提出了以反应器传热长度常数作为评价散热效率的指标。研究结果显示,尽管通道式反应器的散热速率确实比釜式反应器提高了2 到3 个数量级,但要充分利用通道式反应器的散热效果,所需的管长通常不能低于4 个传热长度常数。以典型通道式反应器为例,实现完全散热所需管长高达66 m。当管道长度不足时,实际传热时间将大幅减少,从而限制了通道式反应器的实际传热量。
(2)通过研究基于半衰期的反应速率对体系温度和反应转化率的影响,半衰期小于2 min 的快反应在通道式反应器进口端几十厘米处发生绝热温升反应。常见降温的措施中,溶剂稀释对降低该绝热温升反应的高温问题有效;物料预冷对降低该绝热温升反应的高温度问题部分有效;而管径大小、流量流速降低对绝热温升反应的最高温度值无效。
(3)首次提出了以临界半衰期作为热安全判据的新方法。临界半衰期可通过模拟仿真计算确定,得到简易的计算方法(式14)。
(4)基于临界半衰期,进一步提出了连续流反应热安全风险评估方法,得到了具有热安全高风险的两大反应条件,包括:1)目标反应产热总量大于800 J·g-1,且该反应在反应温度下半衰期小于反应器的临界半衰期;2)分解反应产热总量大于800 J·g-1,目标反应在反应温度下半衰期小于反应器的临界半衰期,且分解反应在100% MTSR 下半衰期也小于该临界半衰期。另外,从经济性考虑,也不太适合连续流反应体系的反应条件;3)反应目标产物选择性对温度极为敏感,且该反应在反应温度下半衰期小于反应器的临界半衰期的体系。同时利用建立的方法以氯苯二级硝化反应为例,验证了本研究提出的热安全风险评估方法和控制措施的有效性,并确定了特定体系的硫酸稀释倍数的安全边界为4.07。
本研究不仅为连续流技术和工艺的安全边界研究提供了基础,还为连续流工艺边界和质量边界的确立提供了支撑借鉴,有望推动我国连续流工艺技术的安全高效地广泛应用。
物理量符号说明:
A:传热面积,m2
Cp:热容,J·g-1·K-1
D:管内径,m
Ea:活化能,kJ·mol-1
F:体积流速,m3·s-1
ΔHR:反应热,kJ·mol-1
L:管长,m
k:反应速率常数,mol·L-1·s-1
q:传热速率,W
Q:单位质量产热速率,W·kg-1
rA:反应速率,s-1
X:转化率
t:时间,s
T:温度,℃ or K
u:流速,m·s-1
U:总传热系数,W·m-2·K-1
V:体积,m3
z:微分管长
罗马字母:
ρ:密度,kg·m-3
τ:时间常数,s
τL:传热长度常数,m
下标:
c:冷却液
0:初始
½:半衰期
