假性甲状旁腺功能减退症Ⅰb型合并亚临床甲状腺功能减退症1例报告及文献复习
2024-03-26郑文静江黎晨张楠章诗琪薛丽萍胡红琳
郑文静,江黎晨,张楠,章诗琪,薛丽萍,胡红琳
作者单位:安徽医科大学第一附属医院内分泌科,安徽 合肥230022
假性甲状旁腺功能减退症(pseudohypoparathyroidism,PHP)是终末靶细胞甲状旁腺激素(PTH)抵抗导致以低血钙、高血磷、血清高PTH为主要特征的罕见遗传性疾病[1]。PHP特征性体征包括身材矮胖、圆脸、指(跖)骨畸形、智力发育障碍等Albright遗传性骨营养不良症(AHO)相关表现,但并非所有PHP均具有AHO体征[2]。本研究就安徽医科大学第一附属医院收治的1例PHPⅠb型合并亚临床甲状腺功能减退症病人的临床特点及诊疗经过进行回顾性分析,通过临床资料及基因检测确定疾病诊断及分型,分析亚临床甲状腺功能减退症与PHPⅠb型间相关性并进行相关文献复习,以期提高临床医生对该疾病的认知和诊疗水平。
1 资料与方法
1.1 一般资料 2022年3月31日于安徽医科大学一附属医院内分泌科收治1例PHPⅠb型合并亚临床甲状腺功能减退症病人。病人及其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 方法 (1)病史:女,56岁,因反复双下肢搐搦、乏力2年余入院。临床表现为双下肢伸展、抖动,伴颈部酸胀、抬头困难、双膝关节疼痛、下蹲及起立动作受限,发作时无大小便失禁及意识障碍等表现。上述症状反复出现且频率增加。(2)检测方法:行血常规、尿常规、粪便常规、肝功能、肾功能、甲状腺功能、血糖、血电解质、24 h尿电解质、皮质醇、肾素血管紧张素醛固酮水平、肾酸化功能等生化指标检测;行心电图、胸片、头颅CT、双手双足正侧位片、骨密度、双侧甲状腺、双侧甲状旁腺区、双肾、输尿管、膀胱B超等多学科综合检查评估并发症发生。(3)基因检测:乙二胺四乙酸(EDTA)抗凝管采两管静脉血各3.0 mL送至北京智因东方转化医学研究中心提取DNA后进行基因全外显子组测序。采用遗传学及分子生物学技术进行基因分析和筛选,PCR扩增目标序列并验证测序结果。
2 结果
2.1 一般情况 病人身高160 cm,体质量60 kg,身体质量指数(BMI)23.4 kg/m2,血压107/80 mmHg。病人神志清楚,智力发育正常,无圆脸、颈短,无第4掌骨或跖骨缩短,体格检查示心肺腹均无异常体征。肌力检查示四肢肌力Ⅴ级,肌张力正常。双足针刺觉、温度觉、震动觉、触压觉均无异常。面神经叩击征阳性,束臂加压试验阴性。双侧膝反射正常,生理反射存在。双侧巴宾斯基征(-),且无其他病理反射。病人足月顺产,年幼时说话迟,有高血压病史5~6年,已婚并育有一子,其子幼年检查出低钙但无四肢软瘫、肌无力等临床表现。病人月经初潮年龄14岁,月经持续5~7 d,月经周期28 d,绝经年龄53岁。否认父母近亲婚配,母亲有高血压病史,因脑卒中去世,父亲因腹泻放弃治疗去世(具体不详)。自述无家族性肿瘤史。
2.2 辅助检查 2022年3月28日本院门诊查PTH 429.00 ng/L(参考范围14.9~56.9 ng/L,下同),血电解质钙2.03 mmol/L(2.11~2.52 mmol/L),磷1.45 mmol/L(0.81~1.51 mmol/L),钾3.24 mmol/L(3.50~5.30 mmol/L)。2022年4月1日住院后查PTH 284.10 ng/L,血电解质钙1.86 mmol/L,钾3.63 mmol/L,磷1.69 mmoL/L,25羟维生素D 10.9 µg/L(>20 µg/L),24 h尿钾33.43 mmol/24 h(25.00~100.00 mmol/24 h),尿钙3.07 mmol/24 h(2.50~7.50 mmol/24 h),尿磷5.30 mmol/24 h(22.00~48.00 mmol/24 h)。治疗前后血电解质变化见表1。三碘甲状腺原氨酸1.1 nmol/L(0.92~2.79 nmol/L),甲状腺素59.80 nmol/L(58.10~161.30 nmol/L),促甲状腺激素5.539 µmol/L(0.55~4.78 µmol/L),甲状腺过氧化物酶抗体、甲状腺球蛋白抗体阴性。2022年4月2日查肾素血管紧张素醛固酮(立位):醛固酮126.79 ng/L(40~310 ng/L),血管紧张素Ⅱ 71.50 ng/L(49~252 ng/L),肾素14.46 ng/L(4~38 ng/L);肾素血管紧张素醛固酮(卧位):醛固酮199.65 ng/L(10~160 ng/L),血管紧张素74.59 ng/L(25~129 ng/L),肾素10.26 ng/L(4~24 ng/L)。肝功能、全套血脂、肾酸化功能、心肌酶谱、血糖、血常规、粪便常规、免疫十一项、性激素六项、皮质醇、生长激素、胰岛素样生长因子Ⅰ均未见异常。12导联心电图提示窦性心律,正常范围内心电图。眼科检查提示双眼底未见明显异常。甲状腺超声:甲状腺轻度弥漫性病变,左侧甲状腺结节(TI-RADS:3类),右侧甲状腺囊肿。胸部正位:两下肺斑点状,结节状致密影,心脏横径增大。骨密度:腰椎L1-4低骨量,股骨端wards三角骨质疏松,C7低骨量。头颅CT:双侧小脑半球、苍白球对称性钙化(图1)。手足双侧正位:右足第2跖骨远端低密度,双足骨质疏松改变(图2),双手未见明显骨质异常。

图1 假性甲状旁腺功能减退症病人头颅CT成像位片:双侧小脑半球、苍白球对称性钙化 图2 假性甲状旁腺功能减退症病人双足正侧位片:右足第2跖骨远端低密度
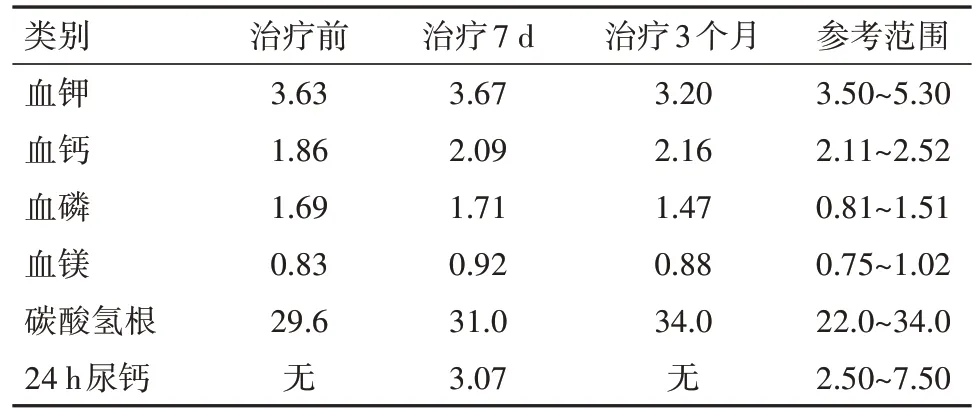
表1 治疗前后血电解质及24 h尿钙水平变化/(mmol/L)
2.3 基因测序结果 病人常染色体20 q 13.32的STX16基因exon5-6杂合缺失,GNAS A/B甲基化丧失(见图3)。该基因突变及表观遗传学异常与假性甲状旁腺功能减退症Ⅰb型(OMIM:603233)特征相符。先证者杂合denovo突变遵循常染色体显性遗传(AD)规律。根据ACMG评级,STX16基因exon5-6杂合缺失归类为可能致病(likely pathogenic):PVS1。
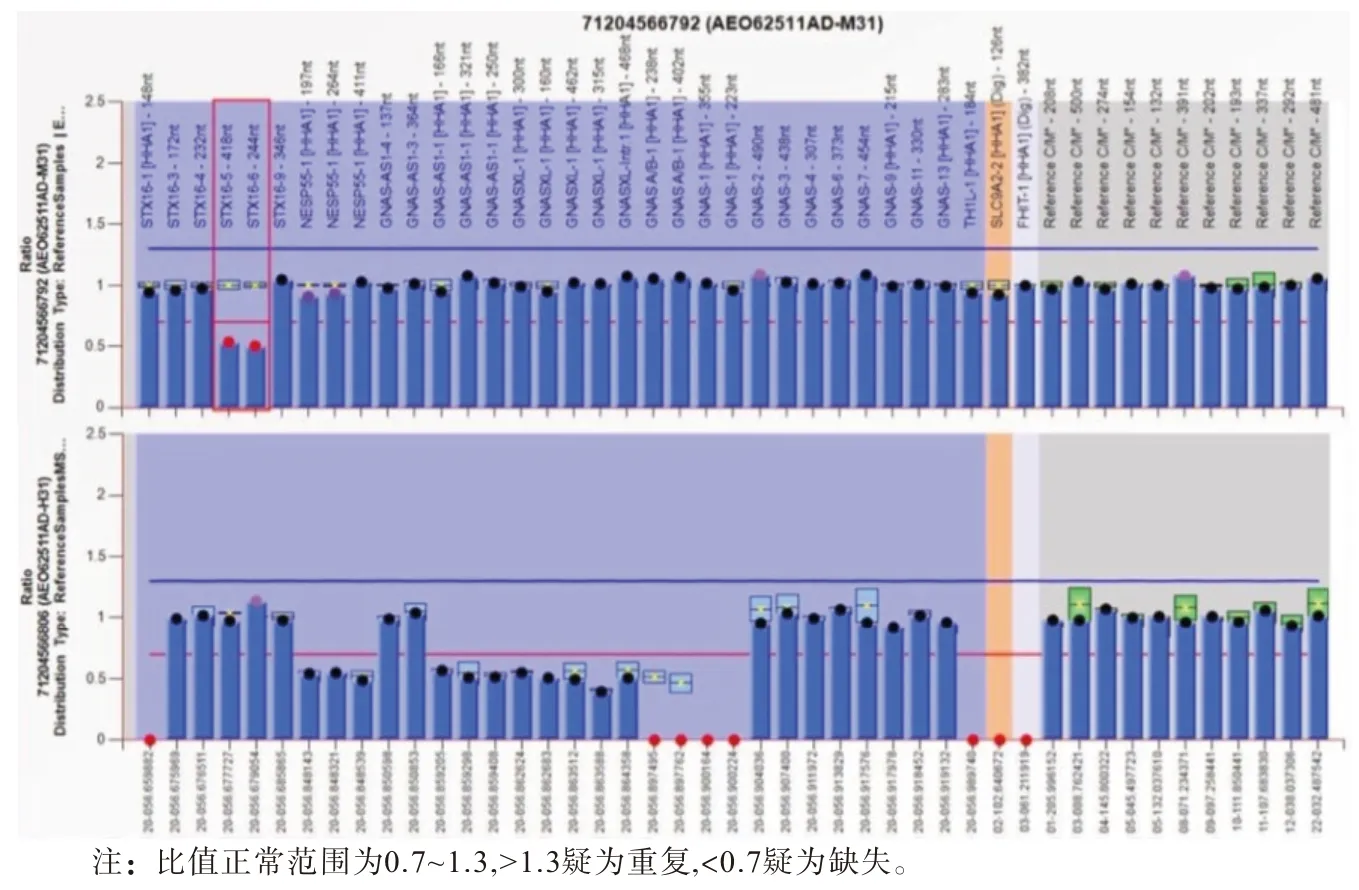
图3 假性甲状旁腺功能减退症先证者基因异常序列(红色线框标记STX16基因外显子拷贝数异常)
2.4 诊治经过 病人入院后予以每日口服维D钙咀嚼片600 mg及阿法骨化醇0.5 µg、肌内注射维生素D2一次补充钙及维生素D并监测电解质变化。病人经治疗后血钙水平接近正常标准(表1)但血磷水平仍高于正常值。病人入院时曾出现低钾,且病人既往有高血压病史,完善醛固酮立卧位检查及血皮质醇昼夜节律后,结果排除原发性醛固酮增多症及皮质醇增多症,病人治疗过程中未予补钾,入院后两次复查血钾均正常,考虑一过性低钾可能性大。2022年7月28日该病人出院3个月后复查除血钾仍稍低外血钙、磷、镁、碳酸氢根、24 h尿钙均至正常水平(表1),甲状腺功能基本同前。尚需长期随访监测上述指标以调整治疗方案。
3 讨论
PHP是一种罕见异质性疾病及最早发现的激素抵抗综合征。由Albright等[3]于1942年首次报道终末器官的PTH抵抗和低钙血症表现。
PTH对钙和磷酸盐稳态的重要调节作用由G蛋白偶联受体 (GPCR)和PTH相关蛋白1型受体(PTHR1)介导。PTH释放能够激活破骨细胞,促进肾脏合成1,25-二羟基维生素D,增加血清、远端肾小管及肠道中活性钙的吸收。而血磷酸盐主要通过抑制近端肾小管重吸收降低水平[4]。
GNAS是位于染色体20q13.3上高度复杂的印迹基因座[5],参与编码多种基因产物,可由父系、母系或双等位基因表达。GNAS基因除产生刺激性G蛋白α亚单位( Gsα)外还能够生成Gsα片段(XLαs)、外显子A/B、神经内分泌蛋白55(NESP55)和附加反义转录本AS。GNAS-AS、Gsα、XLαs、GNAS-A/B和GNAS-NESP55的启动子均位于GNAS基因包含的多个差异甲基化区域(DMR)[6-7]。其中父系GNAS表达XLαs、A/B及AS转录本,母系GNAS表达NESP55。而Gsα启动子因不参与亲本特异性甲基化故在多数组织中允许双等位基因表达,但在近端肾小管,甲状腺,下丘脑室旁核,棕色脂肪,卵巢和垂体等特殊组织中主要来自于母体等位基因[8-9]。依赖GNAS编码的G蛋白耦联受体α亚基(Gsα)信号传导通路异常(Gsα活性降低或下游信号通路中其他成分异常)可导致激素信号传递受阻,靶组织无应答,进而出现PTH抵抗/不敏感,导致低钙血症、高磷血症及继发性甲状旁腺功能亢进。根据外源性给予PTH刺激后尿中环磷酸腺苷的变化,PHP可分为PHPⅠ和PHPⅡ两种类型,以Ⅰ型更为常见,可分为Ⅰa、Ⅰb及Ⅰc型,各型发病机制不同,临床表现多样[10-11]。
本例病人中年起病,表现为以反复双下肢搐搦、乏力为主要特征的典型低血钙、高血磷以及PTH抵抗体征,补充维D钙咀嚼片及阿法骨化醇后症状明显好转,血钙磷等生化指标改善,故排除原发性甲状旁腺功能减退症。因肾功能和尿常规正常,排除继发性甲状旁腺功能减退症,考虑为PHP。为明确病因,同病人及家属沟通后,予以抽取病人血标本进行基因检测,结果提示GNAS复合体基因上游220kb处突触融合蛋白16(STX16)基因exon5-6杂合缺失,GNAS A/B甲基化丧失,确诊为PHPⅠb。遗憾的是,病人父母均去世,其父母及孩子未参加基因检测。PHPⅠb无GNAS突变,分为散发PHPⅠb和常染色体显性遗传的家族PHPⅠb。散发PHPⅠb是GNAS上游4个甲基化差异表达区域不同程度的广泛甲基化异常导致,最常为母源等位基因的GNAS-NESP:TSS-DMR过甲基化,而GNAS-ASI:TSS-DMR,GNASAS1:TSS-DMR,GNAS-XL:EX1-DMR和GNAS A/B:TSS-DMR低甲基化,少数由于父源单亲二倍体导致,大部分机制未明。家族性PHPⅠb是GNAS上游约220 kb初编码突触融合蛋白16(STX16)的基因部分缺失,导致GNAS A/B:TSS-DMR甲基化缺失。STX16是GNAS复合物基因座着丝粒(约250 kbs)编码突触融合蛋白16,为GNAS外显子A/B建立甲基化必需且调控Gsα基因于近端肾小管正常表达的关键基因。大多数常染色体显性遗传PHPⅠb(AD-PHPⅠb)是由STX16基因中第4~6号外显子3-kb缺失引起,继而引起GNAS外显子A/B甲基化(LOM)丧失,导致因Gsα表达降低所致肾PTH抵抗和PHPⅠb型发病[12-13]。结合本例病人基因序列分析结果可确定相应杂合缺失突变为致病原因。此外,个别家系报道STX16基因第2~4外显子4.4 kb大片段缺失及AS第3~4号外显子伴或不伴有NESP55缺失也与家族性PHPⅠb有关[14-15]。
本例病人合并亚临床甲状腺功能减退症但缺乏身材矮胖、圆脸、第4掌骨或跖骨缩短等典型AHO体征。既往研究表明,AHO体征多见于Ⅰa型或Ⅰc型病人,但有报道指出Ⅰb型病人AHO体征较为罕见而并非没有,本例病人无典型AHO体征。除PTH抵抗外PHP病人常出现其他激素抵抗,如促甲状腺激素(TSH)抵抗、生长激素释放激素(GHRH)抵抗、黄体生成素/卵泡刺激素(LH/FSH)抵抗,以TSH受累最为常见,多见于PHPⅠa病人。TSH升高是亚临床或甲状腺功能显著减退的证据,有学者发现在一些GNAS位点发生甲基化改变的PHPⅠb病人中观察到轻微TSH升高[16]。父系Gsa信号显著降低可能会导致母体GNAS突变而出现短暂或持续的TSH抵抗,即此种TSH抵抗是父系Gsa转录沉默与母体GNAS甲基化改变的共同体现。TSH升高是假性甲状旁腺功能减退症Ⅰb型的首要证据,部分PHPⅠb病人出现先天性甲状腺功能减退3~20年后出现PTH抵抗,因此应对无法解释的甲状腺功能减退症病人长期随访PTH、钙、磷酸盐水平并行基因检测。本例病人血中促甲状腺素水平升高, 游离血清游离三碘甲状腺原氨酸、血清游离甲状腺素正常,甲状腺抗体阴性,甲状腺超声示轻度弥漫性病变,暂无甲状腺功能减退的临床表现,考虑亚临床甲状腺功能减退可能,亦不排除PHPⅠb相关的TSH抵抗可能。目前病人尚未达治疗指征,建议随访监测甲状腺功能。既往研究表明AHO见于PHPⅠa型或Ⅰc型病人,近来有学者提出极少数Ⅰb型病人亦合并有AHO体征。本例病人合并亚临床甲状腺功能减退且无AHO体征。因此,仅依据临床特征分析无法准确判断分型,仍需结合遗传学资料、分子生物学检测和影像学检查进行最终诊断。
PHP典型临床表现为低血钙、高血磷及PTH升高,易出现脑、软组织、脊柱旁韧带等部位钙盐沉积,以颅内异位钙化最严重[17]。本例病人头颅CT示双侧小脑半球、苍白球对称性钙化,考虑PHP导致的基底节钙化。目前PHP治疗原则同原发性甲状旁腺功能减退症一致,仅对症治疗:(1)急性低钙血症时期需积极补钙及监测血钙水平,避免高钙血症所致恶性心律失常发生。出现严重低钙血症导致抽搐时,可缓慢静脉推注10%葡萄糖酸钙10 mL+葡萄糖注射液10 mL,症状通常迅速缓解;若反复出现低钙血症导致抽搐,需按50 mL/h静脉滴注10%葡萄糖酸钙100 mL+5%葡萄糖液1 000 mL;若出现抽搐难以缓解,可肌内注射地西泮或苯妥英钠以迅速控制痉挛。(2)间歇期需长期治疗,提倡活性维生素D(骨化三醇)、钙剂联合应用,剂量需根据个体化定制方案并相互调节。骨化三醇的半衰期为2~3 h,通常以0.25~0.50 µg的起始剂量每日至少服用2次。钙剂用量取决于血钙水平及膳食钙摄入量,通常钙剂每天补充1~2 g即可将血钙水平提高至正常范围,同时膳食中需添加钙[18-19]。治疗期间须注意:(1)应用钙剂及维生素D控制临床症状,不需提升血钙至正常水平,血清钙宜保持在2.00~2.25 mmol/L;(2)尿钙不宜过高(24 h尿钙应低于400 mg)以避免尿路结石、肾钙质沉积和肾功能减退,并防止维生素D中毒;(3)避免摄入奶制品、肉、豆制品等高磷食物加重异位钙化;(4)为降低尿路结石风险可给予噻嗪类利尿剂口服,但长期使用噻嗪类利尿剂易流失尿钾,需补钾预防低钾血症;(5)定期复查血钙、血磷、血钾、血清PTH及头颅CT等检查。
综上所述,本研究通过对1例PHPⅠb合并亚临床甲状腺功能减退症病人相关临床资料进行分析,进一步运用分子生物学手段进行基因突变检测明确诊断,提高了对PHPⅠb的发病机制、临床特征及合并症的认识。临床工作中如遇到原因不明的甲状腺功能减退病人,应考虑到罕见病PHP可能,定期检测PTH、钙、磷水平,必要时完善基因检测,以便早期诊断、及时对症治疗,以免误诊、漏诊。
