Toll样受体2对儿童肺炎支原体肺炎肺部炎症表现和肿瘤坏死因子-α的调节作用
2024-03-26刘满菊王小稳陈丹邰亚辉孙晓敏
刘满菊,王小稳,陈丹,邰亚辉,孙晓敏
作者单位:郑州大学附属儿童医院西区门诊部,河南 郑州450000
肺炎支原体肺炎(MPP)占儿童社区获得性肺炎的10%~40%[1],难治性肺炎支原体肺炎(RMPP)病儿临床症状或影像学表现难以改善甚至继续进展,可导致预后不良[2]。RMPP的发病机制尚不清楚,过度免疫反应是肺炎支原体(MP)感染引起的多系统症状和RMPP的重要因素[3]。Toll样受体(TLR)是一种模式识别受体,激活后通过衔接蛋白MyD88发出信号,对促炎细胞因子表达发挥作用,并将免疫细胞募集到感染部位。研究表明,TLR是MP的重要受体,其中TLR2可能与MP感染引起的过度炎症密切相关[4]。还有研究显示,RMPP病儿血清肿瘤坏死因子-α(TNF-α)水平显著高于非RMPP病儿[5]。本研究旨在探讨TLR2对儿童肺炎支原体肺炎肺部炎症表现和TNF-α的调节作用。
1 资料与方法
1.1 一般资料 选取2021年1月至2022年1月郑州大学附属儿童医院诊治的MPP病儿27例,其中RMPP病儿12例、非RMPP病儿15例。
纳入标准:①入院时有肺炎的体征和症状;②胸片上有肺炎浸润;③鼻咽抽吸物中检测出MP阳性(≥1.0×104DNA copies)。排除标准:①年龄>14岁;②鼻咽分泌物经免疫荧光技术检测为呼吸道合胞病毒、流感病毒、腺病毒、副流感病毒阴性,核酸检测为沙眼衣原体等其他病原体;③鼻咽分泌物细菌培养和双阴性血培养阳性。RMPP根据下列标准诊断[6]:①持续发热7 d或更长时间,②持续高热、顽固刺激性咳嗽,或出现肺外并发症等多系统损害,③使用抗生素治疗后咳嗽和胸片浸润增加。选取非感染病儿12例作为对照。入院后收集外周血2 mL,半径10 cm、1 000×g下离心10 min,血清保存在-80 ℃冰箱备用。本研究符合《世界医学协会赫尔辛基宣言》相关要求,所有病儿监护人均签署了知情同意书。
1.2 实验方法
1.2.1 细菌菌株和培养条件 标准MP菌株来自中国典型培养物保藏中心(CCTCC),菌株在支原体肉汤培养基中培养,每2天刷新一次培养基,培养5~6 d后,培养基颜色从红色变为黄色,表明MP处于对数生长阶段。
1.2.2 细胞培养 A549细胞(CCTCC)在10%胎牛血清(FBS)的Duibeco改良eagIe培养基(DMEM)中培养。使用人中性粒细胞分离试剂盒在采集后2 h内从外周血样中提取中性粒细胞。用含10% FBS的RPMI-1640培养基在37 ℃,5%二氧化碳培养箱中培养。
1.2.3 细胞治疗 在显微镜下对每个非感染病儿的外周血中性粒细胞进行计数,并将其分为阴性对照(NC)组和MP刺激组。每份约106个细胞接种在6孔板中。MP通过肺炎支原体核酸检测试剂盒进行定量。定量后用磷酸盐缓冲液(PBS)悬浮洗涤2次,最后用RMPI-1640培养基重新悬浮至浓度108个细胞/mL。MP刺激组以100∶1的感染率向中性粒细胞添加1 mL MP混悬液,NC组向中性粒细胞中添加1 mL RMPI-1640培养基。然后在37 ℃,5%二氧化碳的细胞培养室中培养6 h。
将A549细胞接种在10%FBS的DMEM培养基6孔板中。增长到面积的50%时,MP刺激组添加1 mL 108/mL MP混悬液,NC组加入1 mL细胞培养液。NF-κB抑制组在培养基中补充100 µmol/L的NF-κB抑制剂吡咯烷二硫代氨基甲酸铵(PDTC)预处理1 h,同时加入1 mL 108/mL MP混悬液。MyD88抑制组用100 µmol/L的MyD88抑制剂NBP2-29328预处理24 h。当细胞生长至50%密度时,加入1 mL 108/mL MP混悬液培养12 h。
1.2.4 TNF-α表达测量 使用酶联免疫吸附测定(ELISA)试剂盒,在450 nm处测量吸光度,并根据标准曲线计算血清TNF-α表达。
1.2.5 实时荧光定量聚合酶链反应(RT-qPCR)RT-qPCR方法如以往研究所述[7],用TRIzol试剂分离外周血中性粒细胞RNA,并使用随机引物和逆转录酶将其反转录为cDNA。使用基因特异性引物和AceQ qPCR SYBR Green Master Mix预混液(低ROX)在AppliedBiosystems7500系统上运行RT-qPCR。使用人TLR基因的引物序列检测靶基因表达水平,并将其标准化为甘油醛-3-磷酸脱氢酶(GAPDH)mRNA水平,并使用2-ΔΔCt方法测定相对表达。见表1。

表1 TLR基因的引物序列
1.2.6 蛋白质印迹法 为了检测A549细胞中p-p65和Myd88的蛋白表达,使用总蛋白提取试剂盒提取A549细胞蛋白。用Bradford法测定蛋白质含量。在Tris/HCl缓冲系统中使用12%十二烷基硫酸钠聚丙烯酰胺凝胶对等量的蛋白质(30 µg蛋白质/泳道)进行电泳,然后将电泳转移至聚偏二氟乙烯微孔膜。随后在室温下用5%脱脂乳密封膜2 h,并与稀释1/1 000的GAPDH、NF-κBp65和MyD88抗体在4 ℃下孵育过夜。再用含有TBST的Tris缓冲盐洗涤5次后,使用合适的第二抗体和增强化学发光系统完成免疫检测。使用Image Lab成像系统进行条带的光密度扫描,确定每个条带的积分光密度值(IOD),并进行光密度扫描分析。
1.2.7 流式细胞分析 A549细胞在6孔板中生长至接近汇合,并用MP(MOI 1∶100)培养12 h,然后在胰蛋白酶孵育后收获。将细胞悬浮液在300×g下离心10 min,并将颗粒细胞重新悬浮在PBS中(在80µL PBS中最多107个有核细胞)。向细胞悬浮液中加入20 µL FcR阻断试剂,持续10 min。然后,加入2.5 µL APC标记的抗人TLR4抗体和2.5 µL PE标记的TLR2抗体,将混合物在2~8 ℃的黑暗环境中培养10 min。在1~2 mL PBS中洗涤细胞,并在半径3 cm、300×g下离心10 min。将获得的A549细胞重新悬浮在300 µL PBS中,通过流式细胞仪检测。
1.2.8 siRNA介导的基因敲除 使用核糖体提取试剂盒将特异性人TLR2 siRNA或对照siRNA转染汇合30%~50%的A549细胞48 h,然后在37 ℃,5%二氧化碳下感染MP(MOI=1∶100)24 h,通过ELISA试剂盒测定上清液中的细胞因子。
1.3 统计学方法 使用SPSS 24.0统计学软件进行数据分析,计量资料以描述,两组比较采用t检验,多组比较采用单因素方差分析(SNK-q检验),计数资料采用例(%)描述,采用χ2检验进行比较。所有检验均为双尾,P<0.05为差异有统计学意义。
2 结果
2.1 病儿一般资料及MPP病儿临床特征比较MPP组男11例、女4例,年龄(4.60±1.76)岁,RMPP组男8例、女4例,年龄(5.35±1.11)岁,NC组男6例、女6例,年龄(5.18±1.54)岁,三组病儿性别年龄差异无统计学意义(P>0.05)。RMPP病儿胸腔积液和肺不张发病率高于MPP(P<0.05),其他临床特征两组差异无统计学意义(P>0.05),见表2。

表2 MPP病儿15例与RMPP12例临床特征比较
2.2 MPP病儿血清TNF-α和中性粒细胞TLR mRNA水平 MPP病儿血清TNF-α水平高于NC组,且RMPP组高于MPP组(P<0.05)。RMPP组外周血中性粒细胞TLR1和TLR2mRNA高于MPP组(P<0.05)。MPP组TLR2 mRNA高于NC组(P<0.05)。TLR4和TLR6 mRNA表达三组间差异无统计学意义(P>0.05),见表3。
表3 RMPP、MPP和NC组病儿TNF-α和TLR mRNA水平比较/

表3 RMPP、MPP和NC组病儿TNF-α和TLR mRNA水平比较/
注:NC为对照,MP为肺炎支原体,RMPP为难治性肺炎支原体,TNF-α为肿瘤坏死因子-α,TLR为Toll样受体。①与NC组比较,P<0.05。②与MPP组比较,P<0.05。
组别NC组MPP组RMPP组F值P值TLR6 mRNA/×10-3 51.29±13.77 48.77±15.15 49.29±13.77 1.23 0.136例数12 15 12 TNF-α/(ng/L)43.46±19.55 101.15±40.98①244.43±93.29①②5.91<0.001 TLR1 mRNA/×10-4 4.49±1.98 6.36±2.78 14.49±6.16①②6.68<0.001 TLR2 mRNA/×10-2 7.40±3.32 13.89±5.11①20.40±8.32①②4.77 0.016 TLR4 mRNA/×10-2 15.87±6.29 17.59±8.08 19.05±8.29 0.22 0.521
2.3 MP刺激增强TNF-α和TLR2表达 MP刺激组的TNF-α和TLR2表达在中性粒细胞和A549细胞中显著增加(P<0.05)。见表4。
表4 中性粒细胞和A549细胞中两组TNF-α、TLR2和TLR4表达/
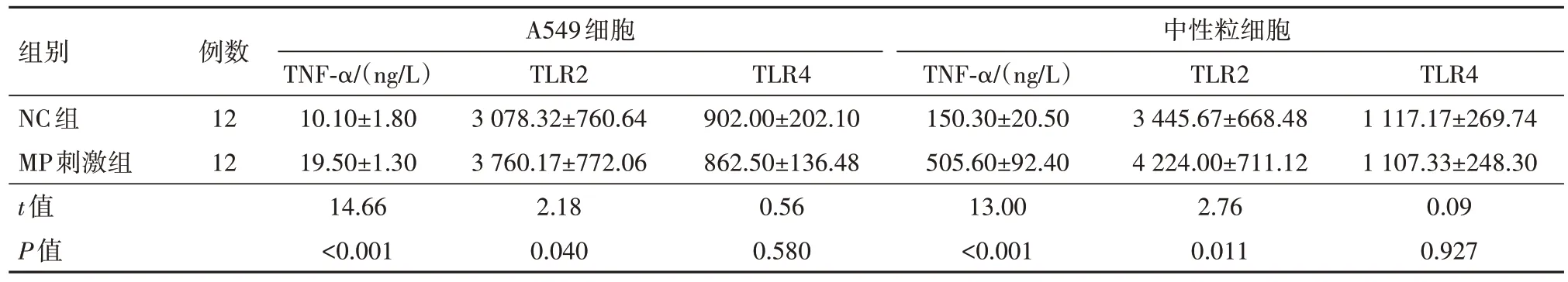
表4 中性粒细胞和A549细胞中两组TNF-α、TLR2和TLR4表达/
注:NC为对照,MP为肺炎支原体,TNF-α为肿瘤坏死因子-α,TLR为Toll样受体。
组别NC组MP刺激组t值P值A549细胞中性粒细胞TLR4 1 117.17±269.74 1 107.33±248.30 0.09 0.927例数12 12 TNF-α/(ng/L)10.10±1.80 19.50±1.30 14.66<0.001 TLR2 3 078.32±760.64 3 760.17±772.06 2.18 0.040 TLR4 902.00±202.10 862.50±136.48 0.56 0.580 TNF-α/(ng/L)150.30±20.50 505.60±92.40 13.00<0.001 TLR2 3 445.67±668.48 4 224.00±711.12 2.76 0.011
2.4 TLR2敲除抑制TNF-α表达 用靶向TLR2的siRNA转染A549细胞后,与siNC组相比,在TLR2沉默的细胞中MP刺激诱导的TNF-α表达受到显著抑制(P<0.05),见表5。
表5 ELISA测定对照组或MP感染的A549细胞中TNF-α的分泌/(ng/L,)
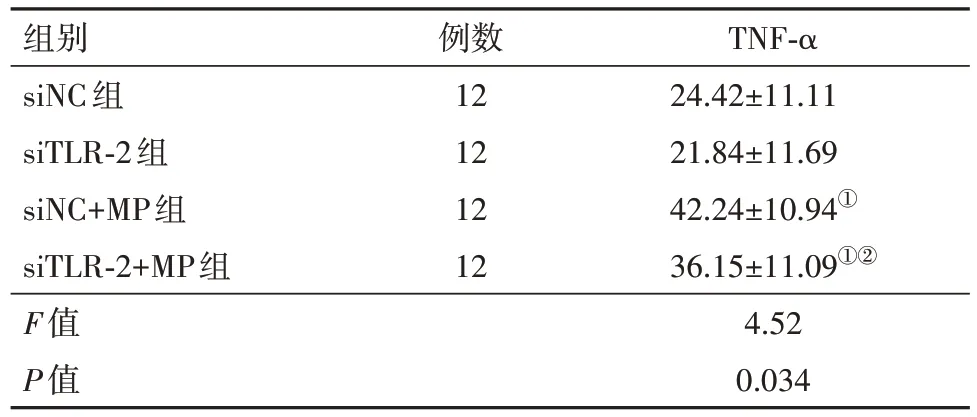
表5 ELISA测定对照组或MP感染的A549细胞中TNF-α的分泌/(ng/L,)
注:siNC为靶向TLR2的siRNA转染的对照,siTLR-2为靶向TLR2的siRNA转染的Toll样受体2,MP为肺炎支原体。①与siNC组比较,P<0.05。②与siNC+MP组比较,P<0.05。
例数12 12 12 12 TNF-α 24.42±11.11 21.84±11.69 42.24±10.94①36.15±11.09①②4.52 0.034组别siNC组siTLR-2组siNC+MP组siTLR-2+MP组F值P值
2.5 MP刺激增强TLR相关信号分子的表达Western blotting结果显示,MP刺激后A549细胞中MyD88和NF-κB p65表达均明显增加(P<0.05),见图1,表6。

图1 肺炎支原体刺激的A549细胞中MyD88(A)和NF-κB p65(B)的蛋白质印迹图像
表6 肺炎支原体刺激的A549细胞中MyD88和NF-κB p65的表达变化/

表6 肺炎支原体刺激的A549细胞中MyD88和NF-κB p65的表达变化/
注:NC为对照,MP为肺炎支原体,PTDC为吡咯烷二硫代氨基甲酸铵,GAPDH为甘油醛-3-磷酸脱氢酶。①与NC组比较,P<0.05。
NF-κB p65/GAPDH 1.00±0.00 1.84±0.69①0.78±0.16①0.88±0.19①(0.22)0.521组别NC MP PDTC PDTC+MP t(F)值P值例数12 12 12 12 MyD88/GAPDH 1.00±0.00 1.68±0.28①13.74<0.001
2.6 阻断Myd88或NF-κB减弱MP刺激TNF-α表达 抑制MyD88或NF-κB后用MP刺激A549细胞显示,PDTC和NBP2-29328均可显著抑制MP诱导的TNF-α表达增加,见表7。
表7 阻断Myd88或NF-κB减弱MP刺激TNF-α表达/(ng/L,)
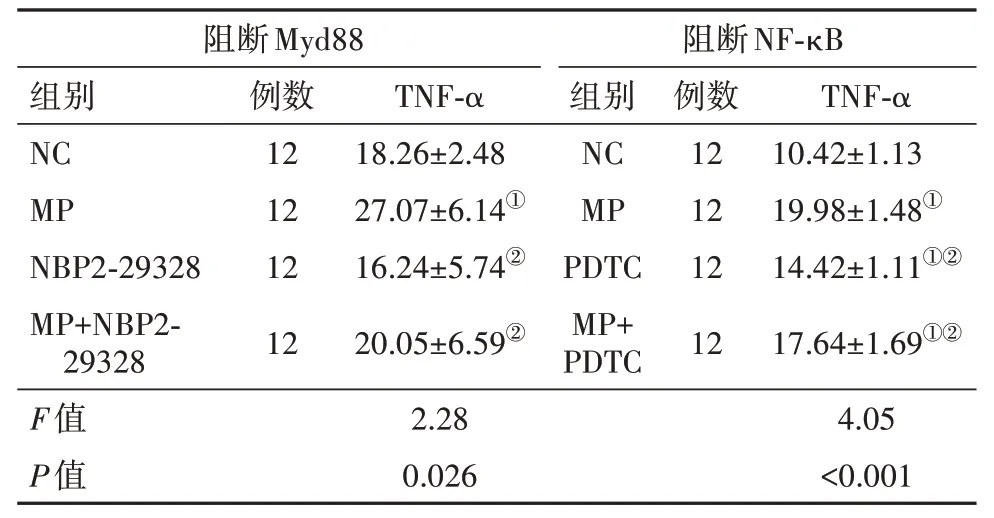
表7 阻断Myd88或NF-κB减弱MP刺激TNF-α表达/(ng/L,)
注:NC为对照,MP为肺炎支原体。①与NC组比较,P<0.05。②与MP组比较,P<0.05。
阻断Myd88阻断NF-κB组别TNF-α例数TNF-α组别例数NC MP NBP2-29328 MP+NBP2-29328 F值P值10.42±1.13 19.98±1.48①14.42±1.11①②17.64±1.69①②4.05<0.001 12 12 12 12 18.26±2.48 27.07±6.14①16.24±5.74②20.05±6.59②2.28 0.026 NC MP PDTC MP+PDTC 12 12 12 12
3 讨论
近年来,我国MPP发病率不断上升,5岁以上儿童的感染率高达70%,MPP可导致急性呼吸道炎症以及肺外综合征,过度炎症反应易引起不良临床结果[8],了解炎症介导的组织损伤的作用机制对预防和治疗该病导致的严重并发症具有重要意义。
上皮细胞具有分泌TNF-α的功能,黏附上皮细胞是MP致病的第一步,肺部炎症和全身过度炎症的发生可能是由MP和TNF-α共同刺激引发的中性粒细胞炎症级联反应介导的[9]。本研究显示,MPP病儿血清TNF-α水平明显高于NC组,RMPP组明显高于MPP组(P<0.05)。中性粒细胞是重要的炎症细胞,多形核中性粒细胞在MPP病儿的支气管肺泡灌洗液和外周血中显著增加[10]。在毒素诱导的肺损伤模型中,肺泡巨噬细胞可通过分泌TNF-α调节中性粒细胞募集[11]。之前的研究证实,MPP病儿外周血中性粒细胞显著升高,尤其是RMPP病儿,因此中性粒细胞可能参与MPP的过度炎症、肺炎和肺损伤[12]。本研究中,中性粒细胞TLR1、TLR2、TLR4和TLR6的mRNA水平在MPP病儿中显著增加,且RMPP组高于MPP组(P<0.05),此外中性粒细胞和A549细胞经MP刺激后TNF-α和TLR2表达显著增加(P<0.05)。TLR2在感染后气道高反应性和慢性气道炎症的发展中起关键作用,Ju等[13]发现缺乏或抑制TLR2不仅可以防止博莱霉素诱导的炎症,还能通过逆转博莱霉素诱导的纤维化组织中的免疫抑制微环境来防止和逆转进行性肺纤维化。Jung等[14]确定TLR-2可通过激活细胞内信号通路导致NF-κB易位及TNF-α和IL-1β分泌,是介导博莱霉素刺激的肺部炎症和纤维化的关键受体。NF-κB位于TLR信号下游的关键位置,参与炎症分子的调节、细胞凋亡、应激反应和肿瘤生长抑制等多种生理和病理过程,活化的NF-κB调节IL-4、IL-6、IL-8和TNF-α等炎症因子的表达,并引发炎症反应[15]。MyD88是TLR激活NF-κB的重要途径,研究表明,TLR2-MyD88-NF-κB途径与急性肺损伤、慢性阻塞性肺炎、哮喘、肺癌等肺部疾病的发生密切相关[16-17]。MP是一种无细胞壁微生物,细胞膜上的脂蛋白暴露于免疫细胞,因此TLR2是参与MP识别的最重要的TLR[18-19]。本研究侧重于TLR2在MPP疾病中的作用,结果显示,MP刺激后A549细胞中TLR2、MyD88和NF-κBp65水平明显升高,而在抑制TLR2、MyD88或NF-κB后,MP诱导的TNF-α表达明显降低。表明TLR2-MyD88-NF-κB途径在MP诱导TNF-α产生中起重要作用。
综上所述,TLR2可能通过TLR2-MyD88-NF-κB途径介导TNF-α的表达并参与了肺部炎症反应。TLR2的表达水平可作为潜在的MPP严重程度的判断指标。
