肾衰宁颗粒联合还原型谷胱甘肽治疗维持性血液透析慢性肾功能衰竭的临床研究
2024-03-26卞宝花刘红
卞宝花,刘红
1.连云港市第四人民医院 血透室,江苏 连云港 222000
2.连云港市第四人民医院 肾内科,江苏 连云港 222000
慢性肾衰竭的终末期典型症状为水电解质、酸碱失衡,导致大量代谢产物潴留,累及全身各系统器官,难以通过保守治疗加以控制,临床需采取血液透析进行治疗[1]。临床治疗慢性肾功能衰竭的原则为积极控制原发病,延缓疾病进展,其中常见药物包括利尿剂、降压药、铁剂、重组人促红素等[2]。还原型谷胱甘肽能有效提高患者红细胞内谷胱甘肽水平,进而增强机体抗氧化能力,稳定红细胞膜,延长红细胞寿命,还能加快氧化自由基排泄,改善红细胞变形能力,发挥治疗慢性肾衰竭的作用[3]。肾衰宁颗粒可活血祛瘀、泄浊通腑、健脾益气,用于多种原因引起的慢性肾衰竭[4]。本研究对维持性血液透析慢性肾功能衰竭患者使用肾衰宁颗粒联合注射用还原型谷胱甘肽治疗,探讨治疗效果。
1 资料与方法
1.1 临床资料
选取2023年1~10月在连云港市第四人民医院就诊的80例维持性血液透析慢性肾功能衰竭患者。其中男34例,女46例;年龄48~81岁,平均年龄(63.51±8.29)岁;肾功能衰竭病程2~10年,平均(5.28±1.37)年;透析时间4个月~2年,平均透析时间(1.09±0.36)年;原发病高血压肾病26例、肾小球肾炎37例、糖尿病肾病17例。本研究经连云港市第四人民医院伦理委员会批准(批号:22110312LL号)。
纳入标准:(1)符合慢性肾功能衰竭的临床诊断标准[5];(2)在医院持续进行血液透析治疗;(3)患者阅读并签订知情同意书;(4)残余肾功能,病情稳定。
排除标准:(1)其他器官功能不全;(2)对肾衰宁颗粒、还原型谷胱甘肽明确过敏;(3)恶性肿瘤;(4)血液系统、内分泌系统、免疫系统病变;(5)全身感染性疾患;(6)精神状态异常;(7)肾动脉狭窄、肾病综合征等病变;(8)其他因素需血液透析治疗;(9)胃肠道器质性病变;(10)肾移植、肾手术史。
1.2 药物
肾衰宁颗粒由山西德元堂药业有限公司生产,规格5 g/袋,产品批号202212042、202304113。注射用还原型谷胱甘肽由重庆药友制药有限公司生产,规格0.3 g/支,产品批号20221114、20230326。
1.3 分组与治疗方法
根据随机数字表法将所有患者分为对照组和治疗组,每组各40例。对照组中男16例,女24例;年龄48~81岁,平均(63.14±8.22)岁;肾功能衰竭病程2~9年,平均(5.21±1.48)年;透析时间4个月~2年,平均(1.03±0.32)年;原发病高血压肾病14例、肾小球肾炎18例、糖尿病肾病8例。治疗组中男18例,女22例;年龄49~80岁,平均(63.88±8.36)岁;肾功能衰竭病程2~10年,平均(5.35±1.26)年;透析时间5个月~2年,平均透析时间(1.15±0.40)年;原发病高血压肾病12例、肾小球肾炎19例、糖尿病肾病9例。两组资料无显著差异,有可比性。
全部患者进行常规血液透析(金宝AK96型血液透析机),透析液流量500 mL/min,血流量200~250 mL/min,钠离子浓度135~140 mmol/L,钙离子1.5 mmol/L,每周治疗3次,每次4 h。对照组静脉滴注注射用还原型谷胱甘肽,1.5 g/m2加入100 mL生理盐水后输注,1次/d。治疗组在对照组基础上温水冲服肾衰宁颗粒,1袋/次,3次/d。两组的疗程为45 d。
1.4 临床疗效评价标准[6]
治愈:症状、体征均消退,血压、肾功能指标正常;好转:症状得到控制,血红蛋白(Hb)上升,血液有所控制、血清肌酐(Scr)、尿素氮(BUN)降低;无效:病情反复或加剧。
总有效率=(治愈例数+好转例数)/总例数
1.5 观察指标
1.5.1 病情程度 对患者治疗前后的疾病严重程度使用急性生理与慢性健康(APACHEⅡ)评分进行评估,APACHEⅡ包括平均动脉压、心率、直肠温度、血钠、血钾、白细胞等项目,APACHEⅡ评分总分71分,分值越小则病情越轻[7]。
1.5.2 肾功能指标 在治疗前后获取患者的空腹外周血,使用博科BK-600型全自动生化分析仪测定Scr、尿蛋白定量(UTP)、肾小球滤过率(GFR)、β2-微球蛋白(β2-MG)。
1.5.3 氧化应激指标 在迈瑞MR-96A型全自动酶标仪上采用酶联免疫法测定血清淀粉样蛋白A(SAA)、糖基化终产物(AGEs)、终末期氧化蛋白产物(AOPP)水平,选择武汉艾迪抗生物公司生产的试剂盒。
1.5.4 红细胞参数 使用优利特URIT-3060型全自动血细胞分析仪测定患者红细胞压积(HCT)、Hb。
1.6 不良反应观察
记录患者发生皮疹、食欲不振、恶心呕吐、胃痛的情况
1.7 统计学处理
采用SPSS 26.0分析,使用χ2检验比较组间计数资料;以表示计量资料,以配对t检验比较治疗前后的数据,以独立t检验比较组间的数据。
2 结果
2.1 两组治疗效果比较
由表1可见,治疗组的总有效率为92.50%,对照组的总有效率为75.00%,组间差异显著(P<0.05)。

表1 两组总有效率比较Table 1 Comparison on total effective rates between two groups
2.2 两组病情程度比较
由表2可见,治疗后,两组的APACHEⅡ评分比治疗前小(P<0.05),且治疗组的APACHEⅡ评分比对照组更小(P<0.05)。
表2 两组的APACHEⅡ评分比较()Table 2 Comparison on APACHEⅡ scores between two groups ()

表2 两组的APACHEⅡ评分比较()Table 2 Comparison on APACHEⅡ scores between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05。*P < 0.05 compared with the same group before treatment;▲P < 0.05 compared with the control group after treatment.
2.3 两组肾功能指标比较
由表3可见,治疗后,两组的GFR比治疗前大,Scr、UTP、β2-MG比治疗前小(P<0.05);治疗组的GFR比对照组大,Scr、UTP、β2-MG比对照组小(P<0.05)。
表3 两组的Scr、UTP、GFR、β2-MG水平比较()Table 3 Comparison on levels of Scr,UTP,GFR,and β2-MG between two groups ()
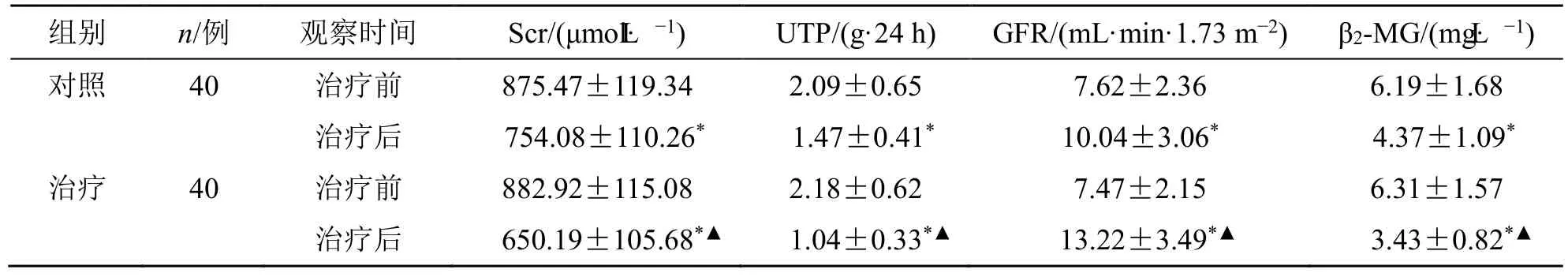
表3 两组的Scr、UTP、GFR、β2-MG水平比较()Table 3 Comparison on levels of Scr,UTP,GFR,and β2-MG between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05。*P < 0.05 compared with the same group before treatment;▲P < 0.05 compared with the control group after treatment.
2.4 两组氧化应激指标比较
由表4可见,治疗后,两组的血清SAA、AGEs、AOPP水平比治疗前低(P<0.05);治疗组的血清SAA、AGEs、AOPP水平比对照组低(P<0.05)。
表4 两组血清SAA、AGEs、AOPP水平比较()Table 4 Comparison on serum levels of SAA,AGEs,and AOPP between two groups ()

表4 两组血清SAA、AGEs、AOPP水平比较()Table 4 Comparison on serum levels of SAA,AGEs,and AOPP between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05。*P < 0.05 compared with the same group before treatment;▲P < 0.05 compared with the control group after treatment.
2.5 两组红细胞参数比较
由表5可见,治疗后,两组的HCT、Hb比治疗前高(P<0.05);治疗组的HCT、Hb比对照组高(P<0.05)。
表5 两组HCT、Hb的水平比较()Table 5 Comparison on levels of HCT and Hb between two groups ()

表5 两组HCT、Hb的水平比较()Table 5 Comparison on levels of HCT and Hb between two groups ()
与同组治疗前相比:*P<0.05;与对照组治疗后相比:▲P<0.05。*P < 0.05 compared with the same group before treatment;▲P < 0.05 compared with the control group after treatment.
2.6 两组不良反应比较
由表6可知,治疗组的不良反应发生率为10.00%,对照组的不良反应发生率为7.50%,组间无明显差异。

表6 两组不良反应发生率比较Table 6 Comparison on incidence of adverse reactions between two groups
3 讨论
慢性肾衰竭发展到终末期临床特征表现为内分泌代谢紊乱、水电解质失衡。血液透析是目前治疗该病的主要治疗手段,通过血液过滤器清除血液中毒性物质,进而减轻毒性物质对机体各器官的损伤,替代肾脏部分功能[8]。
还原型谷胱甘肽参与机体糖代谢、三羧酸循环,迅速补充肾脏所需谷胱甘肽,增强抗氧化能力,促进氧化自由基清除,改善红细胞功能,促进慢性肾功能衰竭病情恢复[9]。中医认为慢性肾衰竭的基本病机为气血亏虚、脾肾不足,形成瘀血、痰浊、湿热等,导致肾络痹阻,全身气机逆乱,阴阳俱虚[10]。肾衰宁颗粒由丹参、牛膝、半夏、牛膝等组成,具有健脾补气、活血祛瘀、泄浊通腑的功效,符合该病的病机[11]。本研究结果发现,治疗组的总有效率高于对照组,且APACHEⅡ评分比对照组更小,GFR比对照组大,Scr、UTP、β2-MG比对照组小,结果提示肾衰宁颗粒联合还原型谷胱甘肽有助于提高维持性血液透析慢性肾功能衰竭的治疗效果,进一步控制病情,改善肾功能。
SAA是由肝细胞分泌的急性时相蛋白,与肾功能衰竭患者机体组织损伤程度呈正相关,过度的氧化反应可加重慢性肾功能衰竭的肾组织损伤[12]。AGEs能直接造成蛋白质交联部位结构破坏,通过与多种细胞受体结合,分泌炎症因子,造成血管通透性改变和血管异常反应[13]。AOPP是一种氧化应激标志物,可作用于脂肪和蛋白质,与慢性肾功能衰竭患者氧化应激程度呈正相关[14]。本研究结果发现,治疗组的血清SAA、AGEs、AOPP水平比对照组小。结果提示,肾衰宁颗粒联合还原型谷胱甘肽有助于减轻维持性血液透析慢性肾功能衰竭患者的氧化应激损伤。
维持性血液透析慢性肾功能衰竭患者普遍存在贫血症状,机体Hb明显低于正常人群;HCT可反映机体红细胞数量,随着患者红细胞显著减少,HCT的水平明显降低[15]。本研究结果提示,治疗组的HCT、Hb比对照组大,提示肾衰宁颗粒联合还原型谷胱甘肽有助于改善维持性血液透析慢性肾功能衰竭患者的红细胞功能。
综上所述,肾衰宁颗粒联合注射用还原型谷胱甘肽有助于提高维持性血液透析慢性肾功能衰竭的治疗效果,进一步控制病情,改善肾功能和红细胞功能,降低氧化应激反应。
利益冲突所有作者均声明不存在利益冲突
