替雷利珠单抗联合XELOX方案治疗晚期胃癌的临床研究
2024-03-26童慧邢鹏
童慧,邢鹏
泾县医院 肿瘤内科,安徽 宣城 242500
胃癌为消化系统发病率极高的一种恶性肿瘤,早期通常无典型症状,当发展至晚期时,癌细胞已向浆膜层、浆膜层外转移,并向周围脏器浸润,此阶段患者已错过手术治疗最佳时机[1-2],故临床对于晚期胃癌患者通常以化疗为主要治疗手段。XELOX方案(奥沙利铂+卡培他滨)是临床常用胃癌化疗方案,对于病情进展具有延缓作用,对于患者生存时间具有延长效果[3]。但XELOX方案治疗不良反应发生风险较高,可导致严重的治疗不适感,影响患者治疗依从性,并对化疗效果产生影响,造成整体疗效无法达到预期目标[4]。近年来免疫疗法逐渐在肿瘤治疗中开展,其中替雷利珠单抗是临床常用的一种免疫检查点抑制剂,对于T细胞抗肿瘤应答效应具有再次激活效果,从而促使T细胞发挥免疫杀伤功能[5-6]。故本研究将替雷利珠单抗注射液联合XELOX方案应用于晚期胃癌患者,观察其疗效,为临床探讨晚期胃癌治疗方案提供更多参考。
1 资料与方法
1.1 一般资料
选取2021年1月—2023年1月泾县医院收治的60例晚期胃癌患者。其中男36例,女24例;年龄48~80岁,平均(61.82±4.51)岁;病程1~4年,平均(1.89±0.41)年;病理分型:腺癌48例,粘液癌9例,印戒细胞癌3例;TNM分期Ⅲb期37例,Ⅳ期23例;身体质量指数(BMI)为17.3~24.1 kg/m2,平均(22.12±0.25)kg/m2。本研究经医院伦理委员会批准,批号为(2020)泾医伦审第(18)号
纳入标准:(1)经影像学、病理学等检查结果确诊为胃癌;(2)TNM分期为Ⅲb~Ⅳ期;(3)生存时间预估值≥3个月;(4)患者已对本研究内容详细了解,且自愿签订知情同意书。排除标准:(1)存在器官功能衰竭;(2)严重凝血功能异常;(3)合并其他恶性肿瘤;(4)肿瘤已转移至脑组织;(5)对化疗无法耐受;(6)合并心血管疾病;(7)对使用药物过敏。
1.2 分组和治疗方法
采用随机数字表法将纳入患者分为对照组和治疗组,每组30例。对照组男19例,女11例;年龄50~80岁,平均(62.43±4.39)岁;病程1~3年,平均(1.91±0.36)年;病理分型:腺癌25例,黏液癌4例,印戒细胞癌1例;TNM分期Ⅲb期19例,Ⅳ期11例;BMI为17.5~24.1 kg/m2,平均BMI(22.11±0.28)kg/m2。治疗组男17例,女13例;年龄48~79岁,平均(61.05±4.27)岁;病程1~4年,平均(1.88±0.47)年;病理分型:腺癌23例,黏液癌5例,印戒细胞癌2例;TNM分期Ⅲb期18例,Ⅳ期12例;BMI 17.3~23.8 kg/m2,平均BMI(22.15±0.21)kg/m2。两组患者各项资料相比较差异无统计学意义,具有临床可比性。
对照组采用XELOX方案:第1天静脉滴注注射用奥沙利铂(江苏恒瑞医药股份有限公司生产,规格100 mg/支,产品批号20200915、20210109、20211005、20220608)130 mg/m2,同时口服卡培他滨片(江苏恒瑞医药股份有限公司生产,规格0.5 g/片,产品批号20200821、20210311、20211203、20221119)1 000 mg/m2,2次/d,连续治疗14 d,并以3周为1个疗程。治疗组在对照组基础上静脉滴注替雷利珠单抗注射液(广州百济神州生物制药有限公司生产,规格100 mg/瓶,产品批号20201115、20210618、20220213、20221003)200 mg/次,3周用药1次,3周为1个疗程。两组均连续治疗3个疗程。
1.3 近期临床疗效评价标准[7]
完全缓解:病灶消失持续时间≥4周;部分缓解:病灶直径之和较治疗前下降>30%,且持续时间≥4周;病情进展:病灶的直径之和较治疗前增大>20%;稳定:上述变化外的情况。
总有效率=(完全缓解例数+部分缓解例数)/总例数
1.4 观察指标
1.4.1 免疫功能指标 治疗前后采集患者空腹静脉血,使用流式细胞仪测定患者血液中CD3+T细胞、CD4+T细胞和CD4+T/CD8+T比值。
1.4.2 血清肿瘤标志物 治疗前后抽取患者空腹静脉血4 mL,离心提取血清,采用酶联免疫吸附法测定患者血清糖类抗原199(CA199)、基质金属蛋白酶-2(MMP-2)、血管内皮生长因子(VEGF)水平。
1.5 不良反应发生情况
统计两组患者白细胞减少、血红蛋白减少、血小板减少、肝肾功能异常等不良反应发生情况。
1.6 统计学方法
经软件SPSS 24.0进行分析和处理,计数数据均采用百分数表示,并通过χ2检验进行分析;计量数据均采用表示,并通过t检验进行分析。
2 结果
2.1 两组近期临床疗效比较
治疗组患者的总有效率高于对照组的总有效率(P<0.05),见表1。

表1 两组总有效率比较Table 1 Comparison on total effective rates between two groups
2.2 两组免疫功能指标比较
治疗后,对照组CD3+T细胞、CD4+T细胞和CD4+T/CD8+T比值均显著降低,治疗组CD3+T细胞、CD4+T细胞和CD4+T/CD8+T比值均显著升高(P<0.05);治疗组CD3+T细胞、CD4+T细胞和CD4+T/CD8+T比值均明显高于对照组(P<0.05),见表2。
表2 两组CD3+ T细胞、CD4+ T细胞和CD4+ T/CD8+ T比值比较()Table 2 Comparison on CD3+ T cells,CD4+ T cells,and CD4+ T/CD8+ T between two groups ()

表2 两组CD3+ T细胞、CD4+ T细胞和CD4+ T/CD8+ T比值比较()Table 2 Comparison on CD3+ T cells,CD4+ T cells,and CD4+ T/CD8+ T between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.3 两组血清肿瘤标志物水平比较
治疗后,两组血清CA199、MMP-2、VEGF水平均显著降低(P<0.05),且治疗组血清CA199、MMP-2、VEGF水平均低于对照组(P<0.05),见表3。
表3 两组血清CA199、MMP-2、VEGF水平比较()Table 3 Comparison on serum levels of CA199,MMP-2,and VEGF between two groups ()

表3 两组血清CA199、MMP-2、VEGF水平比较()Table 3 Comparison on serum levels of CA199,MMP-2,and VEGF between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.4 两组不良反应发生情况比较
治疗组、对照组的不良反应发生率分别为33.33%、26.67%,差异无统计学意义,见表4。
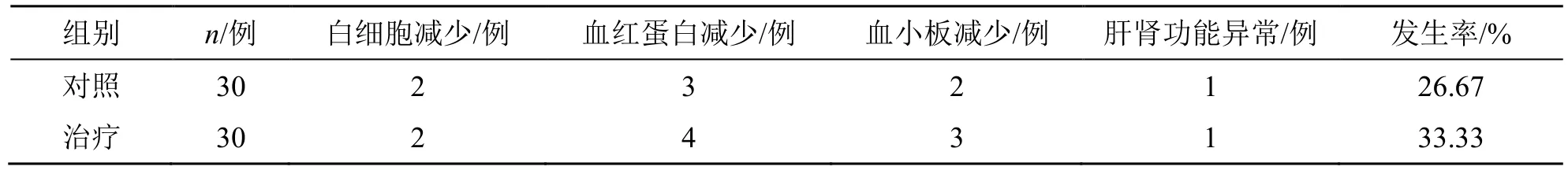
表4 两组不良反应发生率比较Table 4 Comparison on incidence of adverse reactions between two groups
3 讨论
胃癌早期症状不典型,常导致多数患者就诊时病情已发展至中晚期。胃癌晚期通常为患者的肿瘤细胞已向其他器官和组织发生转移,而转移途径主要包括血液系统、淋巴结、局部侵犯等,同时胃癌还存在一种较难处理的转移方式,即癌细胞经癌外表面脱落入腹腔,或经血液、淋巴管腔进入腹腔,从而在腹腔内种植转移。对于出现转移的晚期胃癌患者,尤其是出现腹腔种植转移者,其取得临床根治性效果的可能性通常较低[8-9]。
晚期胃癌的生存时间可受到临床治疗效果的影响,化疗属于临床抗肿瘤治疗的重要手段,主要通过增强患者机体肿瘤免疫应答抑制肿瘤发展。奥沙利铂为第3代铂类抗肿瘤药物,卡倍他滨属于口服类抗癌剂,主要对肿瘤细胞的DNA复制过程发挥抑制效果,并对蛋白质合成形成干扰,从而抑制肿瘤细胞的增殖,进而有利于延长患者生存时间[10]。而在此基础上使用替雷利珠单抗治疗,主要对PD-1/PD-L1通路进行阻断,促进肿瘤浸润淋巴细胞对于肿瘤细胞的识别能力,进而提高淋巴细胞对肿瘤细胞的杀伤效果,有利于提高患者的疗效[11]。本研究结果显示,治疗组的总有效率为60.00%,高于对照组的33.33%,结果表明替雷利珠单抗联合XELOX方案有利于提高晚期胃癌近期治疗效果。
CA199在正常机体中表达水平极低,通常分布于胃肠道肿瘤组织内,属于低聚糖肿瘤相关抗原,且其分泌水平随着胃癌组织增殖发展而逐渐升高;MMP-2属于金属蛋白酶的主要家庭成员之一,可被内皮细胞、巨噬细胞和结缔组织细胞释放,在胃癌患者体内主要处于激活状态,并对于细胞外基质代谢具有调节作用,对于Ⅳ型胶原和凝胶具有降解作用,从而可促进肿瘤细胞穿过底膜侵袭到血管和淋巴管,加快肿瘤的转移过程;VEGF为机体中较常见的促血管生长因子,通常在肝癌组织中表达水平较高,有利于促进肿瘤病灶新生血管的形成,并对于肿瘤细胞的增殖也具有促进作用,从而也有利于加快肿瘤的生长、转移[12-13]。因此患者血清CA199、MMP-2、VEGF水平越高,提示肿瘤生长越快。本研究中,经替雷利珠单抗联合XELOX方案治疗后,患者血清CA199、MMP-2、VEGF水平明显下降,说明替雷利珠单抗联合XELOX方案有利于加强对肿瘤细胞的杀伤效果,抑制增殖效果,从而有效提高抗肿瘤作用。
胃癌晚期患者体内发挥抗肿瘤效果的免疫细胞主要是T细胞,因此T细胞各亚群的检测水平对于患者病情、疗效具有重要评价作用。CD3+T细胞、CD4+T细胞均对单核细胞、巨噬细胞具有激活效果,从而可加强细胞因子的分泌水平[14]。CD4+T细胞对于白细胞介素-2的分泌具有促进作用,从而对于CD8+T细胞具有活化作用,进而可发挥癌细胞凋亡诱导作用[15]。因此,CD4+T细胞/CD8+T细胞水平可用于免疫系统自我调节功能的评估,对于机体免疫功能具有评价作用。而胃癌晚期患者通常免疫功能受到破坏,而化疗药物长期作用也可对免疫细胞等正常细胞产生损害,因此患者CD3+T细胞、CD4+T细胞和CD4+T细胞/CD8+T细胞水平可明显下降。而替雷利珠单抗联合XELOX方案有利于抑制肿瘤生长,其相较于单独化疗,更有利于加强患者的免疫功能。替雷利珠单抗对于由PD-1/PD-L1通路所介导T细胞免疫抑制效应具有抑制作用,从而对T细胞的增殖、免疫功能均具有加重作用,进而有利于促进患者免疫功能的恢复。本研究结果显示,治疗组CD3+T细胞、CD4+T细胞和CD4+T细胞/CD8+T细胞水平均高于治疗前,对照组CD3+T细胞、CD4+T细胞和CD4+T细胞/CD8+T细胞水平均低于治疗前,治疗组各指标均高于对照组,提示替雷利珠单抗联合XELOX方案可有利于提高胃癌晚期患者的免疫功能。此外,本研究中治疗组不良反应与对照组比较无显著差异,表明替雷利珠单抗治疗安全性较好,并不增加不良反应发生风险。
综上所述,替雷利珠单抗注射液联合XELOX方案可提高晚期胃癌患者的近期疗效,促进免疫功能恢复,加强抗肿瘤效果。
利益冲突所有作者均声明不存在利益冲突
