脑安滴丸联合丁苯酞治疗急性脑梗死的临床研究
2024-03-26吴延华郭江涛赵广珍杨志强李艳宋青扬
吴延华,郭江涛,赵广珍,杨志强,李艳,宋青扬
1.北京市隆福医院 神经内科,北京 100010
2.北京市隆福医院 急诊科,北京 100010
3.北京市隆福医院 老年科,北京 100010
急性脑梗死作为最主要的卒中亚型,以高复发、高致死致残性为特征,其发病率、患病率已分别达145/10万和1256/10万,占所有卒中类型的70%左右[1]。该脑血管病是由脑血供突然中断引起,并由此产生半身不遂、眩晕、说话不清、昏厥等症状,因脑组织缺血缺氧性坏死最终导致认知、语言、吞咽等一系列神经功能障碍,是危害患者生命质量的重大疾病。恢复灌注是目前急性脑梗死治疗的关键策略,而开通侧支循环是实现血流再灌注的主要方式之一,可有效避免静脉溶栓和血管内治疗条件的局限性,临床中以此为核心的抗血小板、调脂、脑保护、活血化瘀类中成药等各种治疗措施,旨在尽可能挽救梗死灶周围尚未死亡的神经细胞,促进神经功能恢复[2]。丁苯酞注射液有促进侧支循环开放、抑制神经功能损伤等作用,是治疗急性脑梗死的抗脑缺血新药[3]。脑安滴丸是中药制剂,能益气活血、通络化瘀,对气虚血瘀引起的急性脑梗死有良效[4]。故而本研究针对急性脑梗死采用脑安滴丸联合丁苯酞注射液治疗,探讨其临床疗效。
1 资料与方法
1.1 一般资料
选取2022年1月—12月北京市隆福医院收治的146例急性脑梗死患者,其中男84例,女62例;年龄41~74岁,平均(61.35±9.84)岁;病情程度:中度79例,中-重度67例;发病时间6~43 h,平均(23.10±6.69)h。
纳入标准:(1)符合急性脑梗死的诊断标准[5];(2)无脑外伤及脑出血病史;(3)40岁≤年龄≤75岁;(4)发病前无上下肢功能障碍;(5)发病时间6~48 h;(6)既往无精神异常及认知障碍;(7)无丁苯酞使用禁忌证;(8)患者及家属自愿签订知情同意书。
排除标准:(1)其他类型卒中或病因引起的相关症状;(2)合并肝肾心肺等脏器功能不全;(3)存在血液系统疾病或恶性肿瘤;(4)脑梗死恢复期;(5)对脑安滴丸中任何成分过敏;(6)存在昏迷或大面积脑梗死等危重情况;(7)5分<美国国立卫生研究院卒中量表(NIHSS)评分<20分。
1.2 药物
脑安滴丸由辽源誉隆亚东药业有限责任公司生产,规格50 mg/粒,产品批号 221109;丁苯酞氯化钠注射液由石药集团恩必普药业有限公司生产,100 mL∶丁苯酞25 mg与氯化钠0.9 g,产品批号202111253。
1.3 分组和治疗方法
按随机数字表法将所有患者分为对照组和治疗组,每组各73例。其中对照组男44例,女29例;年龄41~73岁,平均(60.97±9.56)岁;病情程度:中度38例,中-重度35例;发病时间7~43 h,平均(23.37±6.17)h。治疗组男40例,女33例;年龄43~74岁,平均(62.11±9.35)岁;病情程度:中度41例,中-重度32例;发病时间6~41 h,平均(22.88±6.32)h。两组基线资料比较差异无统计学意义,具有可比性。
所有患者均接受相同的血糖和血压控制、持续心电监护、必要时吸氧等一般处理及阿司匹林联合氯吡格雷双联抗血小板、强化降脂等对症治疗。对照组静脉滴注丁苯酞氯化钠注射液,100 mL/次,2次/d,滴注时间≥50 min/次。治疗组在对照组基础上口服脑安滴丸,20粒/次,2次/d。两组疗程14 d。
1.4 疗效判定标准[6]
基本痊愈:治疗后,NIHSS评分减少(简记为“NSD”)≥90%,有独立生活与工作的能力;显著进步:治疗后46%≤NSD≤89%,生活自理或部分自理;进步:治疗后18%≤NSD≤45%;无变化:治疗后NIHSS评分变化<18%;恶化:NIHSS评分增加超出“无变化”范围。
总有效率=(基本痊愈例数+显著进步例数+进步例数)/总例数
1.5 观察指标
1.5.1 相关评分 简式Fugl-Meyer评定量表(FMA)评分包含上、下肢的协调性和速度、反射活动、分离运动等肢体运动功能状况共50项评估内容,每项均计0~2分,量表评分(0~100分)越高则运动功能越佳[7]。NIHSS依据构音障碍、感觉、共济运动、视野等15项内容对神经功能状况作出评价,评分(0~42分)增高提示神经损伤加重[8]。
1.5.2 血栓指标和血小板聚集率(PAgT)治疗前后使用Immulite 1000型化学发光免疫分析仪(美国SIEMENS公司),以化学发光法(试剂盒购自湖南艾科柏生物)测定患者血浆纤溶酶-抗纤溶酶复合物(PAP)、凝血酶抗凝血酶复合物(TAT)水平。PAgT:运用山东泰利信医疗产的AG800型血小板聚集仪,以花生四烯酸为诱导剂,检测患者PAgT。
1.5.3 血清细胞因子 治疗前后采集患者6 mL静脉血,制备血清;使用日本Hitachi公司产的7600型生化分析仪,以免疫比浊法检测血清C反应蛋白(CRP)水平,选用日本Shimadzu公司产的UV-2600型紫外分光光度计,分别以硝酸还原酶法、黄嘌呤氧化酶法、NADH速率法测定血清一氧化氮(NO)、超氧化物歧化酶(SOD)、谷氨酸(Glu)水平,操作均按说明书。其中CRP、Glu的试剂盒均购自上海语纯生物,NO、SOD的试剂盒均购自北京联众泰克科技。
1.6 不良反应观察
记录患者治疗过程中发生的不良反应情况。
1.7 统计学分析
使用SPSS 25.0统计软件包处理数据,计量资料、计数资料分别以、百分比表示,分别行t、χ2检检验。
2 结果
2.1 两组临床疗效比较
治疗后,治疗组总有效率是95.89%,显著高于对照组的86.30%(P<0.05),见表1。

表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组FMA、NIHSS评分比较
治疗后,两组FMA评分均较治疗前显著升高,而NIHSS评分显著降低(P<0.05);治疗组FMA、NIHSS评分改善更显著(P<0.05),见表2。
表2 两组FMA、NIHSS评分比较( )Table 2 Comparison on FMA and NIHSS scores between two groups ()

表2 两组FMA、NIHSS评分比较( )Table 2 Comparison on FMA and NIHSS scores between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.3 两组血栓及血小板参数比较
治疗后,两组血浆PAP、TAT水平和PAgT均较治疗前显著下降(P<0.05);且以治疗组下降更显著(P<0.05),见表3。
表3 两组血栓及血小板参数比较( )Table 3 Comparison on thrombosis and platelet parameters between two groups ()
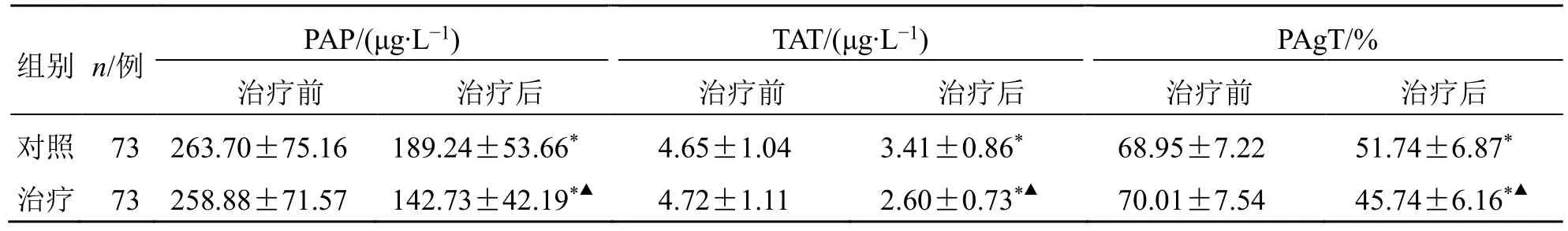
表3 两组血栓及血小板参数比较( )Table 3 Comparison on thrombosis and platelet parameters between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.4 两组血清CRP、NO、SOD、Glu水平比较
治疗后,两组血清CRP、Glu水平均显著下降,而血清NO、SOD水平均显著上升(P<0.05);且治疗组血清CRP、NO、SOD、Glu水平改善更显著(P<0.05),见表4。
表4 两组血清CRP、NO、SOD、Glu水平比较( )Table 4 Comparison of serum CRP,NO,SOD,Glu levels between two groups ()
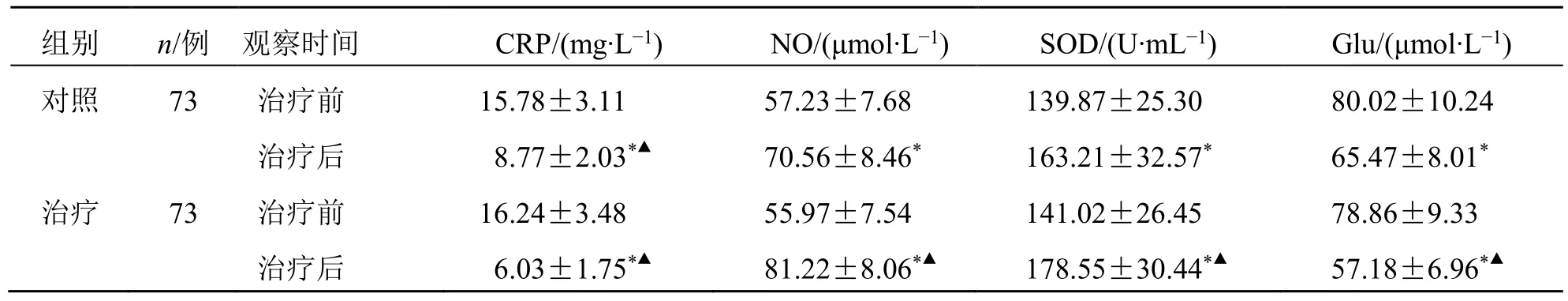
表4 两组血清CRP、NO、SOD、Glu水平比较( )Table 4 Comparison of serum CRP,NO,SOD,Glu levels between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.5 两组不良反应比较
对照组发生转氨酶轻度升高2例,腹部不适、注射部位发红各1例,不良反应发生率是5.48%;治疗组发生胃胀、转氨酶轻度升高各2例,恶心1例,不良反应发生率是6.85%,两组不良反应发生率比较差异无统计学意义。
3 讨论
我国已进入快速老龄化社会,急性脑梗死的发病正逐年增加,≥65岁者发病率整体年增加约6.2%,患者发病后1年致死/致残率33.4%~33.8%,是成人死亡率和寿命损失年数第一的疾病[9]。缺血半暗带是急性脑梗死患者预后的关键,该区域是梗死灶周围的血流低灌注区,由于神经细胞尚未死亡可经及时恢复血液循环而避免进展为梗死灶。由于受时间窗和禁忌证的影响,很多患者无法通过大血管再通实现血流再灌注,而脑侧支循环作为脑循环代偿机制之一,与缺血半暗带密切相关,是延长治疗时间窗及决定梗死面积的主要因素[10]。丁苯酞氯化钠注射液是治疗脑缺血的国内化学Ⅰ类新药,可通过抗血小板聚集、解耦侵袭白细胞与神经血管单位间的相互作用、抑制促炎因子表达和细胞内钙超载、促进血管新生、减轻氧化应激等途径,发挥促进侧支循环建立、保护血脑屏障、改善局部微循环、挽救缺血半暗带、减少缺血再灌注损伤等药理作用,从而取得“复流”和“神经保护”的双重效果,利于急性脑梗死患者梗死面积缩小及脑保护[11]。1项Meta分析显示,丁苯酞可改善血管内皮功能,对急性脑梗死患者神经功能损害有减轻效果[12]。
“中风”为急性脑梗死中医病名,其由多因素共同作用引起,其中“虚”和“瘀”是发病的关键,老年阶段因体弱正衰,或久病伤正,正气虚损,而气为血之帅,气虚则血行无力,瘀阻脑络,发为此病。故在气虚血瘀的重要病机核心指导下,多采取“益气活血、化瘀通络”之法治疗。脑安滴丸是中药活血剂,主要是由川芎、红花、人参、当归、冰片5味中药经现代制药工艺精制而成的滴丸剂,有活血运气、行瘀通经、补气益智、开窍醒神等功效,主治气血不畅而致的急性脑血管疾病,使气虚能补、血瘀能化、浊降清升而风自平,高度契合急性脑梗死气虚血瘀证之中医病机要点。此外,本品为滴丸剂型,具有易吸收、起效快、缓释特性延长药效、生物利用度高、胃肠道刺激小等优点。动物实验发现,脑安滴丸可通过延长凝血时间和血浆复钙时间、抑制血小板聚集、对抗肾上腺素引起的静脉和微动脉收缩、降低脑血管阻力等途径,降低血液黏度、抑制脑血栓形成[13]。刘丽等[14]研究显示,脑安滴丸具有增加脑血流量、保护脑组织、对抗脑缺血损害等功效,能明显改善气虚血瘀型脑梗死患者神经功能障碍,提高临床疗效。本研究在急性脑梗死治疗中联合使用脑安滴丸与丁苯酞氯化钠注射液,其临床总有效率(95.89%)获得明显提高;且治疗组FMA、NIHSS评分改善较对照组更优;而两组患者均未有严重不良反应;表明脑安滴丸联合丁苯酞氯化钠注射液治疗急性脑梗死具有良好的有效性与安全性,利于减轻患者神经功能缺损及促进运动功能恢复。
凝血异常、血小板过度激活等血液成分的改变可导致脑血栓形成,致使管腔狭窄甚至闭塞,是急性脑梗死的主要发病机制。PAP、TAT是血栓标志物组合,前者系由α2-抗纤溶酶(即最重要的纤溶酶抑制物)与纤溶酶反应形成的物质,能评估极易失活的纤溶酶生成情况;后者是凝血激活的特异性指标,可反映人体内潜在的抗凝作用;二者水平升高共同体现急性脑梗死患者机体纤溶和凝血系统亢进状态,与血栓形成密切相关[15]。血小板活化是脑血栓形成的关键因素,急性脑梗死患者血管内皮细胞受损时,血小板受刺激活化、黏附,PAgT随之增加,过度激活的血小板通过释放凝血酶活性因子及炎症介质,进一步导致持续的病理性血栓形成[16]。此外,脑缺血可引起多种炎症细胞的激活及促炎因子释放,诱导脑血管炎症及神经元死亡,CRP由肝细胞合成,因在炎症及感染过程中其血中浓度快速升高被归为急性时相蛋白,与急性脑梗死患者预后有关[17]。NO是与血管内皮功能紧密关联的效应分子,能抑制血管平滑肌收缩及血小板黏附、聚集,起到舒张脑血管、抑制血栓形成、促进脑血流量恢复等作用[18]。SOD作为清除自由基等活性物质的蛋白质,在急性脑梗死患者机体氧化-抗氧化平衡被破坏后,SOD快速消耗,从而拮抗氧化应激引起的神经元损伤,其水平可判断脑组织氧化应激损伤情况[19]。Glu是脑组织中含量最高的兴奋性氨基酸递质,脑缺氧时其大量释放至突触间隙且重摄取受抑制,导致胞外Glu水平升高,并通过激活蛋白溶解酶、磷脂酶等启动神经细胞凋亡的病理反应及引起神经元和神经胶质细胞去极化的途径,加重急性脑梗死患者神经功能损害[20]。本研究中治疗后治疗组PAP、TAT、PAgT及血清CRP、NO、SOD、Glu水平的改善效果均显著优于对照组;提示脑安滴丸与丁苯酞氯化钠注射液的联合治疗方案在抑制急性脑梗死患者体内血栓形成和减轻机体炎症反应、血管内皮损害、氧化应激程度及神经功能损伤等方面更具优势。
综上所述,脑安滴丸联合丁苯酞氯化钠注射液治疗急性脑梗死可获得良好的疗效,能安全有效地抗血栓形成,缓解炎症及氧化应激损害,促进神经及运动功能改善,值得临床推广应用。
利益冲突所有作者均声明不存在利益冲突
