基于网络药理学探讨舒肝宁注射液治疗乙型病毒性肝炎的作用机制
2024-03-26张立娜张向宇朱雨晴刘玉华马颖钰赵海亮
张立娜,张向宇,朱雨晴,刘玉华,马颖钰,赵海亮
1.河北医科大学第三医院,河北 石家庄 050051
2.天津中医药大学,天津 301617
3.河北省医学情报研究所,河北 石家庄 050071
4.河北省儿童医院,河北 石家庄 050031
乙型病毒性肝炎是由乙型肝炎病毒(HBV)感染而起的一类传染性疾病,严重可引起肝硬化、肝衰竭、肝癌等疾病。据世界卫生组织统计,全球约有2.96亿人感染慢性肝炎,相比于往年,患病比率有所下降,但全球消除病毒性肝炎病毒也是刻不容缓[1]。HBV属于DNA病毒,潜伏期较长,西医临床上多采用抗病毒治疗法对抗HBV感染所引起的乙型病毒性肝炎,如干扰素类药物以及核苷(酸)类似物药[2]。中医药治疗乙型病毒性肝炎逐渐走向大众视野,相对于西医治疗乙型病毒性肝炎的疗程较长、停药后复发率较高等状况[3],中药治疗有着辨证论治、多成分、多靶点共同作用,从而实现快速且有效解决不同证型乙型病毒性肝炎的优势[4]。
舒肝宁注射液是由茵陈、栀子、板蓝根、灵芝等多种中药提取物以及黄芩苷组成的用于治疗急、慢性乙型病毒性肝炎的中成药之一。具有清热解毒、利湿退黄、益气扶正、保肝护肝的功效[3]。研究表明,组成舒肝宁注射液的5种中药提取物中,发挥疗效的包括有机酸类、环烯醚萜苷类、黄酮类、腺苷类、生物碱类等多种化学成分[5-8]。但目前舒肝宁注射液活性成分治疗乙型病毒性肝炎的分子作用机制并不明确。网络药理学作为新兴学科,可从网络调控、网络构建进行多成分、多靶点的方剂网络模型创造[9],进一步揭示中药方剂在某种病症中的治疗作用机制。本研究则基于网络药理学和分子对接技术探究舒肝宁注射液中活性成分治疗乙型病毒性肝炎的分子作用机制,为其临床使用提供理论依据。
1 材料与方法
1.1 舒肝宁注射液主要成分的筛选
舒肝宁注射液是由茵陈、栀子、板蓝根和灵芝提取物及黄芩苷组成的中药复方注射剂。茵陈提取物中的绿原酸等有机酸类化合物为其主要的活性成分,有抗炎、抗病毒、保肝利胆、抗氧化等作用[10];环烯醚萜苷类为栀子提取物中主要的一类活性成分,通过抑制氧化应激、抗脂质过氧化等作用发挥保肝利胆作用[11];板蓝根中表告依春及腺苷类、生物碱类成分有较强的抗病毒作用为主要活性成分[12];灵芝提取物中三萜类及腺苷类化合物为其主要活性成分,具有护肝解毒功效[13]。有学者对舒肝宁注射液中的绿原酸、栀子苷、黄芩苷、表告依春、腺苷等主要成分进行了定量分析[5-8]。另外,通过其他针对4味药材物质组解析的文献报道[14-17],并以含量高、活性好、各结构类型兼顾的原则,选取舒肝宁注射液中的代表性成分为研究对象。
1.2 化合物靶点预测分析
在PubChem数据库获得代表性化合物结构及其Smlies号,将其导入Swiss Target Prediction平台,选物种为“人”,进行化合物潜在作用靶点的筛选;在TCMSP数据库检索栏输入化合物英文名,检索其作用靶点,然后整合2个数据库结果,得到舒肝宁注射液主要代表性成分潜在作用靶点库。
同时利用GeneCards和DisGeNET数据库搜索“hepatitis B”,获得乙型病毒性肝炎疾病候选靶点。最后利用Venny平台获取成分潜在作用靶点与疾病靶点的交集靶点,即为舒肝宁注射液治疗乙型病毒性肝炎的潜在靶点。
1.3 蛋白相互作用(PPI)网络构建
将1.2项下获得的交集靶点导入String数据库,选择物种为人、置信度为0.9,获得交集靶点的PPI网络数据,将该数据表导入Cytoscape 3.9.1软件,获得PPI网络图,利用Analyze Network工具进行分析,获取各靶点degree值等信息。
1.4 蛋白质相互作用富集分析
利用Metascape数据库对PPI网络中高度连接的网络进行分组及可视化处理。并对MCODE进行功能富集分析。
1.5 基因本体(GO)、京都基因与基因组百科全书(KEGG)富集分析
运用Omicsbean平台对舒肝宁注射液治疗乙型病毒性肝炎的潜在靶点进行GO功能富集分析及KEGG通路富集分析,ID type设置为Gene Symbol,物种设置为“Homo sapiens”。
1.6 “药材-成分-靶点”网络图构建
建立“药材-成分”“成分-靶点”对应关系工作表并导入Cytoscape 3.9.1软件,绘制“药材-成分-靶点”网络关系图。
1.7 乙型病毒性肝炎信号通路网络分析
分析信号通路结果,获得乙型病毒性肝炎疾病信号通路,找到该信号通路中的靶点信息,并逆推确定舒肝宁注射液中作用于该通路的化学成分,将数据导入Cytoscape 3.9.1获得“药材-成分-靶点-乙型病毒性肝炎通路”网络关系图。
1.8 分子对接验证
将PPI网络分析中得到的核心靶点与“药材-成分-靶点-乙型病毒性肝炎通路”网络分析中的潜在靶点取交集靶点作为对接受体,于PDB数据库中下载蛋白三维结构;并根据化合物靶点预测分析结果中,分别与交集靶点作用的化合物为对接配体,从Pub Chem数据库中下载配体结构的3D sdf格式文件,利用Schrödinger2020 Maestro 12.4软件对蛋白受体以及化合物小分子做去水、能量最小化以及氢键优化处理后进行分子对接。
2 结果
2.1 舒肝宁注射液有效成分
根据化合物选取原则及文献查阅,共确定舒肝宁注射液中19个代表性成分。主要包括来源于茵陈、栀子、板蓝根、灵芝药材中的有机酸类成分如绿原酸、异绿原酸C等,环烯醚萜苷类成分如栀子苷、京尼平苷等,含硫类成分如表告依春,喹唑酮类成分如色胺酮,腺苷类成分如腺苷、鸟苷,吲哚生物碱类成分如靛玉红等,三萜类成分如灵芝酸A等,以及处方中黄酮类成分黄芩苷,见表1。

表1 舒肝宁注射液有效成分Table 1 Active ingredient of Shuganning Injection
2.2 潜在作用靶点筛选
共获得19个化合物的584个作用靶点,整理去重后共得到321个潜在作用靶点;通过GeneCards数据库以“relevance score>10”为条件获得2 506个乙型病毒性肝炎相关靶点;通过DisGeNET数据库获得415个乙型病毒性肝炎相关靶点,二者综合去重后获得2 640个靶点。将321个化合物潜在作用靶点与2 640个疾病靶点数据导入Venn平台,获得173个交集靶点,视为舒肝宁注射液治疗乙型病毒性肝炎的潜在靶点。
2.3 PPI网络构建与分析
将173个交集靶点导入String数据库,选择物种为人、置信度为0.9,获得PPI网络,见图1。分析发现该PPI网络图共涉及142个节点,300条边,平均相邻节点数为4.579,按degree值排序,靠前的20个靶点为非受体酪氨酸激酶(SRC)、热休克蛋白(HSP90AA1)、雌激素受体1(ESR1)、磷脂酰肌醇3-激酶(PIK3CA)、表皮生长因子受体(EGFR)、连环蛋白1(CTNNB1)、核受体辅阻遏物2(NCOR2)、肿瘤坏死因子(TNF)、整合素B1(ITGB1)、胱天蛋白酶3(CASP3)、蛋白激酶Cα(PRKCA)、组蛋白脱乙酰酶1(HDAC1)、细胞凋亡调节因子(Bcl-2)、Ras家族蛋白(HRAS)、丝氨酸/苏氨酸蛋白激酶(RAF1)、细胞色素P450家族蛋白(CYP1A1)、雄激素受体(AR)、V-rel网状内皮增生病毒癌基因同源物A(RELA)、蛋白酪氨酸磷酸酶SHP2(PTPN11)、基质金属蛋白酶9(MMP9),视为核心靶点。图中圆形节点即靶点,其中节点越大颜色越深表示degree值越大,节点间连线颜色越深代表靶点之间联系越紧密。
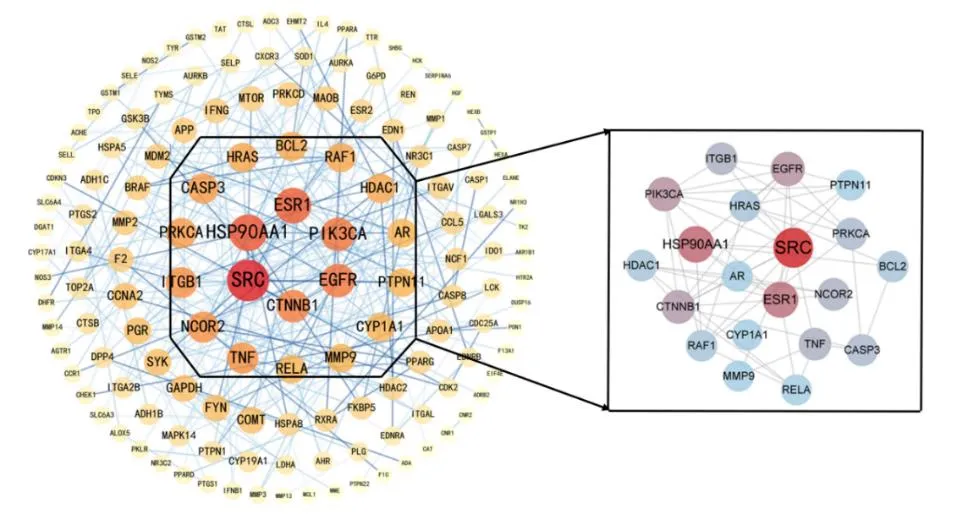
图1 舒肝宁注射液治疗乙型病毒性肝炎的PPI网络分析图Fig.1 PPI network analysis of Shuganning Injection in treatment of hepatitis B
2.4 蛋白质相互作用富集分析
使用Metascape数据库对交集靶点进行聚类分析,共生成6个显著聚类团,见图2。对不同聚类团中的靶点进行潜在功能分析。通过富集分析显示,MCODE 1主要对生物刺激的反应进行调节以及与癌症相关;MCODE 2主要与细胞凋亡信号通路的负调控以及内质网中的蛋白质加工有关;MCODE 3参与胶原蛋白降解、基质金属蛋白酶的激活;MCODE 4主要参与对肽的反应、细胞的活化以及MAPK信号通路相关;MCODE 5与T/B细胞受体信号通路、C型凝集素受体信号通路相关;MCODE 6参与胺代谢、色氨酸代谢、芳香族化合物分解代谢过程。

图2 舒肝宁治疗乙型病毒性肝炎相关蛋白靶点的cluster模块分析图Fig.2 Cluster module analysis of targets related to Shuganning Injection in treatment of hepatitis B
2.5 GO、KEGG富集分析
将舒肝宁注射液治疗乙型病毒性肝炎的潜在作用靶点导入Omicsbean平台,进行GO功能富集分析以及KEGG通路富集分析。通过分析发现,在P<0.05条件下,共富集到5 409条生物过程(BP)、426个细胞组分(CC)、609个分子功能(MF)、166个KEGG相关通路。按P值升序排序,GO功能富集分析各自选前10项进行可视化处理(图3)、KEGG通路富集选择前20个做分析(图4)。结果表明,在BP方面涉及细胞对化学刺激的响应、对生物及细胞过程的正调控、对胁迫的响应等;在CC方面涉及细胞质、囊泡、细胞外基质等;MF主要涉及蛋白结合、酶结合等。干预的信号通路主要有VEGF、TNF、T细胞受体(T cell receptor)、磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)、乙型病毒性肝炎、丙型病毒性肝炎等信号通路。

图3 GO功能富集分析图Fig.3 Analysis of GO functional enrichment

图4 KEGG通路富集分析图Fig.4 Analysis of KEGG pathway enrichment
2.6 舒肝宁注射液“药材-成分-靶点”网络构建
建立“药材-成分-靶点”对应关系工作表,通过Cytoscape 3.9.1软件绘制“药材-成分-靶点”网络作用图,见图5。通过Analyze Network分析,该网络图具197个节点,341条边,平均相邻节点数为3.431。证明舒肝宁注射液治疗乙型病毒性肝炎是多成分与多靶点间的相互作用。
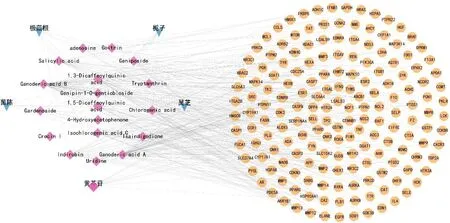
图5 “药材-活性成分-靶点”网络图Fig.5 Network diagram of “traditional Chinese medicine-active ingredient-target”
2.7 乙型病毒性肝炎信号通路相关靶点网络
对KEGG富集到的乙型病毒性肝炎疾病信号通路进行深入分析发现,舒肝宁注射液19个化合物中有13个可作用于乙型病毒性肝炎信号通路的16个靶点(图6),其中在PPI网络分析中处于核心地位的靶点有9个,分别为SRC、PIK3CA、PRKCA、TNF、CASP3、HRAS、RAF1、MMP9、Bcl-2。

图6 乙型病毒性肝炎通路相关“药材-活性成分-靶点”网络图Fig.6 Viral hepatitis B pathway related “drug-active ingredient-target” network diagram
2.8 分子对接结果
采用分子对接技术对舒肝宁注射液治疗乙型病毒性肝炎的机制进行进一步探讨。以PPI网络分析中的核心靶点与乙型病毒性肝炎信号通路分析中的9个重叠靶点作为受体,其所对应的活性成分作为对接配体,于Schrödinger2020 Maestro 12.4软件中处理后进行分子对接。配体与受体结合越稳定,两者对接分数越低。结果如表2所示,对接示意图见图7,除PIK3CA和PRKCA 2个靶点与活性成分对接分数处于-3~-5 kcal/mol(1 kcal=4.2 kJ),其余7个靶点与化合物的对接得分均优于-5 kcal/mol。分子对接结果表明,舒肝宁注射液可通过多成分干预多个靶点,调控乙型病毒性肝炎信号通路,发挥治疗乙型病毒性肝炎的作用。

图7 分子对接示意图Fig.7 Diagram of molecular docking
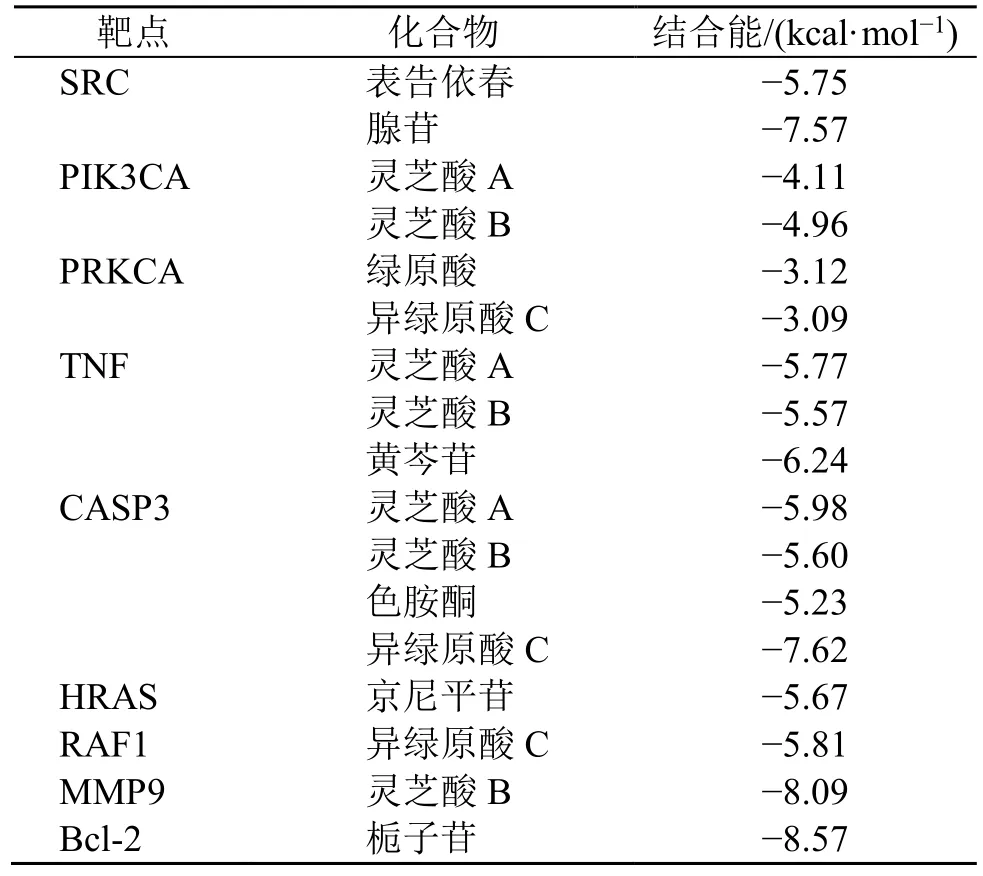
表2 分子对接结果Table 2 Molecular docking results
4 讨论
早在2016年,全球卫生组织已经发布“到2030年消除病毒性肝炎”的战略目标[18],由此可见因HBV引起的乙型病毒性肝炎目前仍属于全球公共卫生问题。近年来,相对于西医的抗病毒治疗法,中医药使用的中药复方、中成药治疗更受欢迎。舒肝宁注射液是以《伤寒论》中的经典名方“茵陈蒿汤”为基础加减而成。中医辨证论治注重扶正祛邪,而舒肝宁注射液在原有组方“祛邪”的基础上增加了“扶正”的功效,以清热解毒、利湿退黄为主,益气扶正、保肝护肝为辅,突出了中医辨证论治的特点。
本研究运用网络药理学的方法探讨舒肝宁注射液对于乙型病毒性肝炎的治疗作用机制。运用文献检索的方式得到舒肝宁注射液组方组成提取物中的19个活性成分。结合活性成分靶点与疾病靶点进行分析,通过构建PPI网络,筛选出舒肝宁注射液治疗乙型病毒性肝炎的靶点有SRC、HSP90AA1、RELA、PIK3CA、EGFR等142个,对其进行聚类分析共得到6个显著聚类团。GO功能富集对舒肝宁注射液治疗乙型病毒性肝炎靶点结果显示,BP主要涉及对含氧化合物的反应、生物过程与细胞过程的正向调节;CC主要包括胞质部分以及细胞质;MF主要是蛋白的结合。KEGG通路分析显示,IL-17信号通路、TNF信号通路、C型凝集素受体信号通路、丙型病毒性肝炎、乙型病毒性肝炎等通路可能与舒肝宁注射液治疗乙型病毒性肝炎有关。IL-17是辅助性T细胞亚群的标志性促炎细胞因子,可通过诱导新基因转录或稳定靶mRNA来调控炎症基因的表达[19]。
通过“药材-活性成分-靶点”网络分析,以灵芝酸A、灵芝酸B、异绿原酸C、京尼平苷、栀子苷、黄芩苷为主要活性成分。灵芝酸A/B同属灵芝三萜类化合物,有抗氧化、保肝护肝的效果。相关报道中,灵芝酸A可调控脂代谢、降低炎症因子的表达、抑制核因子-κB(NF-κB)通路表达来改善多种情况造成的肝损伤[20]。异绿原酸C是一种天然有机酸,临床上具有抗炎、抗病毒、保肝护肝等作用。Hao等[21]发现异绿原酸存在的抗氧化性可通过抑制乙型病毒性肝炎的指标性成分(HBsAg和HBeAg)的产生以达到预防、治疗乙型病毒性肝炎的效果。京尼平苷是中药栀子的主要抗炎活性成分,在保肝利胆上也有显著作用。研究表明,京尼平苷能通过抑制NF-κB、p38丝裂原活化蛋白激酶(MAPK)等相关通路来抑制促炎因子释放、提高抗炎因子水平而达到抗炎的效果[22]。大量研究表明,栀子苷具有抗炎镇痛、治疗脂肪肝等作用。对于非酒精性脂肪性肝病造模地鼠,栀子苷可使天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)含量趋于正常水平[23]。CD14在肝细胞中可以被检测,且CD14可作为脂多糖的受体,介导脂多糖发生的细胞炎症反应。而黄芩苷可通过抑制CD14表达,从而抑制脂多糖诱导的Toll样受体65(TLR65)/核因子-κB(NF-κB)p14通路的激活从而抑制炎症的产生[24]。
在对乙型病毒性肝炎通路的数据分析中提示,组成舒肝宁注射液的5种中药提取物的13个活性成分,灵芝酸A/B、表告依春、靛玉红、京尼平苷、异绿原酸C等可共同作用于SRC、PIK3CA、CASP3、BCL2、TNF、RAF1、MMP9等16个有关乙型病毒性肝炎通路的靶点。研究表明,缺氧条件下SRC会在KCs(肝脏中的一类常驻巨噬细胞群)中被激活,从而达到抑制肝脏炎症的效果[25]。研究发现,由乙型肝炎病毒感染相关的肝细胞癌与PIK3CA基因的突变显著相关[26]。TNF具有很强的促炎和免疫调节能力,其中的TNFR1与TNFR2受体共同协作可对炎症性肝病起作用[27]。细胞凋亡在肝脏疾病中有重要作用,研究表明,当由外源物质引起的过度炎症或氧化应激会增加肝细胞凋亡[28],包括促凋亡标志物CASP3表达增加以及抗凋亡蛋白Bcl-2表达减少,最终导致肝损伤。乙型肝炎病毒的X蛋白(HBVX)的反式激活是RAF1激活的间接结果[29]。也有实验表明MMP9的表达在具有HBV-X表达的细胞中显著上调[30],证明了MMP9在炎症因子表达中的重要作用。分析发现,乙型病毒性肝炎通路富集到的靶点与PPI核心靶点有9个重叠基因(SRC、PIK3CA、PRKCA、TNF、CASP3、HRAS、RAF1、MMP9、Bcl-2),分子对接结果显示,以上9个靶点与其对应的活性成分对接结果较好,提示其可能为舒肝宁注射液治疗乙型病毒性肝炎的关键靶点。
综上所述,舒肝宁注射液治疗乙型病毒性肝炎的分子机制可能是通过其环烯醚萜苷类、腺苷类、三萜类及吲哚类生物碱等成分干预SRC、PIK3CA、PRKCA、TNF等关键靶点进而调控乙型病毒性肝炎信号通路,发挥治疗乙型病毒性肝炎的作用。
利益冲突所有作者均声明不存在利益冲突
