内镜下纵行切开联合曲安奈德注射治疗化学烧伤性食管狭窄的特征分析及效果评价
2024-03-26陈虹羽徐梦楠李曼华张小朋李白容范崇熙宁守斌
陈虹羽,徐梦楠,张 静 ,郭 瑞,陈 晓,李曼华,张小朋,银 新,李白容,孙 涛,范崇熙,宁守斌
(1安徽医科大学空军临床学院消化内科,2空军特色医学中心消化内科,北京 100142)
据估计,全球每年有数万人因摄入化学腐蚀性物品而出现食管烧伤,其中80%发生在5岁以下的儿童中[1],成人摄入腐蚀性物质除误服外,往往伴有自杀倾向,且成人摄入腐蚀物的量往往高于儿童,加之腐蚀物对咽部的强烈刺激,导致上消化道和呼吸道的损伤更为严重[2]。瘢痕愈合致狭窄是食管化学烧伤后的晚期并发症,可能导致患者严重的全身后遗症,包括生理结构畸形、营养不良相关性疾病、反复误吸导致呼吸道感染、心理障碍等[3]。食管狭窄常见的临床治疗包括手术、探条或球囊扩张术、支架置入术、食管重建术、局部激素注射等[4-7]。
内镜下狭窄切开术(endoscopic incision,EI)是一种近年来发展起来的微创治疗方式[8-9],空军特色医学中心消化内科采用内镜下纵行切开联合曲安奈德局部注射或联合支架置入治疗成人化学腐蚀性食管狭窄15例,分析报道如下。
1 对象与方法
1.1 对象
以2019年2月至2023年2月在空军特色医学中心消化内科治疗的15例化学烧伤性食管狭窄患者为研究对象。纳入标准:①吞服腐蚀物烧伤造成的食管狭窄;②一般情况可耐受全身麻醉及内镜治疗者;③治疗停止后随访≥6个月。排除标准:①食管狭窄合并食管瘘或活动性炎症;②存在曲安奈德超敏反应;③依从性差未及时治疗导致狭窄反复难治者。
器材:胃镜(EG-600WR,日本FUJIFILM公司)、锥形透明帽(DH-28GR,日本FUJIFILM公司)、注射针(WS-2423PN2304,上海威尔逊光电仪器有限公司)、切开刀(KD-620UR,日本Olympus公司)、导丝(ACRO-35-480,美国COOK公司)、曲安奈德注射液(1 mL∶40 mg,昆明积大制药)、高频电刀(VIO300S,德国ERBE公司)、定制全覆膜金属支架(CZES-Ⅲ,中国江苏淮安西格玛公司)。
1.2 方法
1.2.1 术前准备 ①一般情况术前评估:包括基础疾病评估、凝血功能及肝肾功能评估、心肺功能的评估、麻醉风险评估等;②食管狭窄术前评估:通过食管造影、纵膈CT、胃镜、内镜超声等检查明确食管狭窄的位置、严重程度、长度、结构特点(环周狭窄或者偏心性狭窄)、狭窄部位食管壁增厚程度以及狭窄段有无瘘或活动性炎症;③术前常规应用质子泵抑制剂预防术中出血,禁食水12 h;④签署手术知情同意书。
1.2.2 内镜下治疗步骤
1.2.2.1 内镜下纵行切开 内镜前端附锥形透明帽,首选瘢痕组织最厚的一侧食管壁进行切开(切开前可结合超声内镜或CT结果选择位置),自浅入深逐步切开瘢痕组织,直到暴露出浅肌层;之后将切开刀插入瘢痕纤维组织与环形肌之间,保持良好视野,向管腔中心上翘内镜,进行瘢痕全层切开,直至内镜无阻力通过狭窄段达到治疗目标(图1)。对于不能经一个部位纵行切开通过狭窄段者,也可以选择两个或多个方位分别纵行切开狭窄段;对于重度狭窄,术中管腔难以辨认,可辅以斑马导丝置入狭窄段,在导丝指引下进行切开(图2)。每4~8周进行一次切开治疗,直至达到黏膜愈合后内镜无阻力通过状态(图3)。
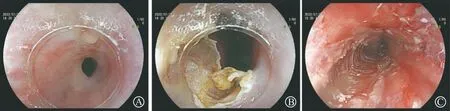
A:化学烧伤性食管狭窄病变内镜图;B:内镜下切开狭窄处瘢痕组织;C:广泛切开狭窄处病变后,食管管腔通畅。
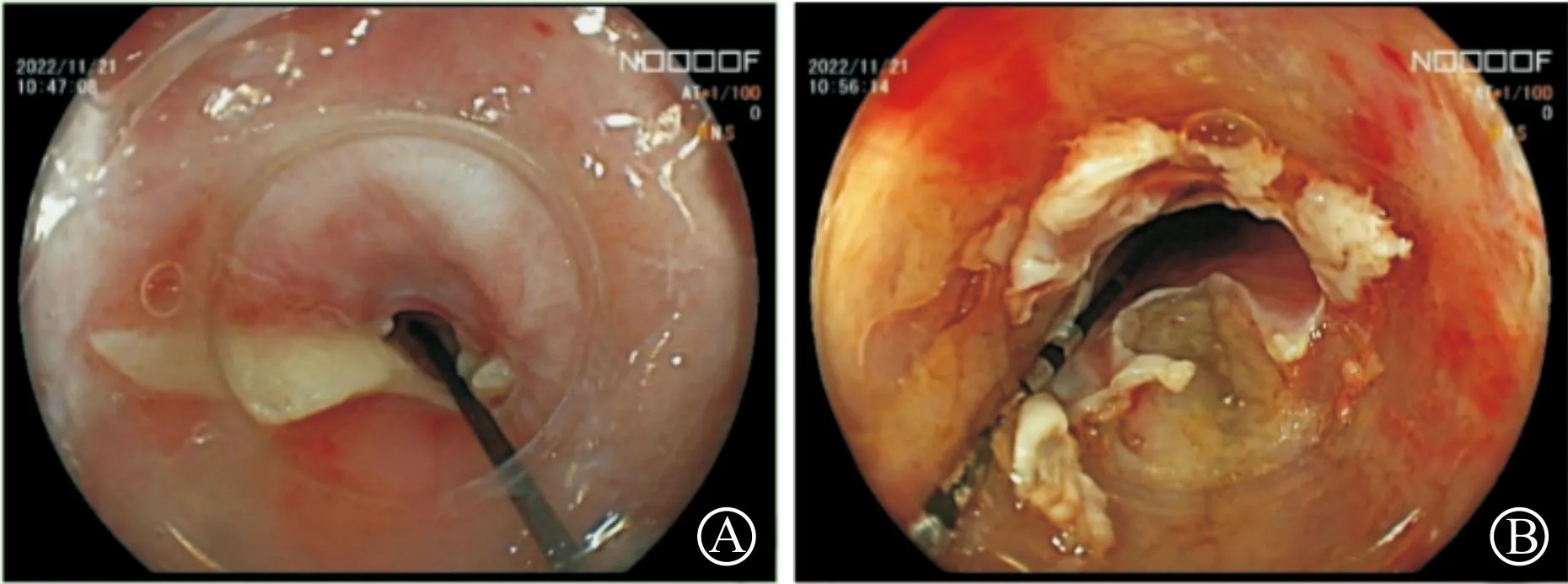
A:导丝通过食管狭窄病变处;B:导丝引导下内镜切开狭窄处瘢痕组织。
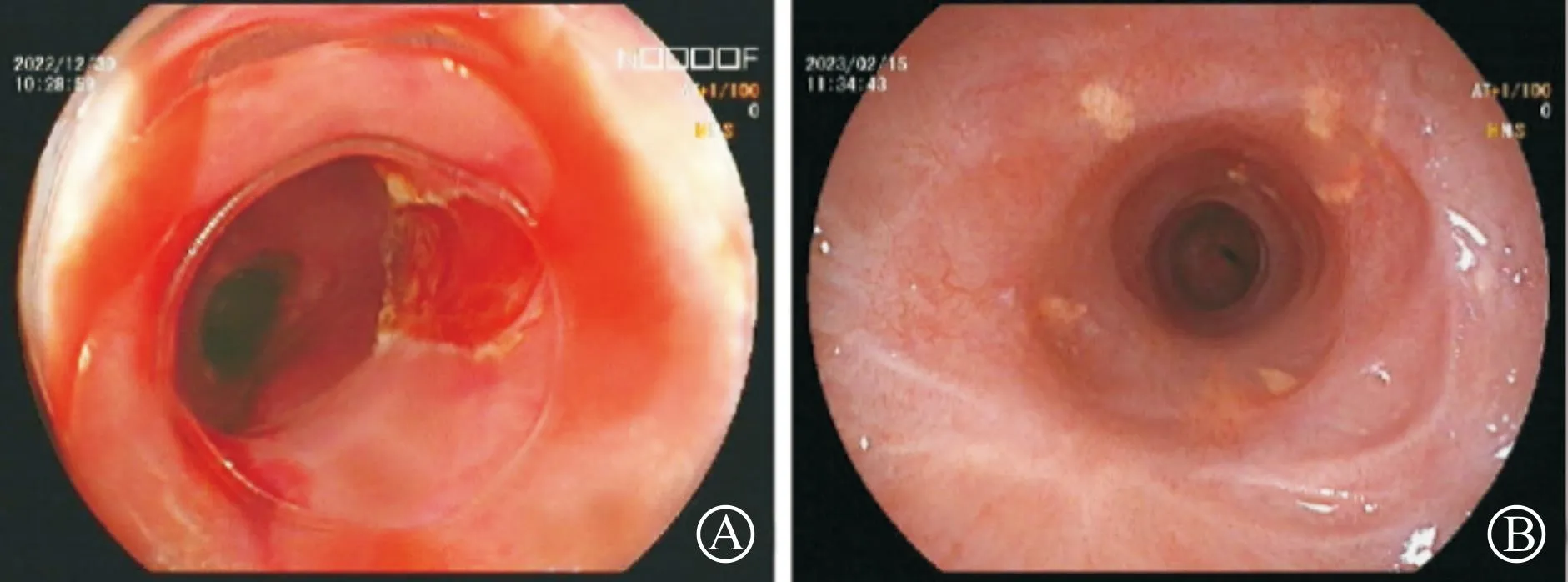
A:定期切开食管狭窄病变黏膜;B:食管狭窄患者定期复查内镜图。
1.2.2.2 手术并发症的预防及处理 完成内镜下切开术后需要仔细检查创面,判断有无出血或穿孔。对有活动性出血部位,进行镜下电凝或钛夹止血,如果发现有局部微小穿孔或肌层切开较深可疑穿孔者,可予以内镜下钛夹缝合。对于穿孔直径≥1 cm,内镜下钛夹缝合效果不确切者,需给予全覆膜金属支架放置。
1.2.2.3 药物局部注射 狭窄切开后,给予创面周边黏膜下层多点注射曲安奈德溶液,约0.2 mL/点位,间隔长度为0.5 cm,根据狭窄长度应用剂量为120~200 mg不等(狭窄长度≤5 cm者注射120 mg,>5 cm且≤10 cm者注射160 mg,>10 cm者注射200 mg)。
1.2.2.4 覆膜支架植入 对于反复切开治疗后食管管腔仍在短期内回缩或长段食管狭窄者(≥8 cm),可根据患者食管狭窄长度、是否存在反流等定制全覆膜金属支架并在切开及曲安奈德注射治疗后置入(图4)。

图4 内镜切开化学烧伤性食管狭窄病变后置入定制金属支架
1.2.3 术后处理 术后给予抑酸、止血、补液等治疗。对于术中未发生穿孔者,术后常规禁食24 h,无明显胸痛、黑便等症状可恢复流食。对于术中有肌层明显损伤或穿孔者酌情给予抗生素治疗,禁食水3~5 d,期间给予静脉营养支持,造影提示无造影剂外漏后恢复流食。
1.2.4 效果评价 患者吞咽困难程度根据Stooler分级进行评估,0级为无症状,能进各种食物;1级为偶尔吞咽困难;2级为仅能进半流质、流质饮食;3级为仅能进流质饮食;4级为不能进食、咽水。效果评价依据吞咽症状改善程度进行评定,分为短期疗效评定及中长期疗效评定,评定时患者为非支架置入状态。短期疗效评定(末次治疗后8周):①显效,Stooler分级较入院时降低≥2级者;②有效,Stooler分级比治疗前降低1级或食管最窄孔径较前无改善但原狭窄节段长度缩短>50%者;③无效,Stooler分级及狭窄节段较治疗前无改善或加重者。中长期疗效评定(末次治疗后6个月):Stooler分级为0~1级人数。内镜操作时间指从内镜进镜至内镜退出结束手术所用时间。
以上操作通过空军特色医学中心伦理委员会审查及批准(许可证号:空特(科研)第2022-120-PJ01号)。
2 结果
本研究中15例患者,男8例,女7例,年龄25~65[平均(44.9±2.8)]岁。患者中53.3%(8/15)误服强碱、20.0%(3/15)误服强酸、13.3%(2/15)误服有机磷溶剂、13.3%(2/15)误服情况不明。33.3%(5/15)患者在外院接受过扩张治疗,66.7%(10/15)患者入院前未接受食管狭窄相关治疗。
患者食管狭窄平均长度(7.53±4.88)cm,其中33.3%(5/15)患者食管狭窄长度≤5 cm、40.0%(6/15)患者食管狭窄长度≥8 cm。狭窄部位数以单处狭窄约80.0%(12/15),2处及3处狭窄者分别占13.3%(2/15)和6.7%(1/15)。治疗前Stooler分级4级者占86.7%(13/15),3级者占13.3%(2/15)。部分患者术前食管造影食管管腔狭窄、蠕动减弱、造影剂通过明显受阻、延迟,近端食管扩张(图5A)。

图5 化学烧伤性食管狭窄患者术前食管造影(A)、在内镜下切开治疗后置入定制支架造影(B)、经内镜下切开联合曲安奈德注射及食管支架治疗后食管造影(C)
15例患者共行内镜下食管狭窄切开联合曲安奈德注射治疗59次,平均手术用时(31.73±11.36)min,治疗过程中合并支架置入6例,其中4例因狭窄节段较长(≥8 cm)且炎症较重遂给予支架置入,2例因多次切开后仍不能长期维持管腔通畅合并应用支架治疗(图5B)。
末次治疗8周,治疗显效率73.3%(11/15),有效率6.7%(1/15),总有效率80%。15例患者中有1例患者经4次治疗后食管狭窄长度由4.0 cm缩减至1.5 cm,但Stooler分级较前无明显改善,评估为治疗有效,仍在继续切开治疗。3例患者治疗无效,1例患者选择继续维持切开治疗,2例患者后续接受胃代食管术、胃造瘘术治疗。15例患者治疗前Stooler中位分级4(4,4)级,末次治疗后8周Stooler中位分级1(-3,0)级,末次治疗8周后Stooler中位分级差值-3(-4,0)级,差异有统计学意义(P=0.001),提示末次治疗8周后吞咽困难情况明显改善(图5C),随访至末次治疗后6个月60%(9/15)患者Stooler分级0~1级。BMI中位值治疗前中位值为18.8(15.6,20.2)kg/m2,末次治疗8周后BMI中位值为21.2(18.4,23.2)kg/m2,同一患者治疗前后BMI差值的中位值为1.7(0.02,3.7)kg/m2,差异有统计学意义(P=0.02),治疗后体质量较前明显增长。其中2例患者在切开联合曲安奈德治疗1次后食管即可长期维持通畅,2例患者在治疗2次后食管长期维持通畅。
15例患者共行59次纵行切开治疗,其中有3次出现肌层损伤或微小穿孔,均给予术中钛夹封闭,未出现需要支架置入及外科手术介入的穿孔,未出现出血、术后明显疼痛等并发症。未出现支架置入术后嵌顿情况(表1)。
3 讨论
腐蚀剂吞入食管急性期愈合后可形成瘢痕而导致程度不同的食管狭窄,狭窄的好发部位、程度、范围,取決于腐蚀剂的种类、浓度、数量、作用时间和条件[4,10-11]。酸和碱会产生不同类型的组织损伤。酸引起凝固性坏死,焦痂形成可能限制物质穿透和损伤深度;相反,碱与组织蛋白结合,引起液化性坏死和皂化作用,并借助较高的黏度和通过食管的较长接触时间,深入组织;此外,碱的吸收会导致血管内血栓形成,阻碍血液流向已经受损的组织,相对于强酸烧伤的凝固性坏死程度更重,损伤部位更深,更易形成狭窄或穿孔[12-15]。30%氢氧化钠溶液可以在1 s内产生全层损伤。对于化学腐蚀性食管狭窄的治疗,目前常用的治疗方法有外科手术和内镜下治疗[4]。外科手术食管重建创伤大、并发症多,影响患者生活质量,且有吻合口再狭窄的风险,不作为首选[5]。传统内镜下治疗包括扩张治疗、食管支架治疗、激素局部注射等[4,8,16-17],扩张仍然是治疗各种良性食管狭窄的一线选择[9,18]。一般情况下,1~3次扩张即可缓解简单型狭窄的吞咽困难,而腐蚀性狭窄往往属于复杂性狭窄甚至难治性狭窄,常需要进一步、间隔更近的后续扩张[19-20]。反复扩张给患者带来不适和不便,加重经济负担,而且暴力的撕裂对于食管化学腐蚀后肌层溶解的部位穿孔概率较高[21]。食管支架置入可给狭窄处的食管提供持续、均匀的径向扩张力,但是单纯的支架置入由于瘢痕组织未被离断或祛除,拔出支架后会快速再狭窄[22]。曲安奈德是一种合成皮质类固醇,通过减少胶原的合成和使胶原酶抑制物如α2-巨球蛋白和α2-抗胰蛋白酶水平降低,从而引起瘢痕疙瘩内部胶原纤维溶解,使瘢痕变软、萎缩而达到治疗的目的[23]。国内最新共识意见推荐曲安奈德应用于良性食管狭窄的治疗[16]。
内镜下切开治疗可以主动选择狭窄段瘢痕最厚的部位切开,且同时对冗余的瘢痕组织进行切除,是治疗良性难治性狭窄的一种快速、相对简单和安全的替代方式[24],尤其是Schatzki环和吻合口狭窄[9]。LEE等[25]报道了该技术在24例既往无扩张的吻合口狭窄患者中的应用,经过2年的随访,87.5%的患者在1次治疗后吞咽困难可得到明显缓解。近期一项应用内镜下放射状切开治疗难治性食管胃吻合口狭窄的研究中[26],93.8%(30/32)的患者吞咽困难得到显著改善,且无严重并发症发生,且术后12个月内超过60%的患者吞咽障碍仍有改善。因此,虽然狭窄切开术作为食管狭窄的二线治疗,其有效性似乎已被广泛接受,但并未在化学腐蚀性狭窄中广泛应用。
本研究对食管化学烧伤性患者首先采用镜下切开/切除纤维瘢痕组织,临时解除狭窄,为食管生理管腔的恢复提供空间,进而给予新生黏膜生长的环境,同时在创面局部注射曲安奈德抑制术后纤维瘢痕组织的生长,为新生黏膜覆盖术后创面提供窗口期。对于长节段狭窄或反复切开治疗后疗效欠佳的难治性狭窄,可进一步局部置入定制全覆膜金属支架进行加强治疗。在内镜下切开及曲安奈德局部注射后再放置支架的好处有:①对于难治性食管狭窄放置支架后可提供持续、均匀的径向扩张力,有利于切开后吻合口新生瘢痕按照支架的直径大小进行塑形[27];②支架的覆膜对切开的创面起到良好的保护作用,可减少胃液及食物对创面的刺激,降低术后出血、再狭窄的发生率[22]。选择定制支架的依据包括:①中国人相较于欧美国家人群体格较小,食管管径较细,定制支架的管径通常为15~17 mm,即能够提供有效的支撑力,又可减轻置入后疼痛感,患者的耐受性较好;②可定制抗反流膜及倒刺预防反流及支架滑脱;③覆膜层较厚,较少出现嵌入食管而无法取出的现象。
EI术中切开深度是成功的关键。理想的深度是到达固有肌层的表面,这对操作者的控镜能力提出很高要求。切开过浅瘢痕松解不彻底,影响疗效;切口过深可能诱发食管穿孔及出血等严重并发症。同时在切开的过程中,为避免出血及穿孔的发生,应避免切开化学物质腐蚀后肌层溶解的部位,可借助超声、CT等影像学资料以及内镜下仔细观察判断瘢痕较厚侧进行切开,且在切开过程中尽量保留正常黏膜,有利于术后黏膜爬行,最终使管腔达到黏膜层愈合,维持长期通畅。
综上,内镜下切开联合曲安奈德注射是治疗化学腐蚀性食管狭窄的一种安全、有效的方法,治疗过程中亦可联合食管支架治疗,为化学腐蚀性食管狭窄的治疗提供一种新思路,但本文样本量较小,且缺乏对照组和更多有效的长期临床评价指标,其安全性及有效性仍有待于后续多中心、大样本的随机对照研究证实。
