LncRNA SNHG8在胎盘植入的表达及其对滋养细胞侵袭及迁移的影响
2024-03-26高丽娜刘小晖张玉芳刘小玲何晓春高晶张莉孙俊王秀娟董燕
高丽娜 刘小晖 张玉芳 刘小玲 何晓春 高晶 张莉 孙俊 王秀娟 董燕
甘肃省妇幼保健院产二科 (兰州 730050)
胎盘植入(placenta accreta,PA)是一种以胎盘异常侵袭植入部位为特征的妊娠并发症,是造成产后大出血及孕产妇死亡的主要病因[1]。近来年,虽然PA的确切发病机制尚不清楚[2],但滋养细胞过度侵袭迁移是PA发病的主要原因[3]。然而,滋养细胞过度侵袭迁移的具体潜在分子机制知之甚少。长非编码RNA(lncRNA)是一种非编码RNA[4],其通过多种机制调控基因表达,包括基因组相互作用、蛋白质含量、miRNA竞争和染色质修饰等[5]。随着表观遗传的发展和高通量RNA测序技术的不断进步,已经明确并验证了lncRNAs在子痫前期[6]、复发性流产[7]、胎儿生长受限[8]等产科疾病中参与该疾病的分子机制。然而,关于PA的RNA测序在近几年才相继报道[9],其中lncRNA在PA中的具体机制研究更是鲜为少见。本课题组前期研究发现lncRNA SNHG8在PA中的异常表达,通过生物信息学软件发现与miR-542-3p的结合位点,但其生物学功能和潜在机制尚不清楚。本研究通过体外培养人绒毛膜滋养细胞系,探讨lncRNA SNHG8对滋养细胞功能行为影响,阐明PA的关键致病分子,丰富对PA病因的认识,可为临床防治提供有效的诊断标志物或治疗靶点。
1 资料与方法
1.1 研究对象本研究经甘肃省妇幼保健院伦理委员会审查批准,批件号:(2023)GSFY伦审[05]号。选取2020年5月至2022年2月本院住院患者纳入研究对象。PA组为胎盘植入孕妇30例,诊断标准均符合《胎盘植入诊治指南(2015)》诊断标准[10]:分娩前经临床高危因素结合彩色多普勒超声和(或)MRI征象评估,且最终确诊根据手术中或分娩时所见或分娩后的病理学诊断。对照组(PC组)为同期妊娠单胎孕妇30例,排除标准如下:多胎妊娠、呼吸系统疾病、妊娠期高血压疾病、慢性肾炎、自身免疫性疾病、血糖异常者、心脏病、血栓性疾病、HELLP综合征、胎儿畸形等。所有参与者在甘肃省妇幼保健院签署知情同意书。两组孕妇年龄差异无统计学意义(P> 0.05),孕周、孕次、产次及剖宫产次数均差异有统计学意义(P<0.05)。见表1。
表1 PC组和PA组临床资料比较Tab.1 Comparison of clinical data between PC and PA groups ±s
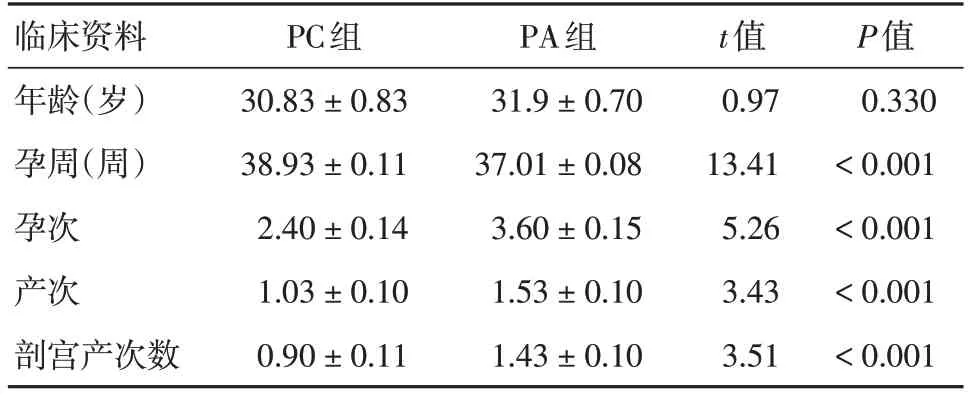
表1 PC组和PA组临床资料比较Tab.1 Comparison of clinical data between PC and PA groups ±s
临床资料年龄(岁)孕周(周)孕次产次剖宫产次数PC组30.83 ± 0.83 38.93 ± 0.11 2.40 ± 0.14 1.03 ± 0.10 0.90 ± 0.11 PA组31.9 ± 0.70 37.01 ± 0.08 3.60 ± 0.15 1.53 ± 0.10 1.43 ± 0.10 t值0.97 13.41 5.26 3.43 3.51 P值0.330< 0.001< 0.001< 0.001< 0.001
1.2 主要试剂人绒毛膜滋养层细胞(HTR8/SVneo)购于上海盖宁公司;胎牛血清、RPMI-1640培养基购自美国Gibco公司;逆转录试剂盒、荧光定量试剂盒购于日本Takara公司;lip2000购于美国Invitrogen公司;青链霉素、胰蛋白酶消化液购于北京索莱宝公司;Matrigel基质胶购自美国BD公司;Transwell小室购于美国Corning公司;总RNA提取试剂盒购于北京天根公司;lncRNA SNHG8、GAPDH引物由上海生工公司合成,miR-542-3p、U6引物有广州锐博公司合成;lncRNA SNHG8干扰片段及过表达质粒由上海吉玛公司构建,MMP-2和MMP-9抗体购于美国Abcam。
1.3 细胞培养及转染在适当的条件下(37 ℃、5% CO2)培养,取对数生长期的滋养细胞进行传代,按说明书添加助转试剂,将细胞分3 组:Control组(空白组)、si-NC组(干扰对照组)、si-SNHG8组(干扰lncRNA SNHG8组)。
1.4 Transell实验Matrigel基质胶加入腔室,转染后的细胞(2 × 104个细胞)用无血清培养液接种于上腔室,对应的底腔室加入700 μL含 15%血清培养基,孵育48 h后,用4%多聚甲醛固定下室细胞30 min,结晶紫染色10~15 min,用显微镜拍照。染色细胞使用 Image-J来计数细胞数量。
1.5 划痕实验预处理后细胞在完全培养液中培养细胞以达到近100%融合,用1 000 μL无菌枪头划痕,无血清培养基冲洗后用显微镜拍照,并用新鲜培养基培养,收集0 h和 24 h创面愈合情况,伤口愈合率计算公式:(初始面积-最终面积)/初始面积×100%。
1.6 Real-time PCR 检测按照总RNA提取试剂标准程序,从胎盘样本和滋养细胞中制备总RNA,使用PrimeScript RT reagent Kit逆转录合成cDNA,然后使用qRT-PCR仪进行扩增。GAPDH,上游,5′-TGGCAGGTAGGCGGTTGTGTAGA-3′;下游,5′-ATGGCATCGTGCCTGGTCATAT-3′;U6 上游,5′-GCATATATAACCACGAGTTCAGGAAT-3′;下游,5′-CGCGGAGTTCACTCGCTAGTGCAT-3′;miR-542-3p上游,5′-TCGGGGATCATCATGTCACG-3′;下游,5′-GAGTGGCTCCCAGACCTTTC-3′;lncRNA SNHG8,上游,5′-AAGTTTACAAGCATGCGCGG-3′;下游,5′-TCAAACTGACGGTTCTCGGG-3′。
1.7 Western blot实验按分组干扰细胞48 h后,严格按照细胞蛋白提取试剂盒提取蛋白并测蛋白浓度。配制10%分离胶进行电泳,湿转法转到PVDF膜,5%脱脂奶粉室温封闭2 h,一抗4 ℃孵育过夜。一抗MMP-2抗兔(1∶1 000,Abcam),一抗MMP-9抗兔(1∶1 000,Abcam),一抗GAPDH抗兔(1∶5 000,protrintech),次日取出用PBS洗3次,每次10 min,二抗抗兔(1∶5 000,abmart)s室温2 h,PBS洗3次,每次10 min,蘸取发光液在曝光机进行曝光并保存,用Image Lab统计。
1.8 统计学方法使用 Prism 7.0 统计软件分析实验数据,结果以均数±标准差表示。相关性分析采用Pearson相关分析,两组间均数采用独立样本t检验比较,以P< 0.05为差异有统计学意义。
2 结果
2.1 LncRNA SNHG8在 PA胎盘组织中的表达及与患者产前超声评分的相关性qRT-PCR 检测显示,与PC组(n= 30)比较,PA 组(n= 30) 胎盘样本中lncRNA SNHG8的表达水平显著升高(P< 0.01),同时,PA患者的lncRNASNHG8的表达与产前超声评分呈正相关(P< 0.01),提示lncRNA SNHG8表达异常可能与PA有关,可作为PA的诊断标志物。见图1。
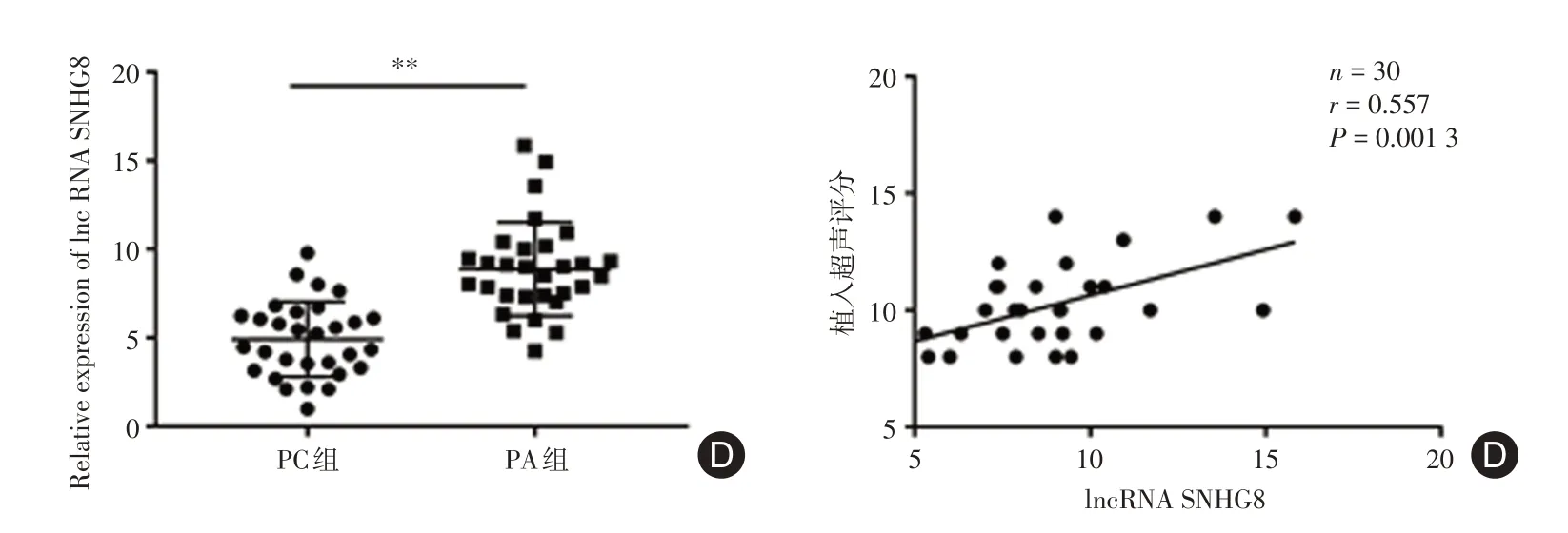
图1 PC组和PA组胎盘中lncRNASNHG8的表达水平及与产前超声评分的关系Fig.1 The expression level of lncRNA SNHG8 in placenta of PC group and PA group and its relationship with prenatal ultrasound score
2.2 LncRNA SNHG8干扰片段的自身验证检测lncRNA SNHG8干扰片段的效率发现,si-SNHG8-1和si-SNHG8-2组中lncRNA SNHG8表达均低于si-NC组(P< 0.01,P< 0.05),见图2。但si-SNHG8-1干扰效率比si-SNHG8-2更佳,故选用si-SNHG8-1继续后续实验。
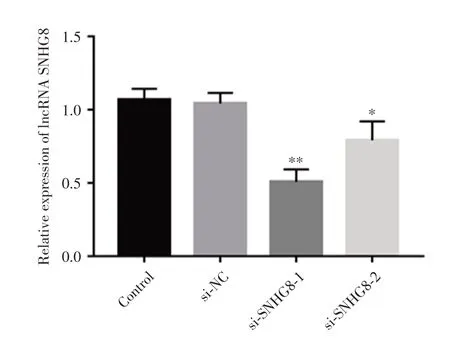
图2 转染干扰片段后lncRNA SNHG8的表达Fig.2 Expression of lncRNA SNHG8 after transfection of interference fragments
2.3 干扰lncRNA SNHG8后对滋养细胞侵袭能力影响Transwell 侵袭迁移实验结果显示:与si-NC组比较,si-SNHG8组侵袭迁移细胞数明显减少(P< 0.01);划痕实验结果示,与si-NC组比较,si-SNHG8组迁移率降低(P< 0.05),提示干扰lncRNA SNHG8可抑制滋养层细胞的侵袭能力。见图3。
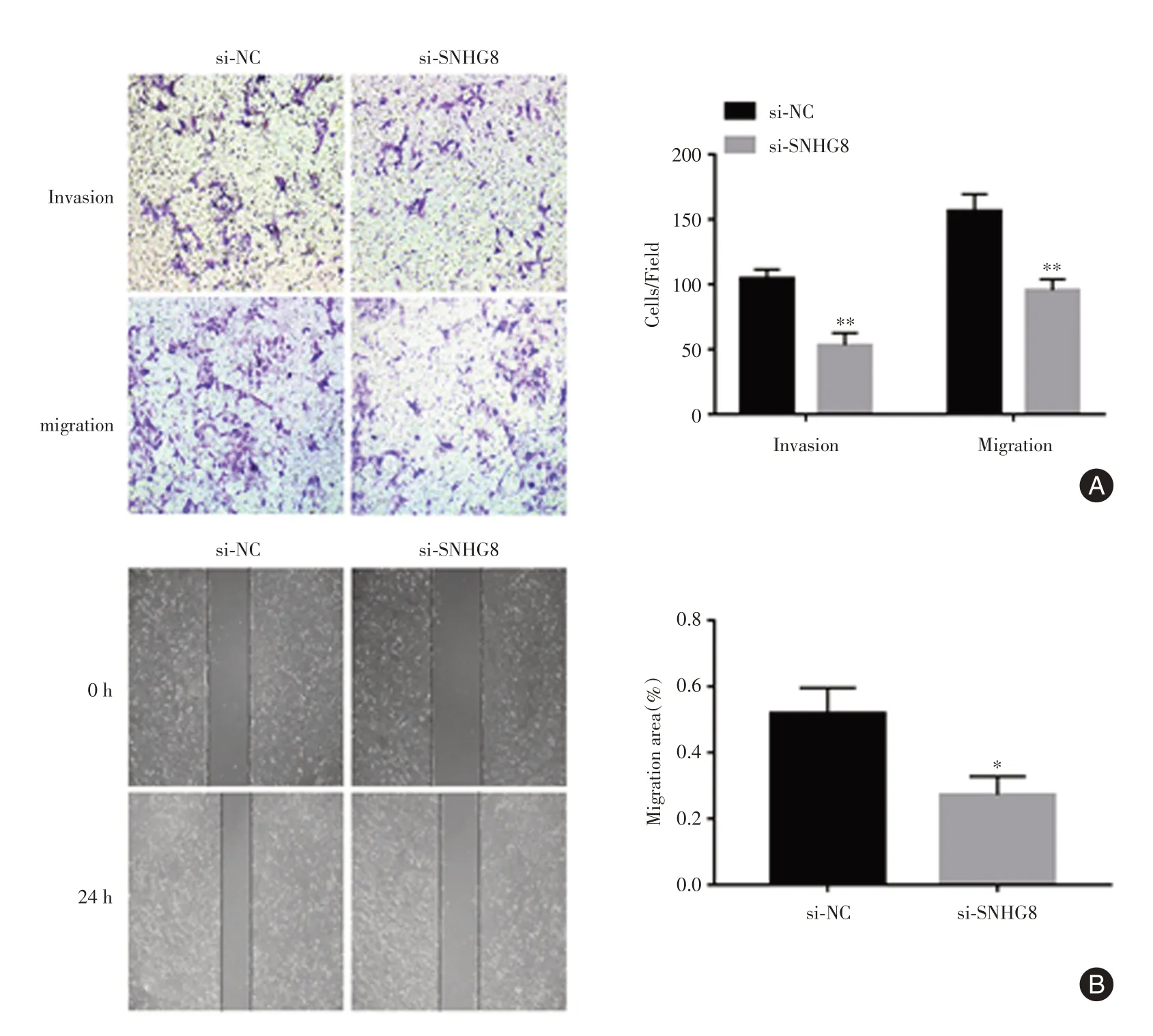
图3 干扰lncRNA SNHG8对滋养细胞侵袭迁移影响Fig.3 Effect of interfering lncRNA SNHG8 on trophoblast invasion and migration
2.4 干扰lncRNA SNHG8后对滋养细胞MMP-2和MMP-9的影响通过瞬时转染lncRNA SNHG8干扰片段后对滋养细胞侵袭迁移相关蛋白的影响,Western blot检测显示:与si-NC组比较,si-SNHG8组的MMP-2和MMP-9蛋白表达明显降低(P< 0.01,P< 0.05)。见图4。
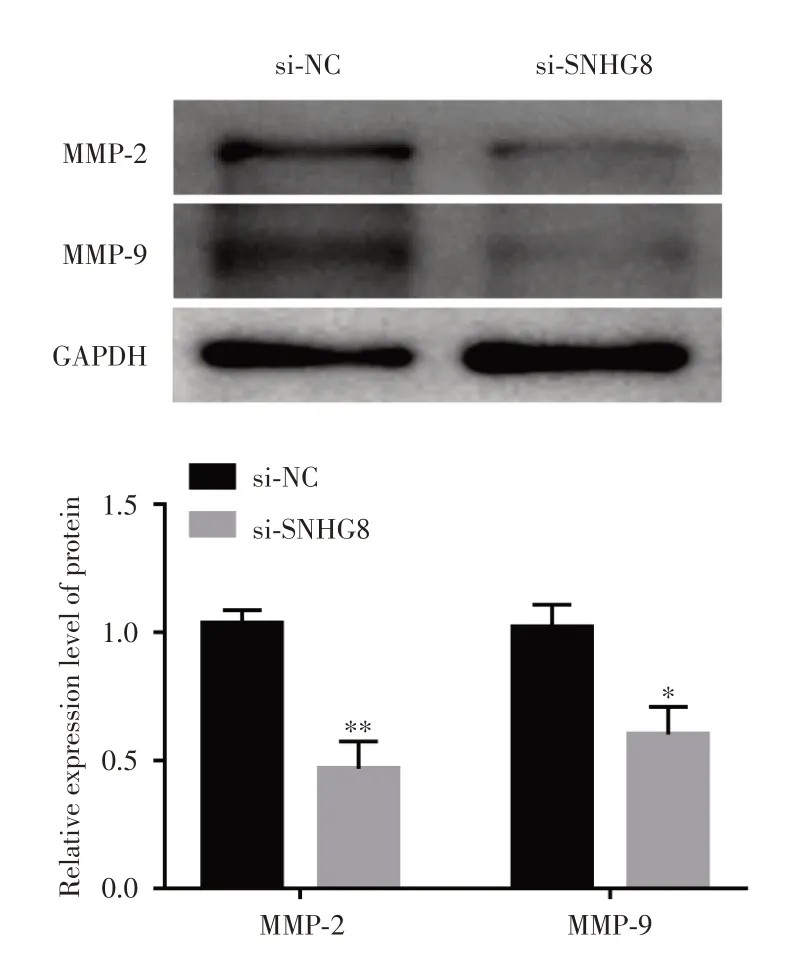
图4 干扰lncRNA SNHG8后对滋养细胞MMP-2和MMP-9影响Fig.4 Effect of lncRNA SNHG8 interference on MMP-2 and MMP-9 trophoblast cells
2.5 lncRNA SNHG8在滋养细胞的定位及miR-542-3p是lncRNA SNHG8可能作用的靶基因我们利用滋养细胞定位分析,结果显示lncRNA SNHG8在滋养细胞中主要定位于胞浆(图5A),通过Star-Base软件分析发现,miR-542-3p具有lncRNA SNHG8的结合位点(图5B),利用qRT-PCR检测在两组胎盘组织中miR-542-3p的表达,结果显示,与PC组相比,PA组中miR-542-3p的表达明显降低,将其与lncRNA SNHG8做相关分析发现,两者呈负相关,提示miR-542-3p可能是lncRNA SNHG8的下游靶基因。
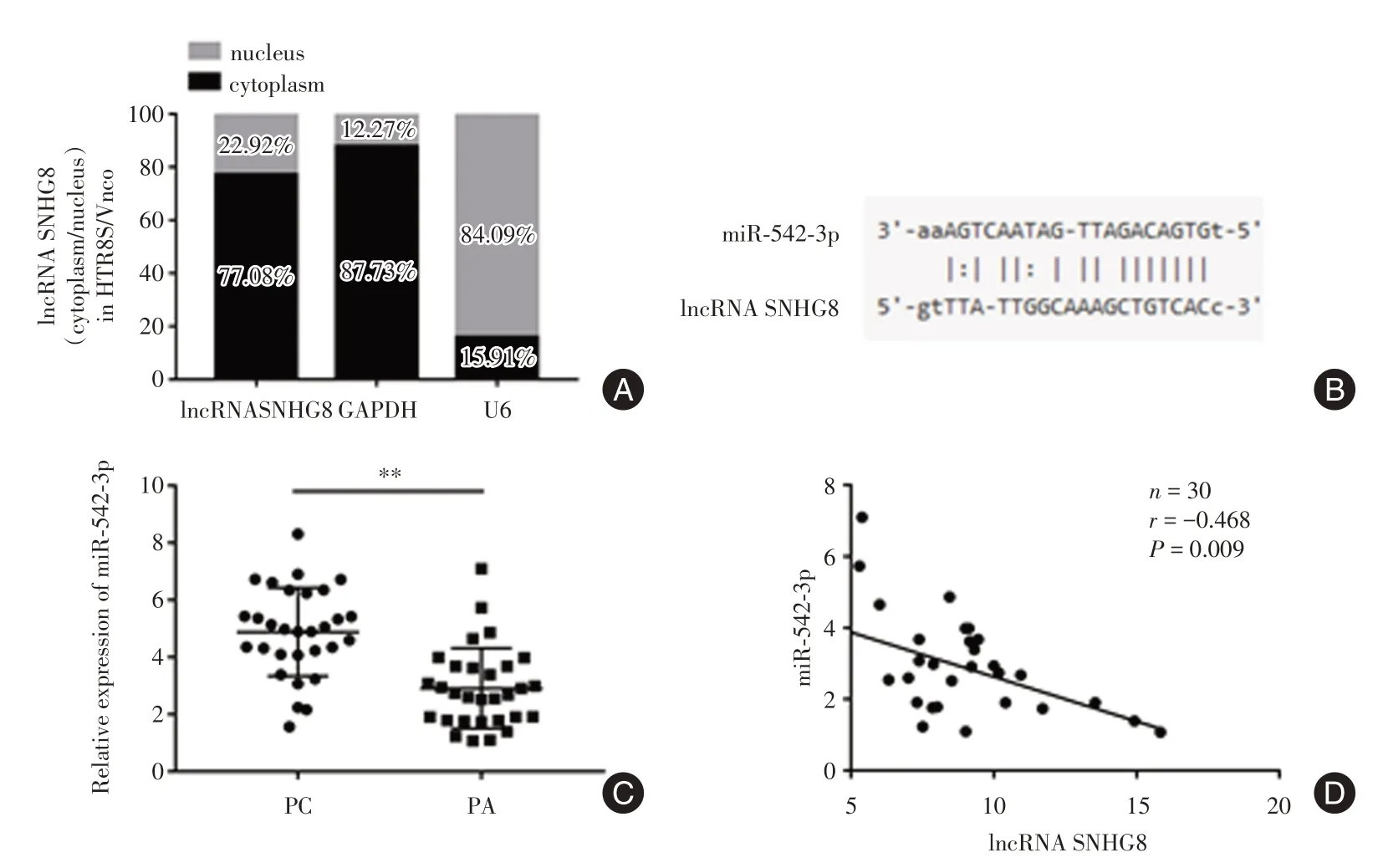
图5 LncRNA SNHG8在滋养细胞中的定位及与miR-542-3p的预测结合位点及表达Fig.5 Localization of lncRNA SNHG8 in trophoblast cells and predicted binding sites and expression of miR-542-3p
2.6 lncRNA SNHG8与miR-542-3p的靶向关系双荧光素酶报告结果显示,过表达miR-542-3p可以明显减低野生型lncRNA SNHG8的荧光素酶活性(P< 0.01),而突变型lncRNA SNHG8的荧光素酶活性未见改变,见图6。
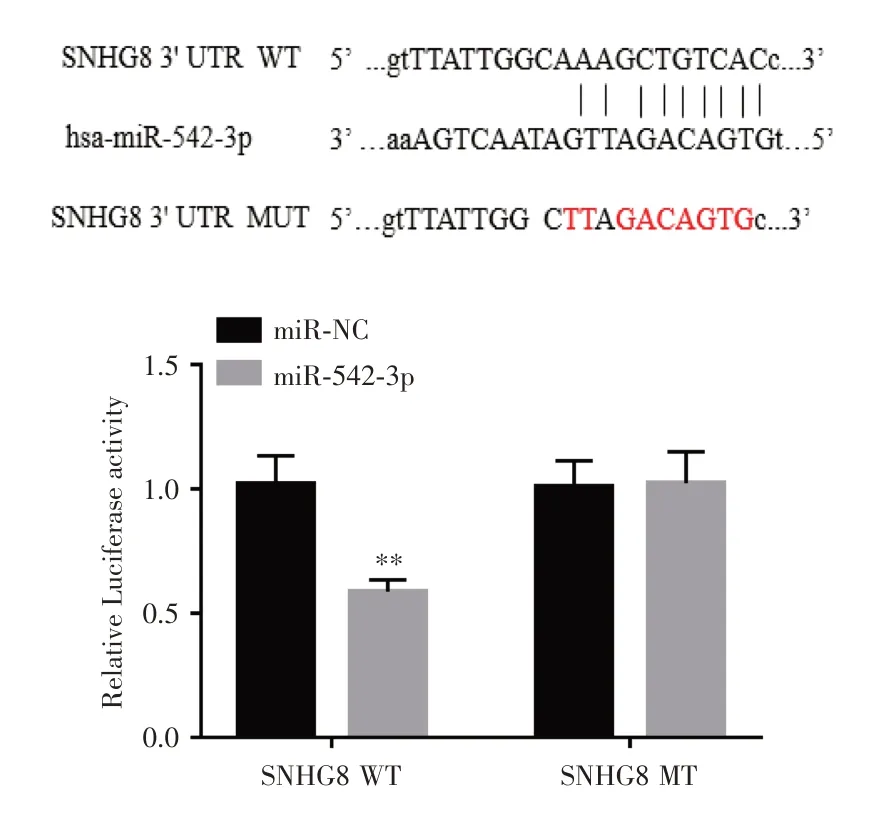
图6 双荧光素酶报告结果Fig.6 Double luciferase reports results
2.7 抑制miR-542-3p可逆转干扰lncRNA SNHG8对滋养细胞侵袭迁移的影响si-SNHG8与miR-542-3p inhibitor共转染后,与si-SNHG8+inhibitor-NC组相比,Transwell实验结果显示滋养细胞侵袭迁移能力(P< 0.05,P< 0.01);同时,划痕实验结果显示迁移率增加(P< 0.05),见图 7。
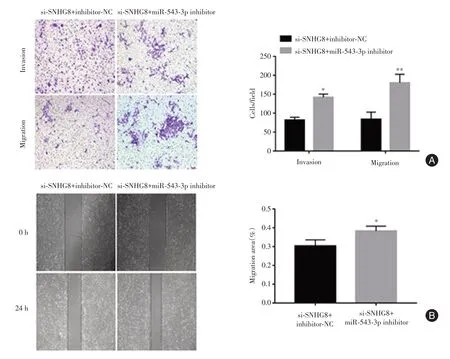
图7 抑制miR-542-3p可逆转干扰lncRNA SNHG8对滋养细胞侵袭迁移的影响Fig.7 Inhibition of miR-542-3p could reverse the effect of interfering lncRNA SNHG8 on trophoblast invasion and migration
3 讨论
PA的发病率逐年增加,据报道在0.13% ~0.18%之间,但其确切的发病机制尚未完全清楚[11]。目前提出较为公认假说包括原发性蜕膜或基板缺失、滋养细胞异常持续侵袭以及母体血管重塑异常等,其中,滋养细胞异常持续侵袭贯穿了整个发病过程[12]。滋养细胞与肿瘤细胞的行为学相似,但与肿瘤细胞不同的是,子宫内的绒毛滋养层细胞侵袭受到严格控制,以防止过度入侵[13]。然而,PA的滋养细胞侵袭是一个独特的分子转换,类似于肿瘤细胞从良性到恶性进化的机制[14],这种机制使滋养细胞可以更深入地侵入子宫肌层,完全穿过子宫肌层甚至达子宫浆膜及以上[15]。因此,分娩时胎盘与子宫内膜不可能正常分离,易导致产妇大出血和产妇死亡的风险。目前,还不清楚滋养细胞是利用其正常的侵袭机制深入子宫,还是PA胎盘差异表达基因所致。为了解决这个问题,本课题组前期取PA组胎盘植入部和正常胎盘进行RNA测序。结果发现,与妊娠年龄匹配的对照组相比,PA组样本中存在大量lncRNAs失调。其中lncRNA SNHG8在PA胎盘植入组织中上调明显的lncRNA之一,且尚未见在PA中报道,其可能是一个与胎盘植入相关的新特异性lncRNA。
LncRNAs是非编码RNA中的大亚群,在肿瘤、心血管疾病及产科疾病中已成为关键调控因子和诊断及预后标志物[16-19]。小核仁RNA宿主基因8(small nucleolar RNA host gene 8,SNHG8)属于小核仁RNA宿主基因(small nucleolar RNA host genes,SNHGs)家族,全长1 062个核苷酸。lncRNA SNHG8在癌症中异常表达并影响肿瘤进展[20]。例如,在食管鳞状细胞癌中发现SNHG8的表达升高,发现SNHG8可以通过海绵化miR-411上调KPNA2的表达[21],从而影响癌症的进展。在胃癌中,SNHG8在癌组织和细胞中表达增加,在体外中发现其敲除可抑制癌细胞增殖和侵袭[22]。此外,FAN等[23]报道SNHG8在乳腺癌组织和细胞中也表达上调。此外,敲除SNHG8对乳腺癌细胞生长、迁移和侵袭有明显的抑制作用。近期研究[3]发现,无论是从分子机制还是表型,PA与肿瘤极其相似。由此,我们推测lncRNA SNHG8可能参与PA滋养细胞侵袭迁移调节机制。为了明确其在PA的作用机制,我们的结果验证发现在PA胎盘组织中lncRNA SNHG8高表达,并与PA患者的产前超声评分呈正相关,这表明lncRNA SNHG8可能是一个潜在的生物标志物。为了确定lncRNA SNHG8是否通过调节滋养细胞侵袭和迁移参与PA,我们体外培养HTR8/SVneo细胞,干扰lncRNA SNHG8后可降低滋养细胞的侵袭和迁移能力,同时,侵袭迁移相关蛋白MMP-2和MMP-9蛋白表达也明显降低,提示lncRNA SNHG8可能是PA的一个潜在致病因子。越来越多的证据证实,lncRNAs与miRNAs结合,负向调控miRNAs的表达,从而调控滋养细胞的侵袭迁移[24]。例如,lncRNA SNHG22下调通过miR-128-3p/PCDH1抑制子痫前期滋养细胞的增殖、迁移和侵袭[25]。本研究通过亚细胞定位实验发现,lncRNA SNHG8主要位于滋养细胞的胞浆中,故我们通过生物软件预测lncRNA SNHG8和miR-542-3p之间存在一个假定的结合位点。同时,在两组胎盘中验证miR-542-3p的表达,与对照组相比,miR-542-3p在PA中呈低表达且与lncRNA SNNG8呈负相关。通过双荧光素酶实验报告证实了miR-542-3p与SNHG8 3′-UTR结合。最后,我们通过恢复实验显示,miR-542-3p inhibitor与si-SNHG8共转染后,滋养细胞侵袭迁移增加,提示抑制miR-542-3p可逆转干扰lncRNA SNHG8对滋养细胞侵袭迁移的影响。上述结果表明lncRNA SNHG8可以通过负向调控miR-542-3p增强滋养细胞侵袭迁移能力。
综上所述,本研究发现lncRNA SNHG8在PA胎盘组织中上调,而miR-542-3p下调,lncRNA SNHG8通过靶向海绵吸附miR-542-3p增强滋养层细胞的侵袭和迁移能力,其可能是PA诊断和治疗的有效靶点。然而,本研究局限性在于miR-542-3p是如何调控下游靶基因尚不清楚;其次,临床样本较少。因此,本课题组后期将进一步扩大临床样本量,探究miR-542-3p的调控机制,更进一步明确lncRNA SNHG8在PA进展中的分子机制,将为进一步完善lncRNA在PA中的研究奠定基础。
