垂体肿瘤转化基因1通过调控肠上皮细胞焦亡在结肠炎症中的作用
2024-03-26易玉君翟晓明刘慧玲陶金
易玉君 翟晓明 刘慧玲 陶金
中山大学附属第三医院消化内科 (广州 510630)
溃疡性结肠炎(UC)是一种累及结直肠的慢性炎症性疾病。患者通常表现为腹痛、腹泻和黏液血便[1]。肠上皮细胞(IECs)的异常死亡会导致肠屏障的破坏,肠道内的微生物入侵肠道,机体释放大量促炎因子进一步促进肠道内的免疫反应,导致更多的IECs死亡。这可能是UC难以治愈和复发的原因之一[2]。焦亡是炎症细胞死亡的过程,主要功能是诱导强烈的炎症反应,以保护宿主免受微生物感染。在病理条件下,NLRP3炎症小体被激活。然后,激活的NLRP3炎症小体通过其连接环将蛋白GasderminD全长段(GSDMD-F)切割成GSDMD-N,GSDMD-N结合在细胞膜上形成孔,释放大量的IL-1β和IL-18[3],最终导致严重的炎症和细胞死亡。过度激活的炎症反应有助于宿主抵御致病性感染,但也可能导致各种炎症性疾病,如脓毒症和寻常痤疮等[4-5]。焦亡在IBD的作用也越来越受到关注。有研究[6]表明,在DSS诱导的实验性结肠炎小鼠模型中,小鼠的肠道黏膜组织中NLRP3炎症小体的激活增加。然而,关于焦亡在UC中的详细作用机制尚缺乏报道。垂体肿瘤转化基因1(PTTG1)是一种垂体衍生的转化基因[7],在正常成人睾丸、胸腺、结肠中表达,具有促细胞存活及抗细胞死亡的特性,参与调节细胞周期、细胞存活和增殖[8]。一项研究[9]发现在急性酒精性肝损伤中,PTTG1可以通过抑制肝细胞焦亡来减轻损伤。目前尚未有关于PTTG1在结肠炎症中的作用的研究报道。本研究通过建立PTTG1 WT和PTTG1 KO小鼠急性结肠炎模型以及在HCoEpiC细胞中沉默PTTG1的表达,探讨PTTG1是否通过调控IECs焦亡水平在结肠炎症中发挥作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物SPF级别的C57BL/6J小鼠10只,雄性,6 ~ 8周龄,体质量20 ~ 25 g,购自广东药康生物科技有限公司。PTTG1 KO小鼠10只,雄性,6 ~ 8周龄,体质量20 ~ 25 g,来自南京赛业生物技术有限公司。本动物实验伦理经华南农业大学实验动物伦理委员会审批通过(编号:2022d060)。
1.1.2 实验细胞系HCoEpiC细胞系由中山大学附属第三医院消化内科实验室冻存保种。
1.1.3 主要试剂与抗体DSS(MP Biomedicals,美国)、HE染液(北京雷根生物技术有限公司)、β-actin抗体(Santa Cruz,美国)、PTTG1抗体(abcam,美国)、NLRP3抗体(proteintech,中国)、ASC抗体(proteintech,中国)、TNF-α(proteintech,中国)、PTTG1 shRNA(吉凯基因,中国)。
1.1.4 主要仪器显微镜(Leica,德国)、SDS-PAGE电泳槽(BIO-RAD,美国)、半干转膜仪(BIO-RAD,美国)、PCR仪(BIO-RAD,美国)。
1.2 方法
1.2.1 小鼠急性结肠炎模型构建小鼠随机分为PTTG1 WT对照组、PTTG1 WT实验组、PTTG1 KO对照组和PTTG1 KO实验组,每组5只。WT对照组和KO对照组小鼠给予无菌双蒸水自由饮用,WT实验组和KO实验组小鼠自由饮用含3%DSS的无菌双蒸水6 d。
1.2.2 疾病活动指数评分从造模第1天起,每天观察小鼠的体质量、粪便性状和粪便隐血情况,计算小鼠DAI。具体评分标准如下:体质量正常为0分,体质量下降1% ~ 5%为1分,下降5% ~ 10%为2分,下降10% ~ 20%为3分,下降> 20%为4分;大便成形为0分,呈糊状或半成形为1分,稀便为4分;粪便潜血阴性为0分,大便潜血阳性为2分,肉眼血便为4分。
1.2.3 小鼠结肠标本收集使用3%DSS造模6 d后,对小鼠深度麻醉后行颈椎脱臼处死。剖开腹部暴露腹腔,游离小鼠全结肠,沿肠系膜对面纵行剖开结肠,用预冷的生理盐水冲洗结肠。部分结肠组织置于组织固定液中后续制成石蜡标本,部分结肠组织用玻片刮取肠黏膜用于蛋白质提取。
1.2.4 HE染色及组织病理学评分将制备好的蜡块切片,进行脱蜡和梯度水化处理后,HE染色,封片,拍照。组织病理学评分标准:炎症细胞浸润:黏膜层轻度浸润为1分,黏膜层及黏膜下层中度浸润为2分,透壁中度浸润为3分;肠上皮结构:上皮局部糜烂为1分,< 50%的局部溃疡形成为2分,广泛溃疡形成和(或)肉芽组织形成和(或)假息肉形成为3分。总分为0 ~ 6分。
1.2.5 免疫组织化学(IHC)染色石蜡切片经过处理,与相应的一抗、二抗孵育好后,用PBST冲洗,显微镜下用DAB显色,苏木素染核后,封片,拍照。
1.2.6 结肠黏膜组织和细胞总蛋白提取及蛋白免疫印迹(WB)根据总蛋白提取裂解液说明书对结肠黏膜和细胞总蛋白进行提取和定量。取蛋白样品进行电泳,转膜结束后,封闭2 h。用TBST洗涤后,一抗4 ℃孵育过夜。TBST洗涤后,用对应的二抗室温孵育2 h,用化学发光法显像,采用Image J图像分析软件进行灰度分析。
1.2.7 结肠组织和细胞RNA提取按照RNA快速提取试剂盒的操作说明对结肠黏膜和细胞进行总RNA提取后,根据TOYOBO逆转录试剂盒的说明将总RNA逆转录合成cDNA,将所得的cDNA用无酶水稀释10倍。应用SYBR Green法对目的基因及内参基因进行特异性扩增。引物序列见表1。
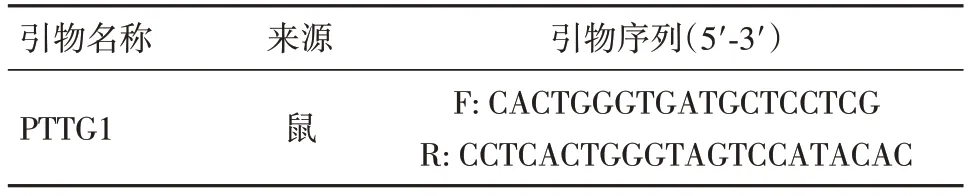
表1 引物序列Tab.1 Primer sequences
1.2.8 shRNA沉默PTTG1基因的表达取对数生长期的细胞接种于6孔板中,根据吉凯公司慢病毒转染说明书,慢病毒转染公式,确定每孔慢病毒用量。转染12 h后更换完全培养基继续培养。转染3 d后加入嘌呤霉素进行细胞抗性筛选。待筛选稳定后,继续培养细胞,扩增,并提取细胞蛋白及RNA,根据qPCR明确转染效率。
1.2.9 流式液相多重蛋白定量技术(CBA)检测炎症因子分泌水平收集细胞培养上清,根据试剂盒说明书进行操作,当天用流式细胞仪上机进行检测,流式数据用Biolegend LEGENDplex™数据分析软件进行分析。
1.3 统计学方法实验数据应用GraphPad Prism9.0软件进行统计学分析和作图。正态分布计量资料以均数±标准误表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,同一对象不同时间点的测量指标比较采用重复测量的方差分析,后行Bonferroni校正。以P< 0.05为差异有统计学意义。
2 结果
2.1 小鼠急性结肠炎模型构建与评估使用3%DSS造模6 d后,小鼠出现急性结肠炎症状,具体表现为体质量下降(P< 0.05)、结肠长度缩短(P<0.000 1)、DAI升高(P< 0.01)、结肠组织病理学评分增加(P< 0.001),与对照组比较,差异均有统计学意义。小鼠结肠组织切片HE染色显示,对照组小鼠结肠黏膜上皮完整,腺体排列规则,未见中性粒细胞浸润;实验组小鼠结肠黏膜上皮糜烂,腺体缺失,溃疡形成,黏膜层及黏膜下层大量炎症细胞浸润。以上结果均表明,3%DSS诱导小鼠急性结肠炎造模成功。见图1。

图1 小鼠急性结肠炎模型构建与评估Fig.1 Model construction and evaluation of acute colitis in mice
2.2 PTTG1在急性结肠炎小鼠结肠黏膜组织中表达减少IHC结果显示,与对照组相比,实验组小鼠结肠黏膜PTTG1蛋白表达水平明显下降。WB结果显示,实验组小鼠结肠黏膜PTTG1表达水平低于对照组(P< 0.01)。实验组小鼠结肠黏膜PTTG1mRNA水平也低于对照组,差异有统计学意义(P< 0.05)。以上结果说明PTTG1在急性结肠炎小鼠结肠黏膜组织中表达减少。见图2。
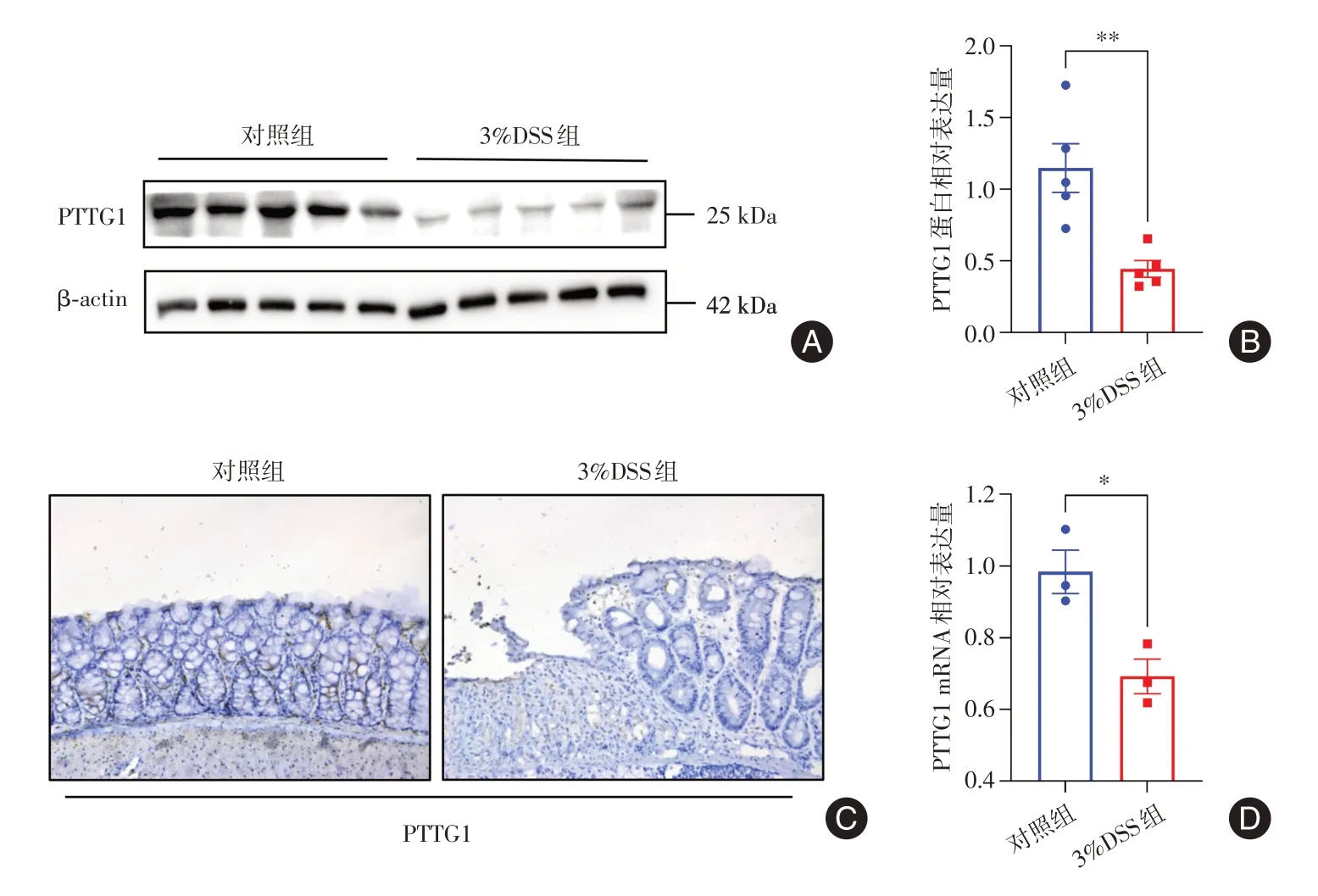
图2 PTTG1在急性结肠炎小鼠结肠黏膜组织中表达减少Fig.2 The expression of PTTG1 was decreased in colonic mucosal tissue in mice with acute colitis
2.3 PTTG1缺失加重小鼠急性结肠炎为进一步研究PTTG1在结肠炎中的作用,我们构建了PTTG1全敲除的小鼠模型。HE染色结果显示,与PTTG1 WT实验组比较,PTTG1 KO实验组结肠炎症严重程度明显加重,腺体结构破坏更为明显,炎症细胞的浸润增加,组织病理学评分明显升高(P< 0.01)。从造模第4天起,PTTG1 KO实验组的体质量低于PTTG1 WT实验组小鼠(P< 0.05)。且从造模第3天起,PTTG1 KO实验组DAI高于PTTG1 WT实验组(P< 0.001)。与PTTG1 WT实验组比较,PTTG1 KO实验组造模后结肠长度缩短更为明显,差异有统计学意义(P< 0.05)。以上结果说明PTTG1缺失会加重小鼠急性结肠炎。见图3。
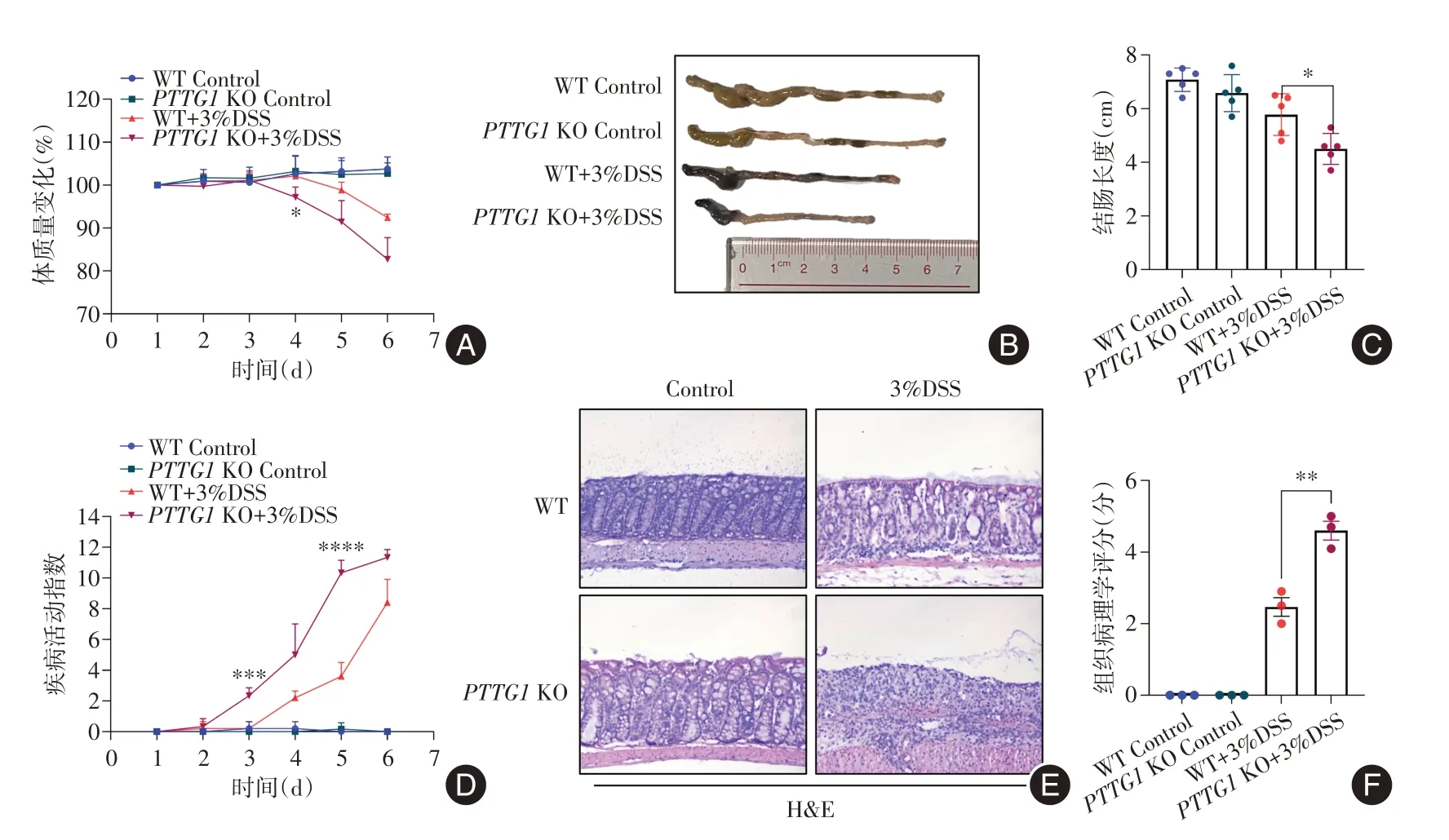
图3 PTTG1缺失加重小鼠急性结肠炎Fig.3 PTTG1 deletion aggravates acute colitis in mice
2.4 TNF-α诱导结肠上皮细胞炎症发生和PTTG1表达的下调在动物实验中证实急性结肠炎小鼠结肠黏膜PTTG1表达下降的研究基础上,我们利用HcoEpic进一步探究急性结肠炎与PTTG1表达的关系。结果显示,随着TNF-α刺激浓度的增加,细胞的PTTG1蛋白表达水平逐渐下降。CBA检测细胞培养上清,结果显示TNF-α刺激后,细胞分泌的促炎因子IL-6、IL-1β增加。以上结果证实TNF-α诱导HcoEpic炎症发生的同时,下调其PTTG1的表达。见图4。
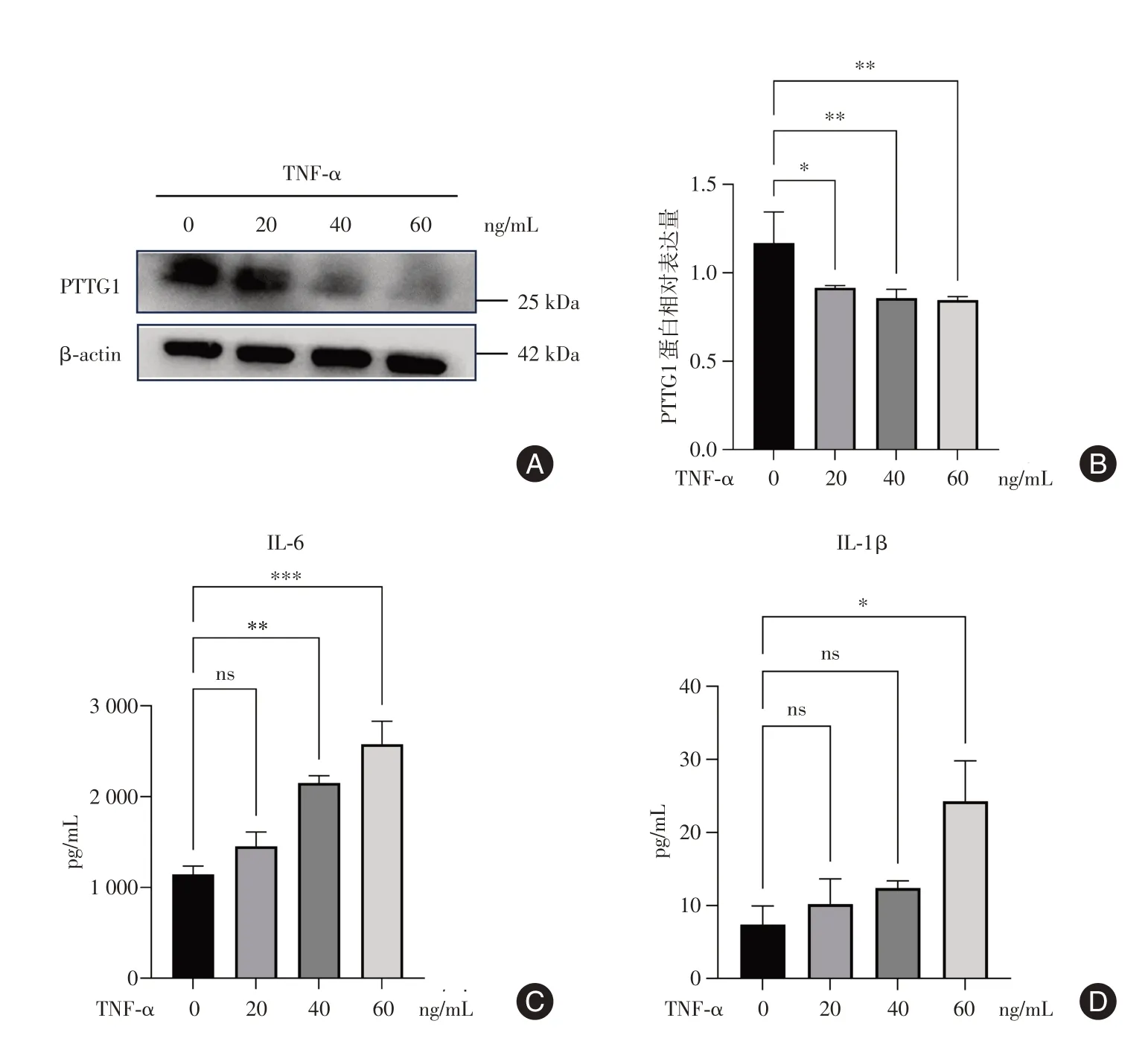
图4 TNF-α诱导结肠上皮细胞炎症发生和PTTG1表达的下调Fig.4 TNF-α induces inflammation and downregulation of PTTG1 expression in HCoEpiC
2.5 PTTG1缺失加重了结肠炎肠上皮细胞的焦亡IHC结果显示,PTTG1缺失上调了结肠炎小鼠结肠黏膜中NLRP3、ASC的表达水平。WB结果显示,PTTG1缺失增加了结肠炎小鼠结肠黏膜中GSDMD-N的表达(P< 0.05)。同样地,在细胞实验中也得到一致的结论,沉默PTTG1增加了TNF-α刺激的HcoEpic中GSDMD-N的表达(P< 0.05)。此外,沉默PTTG1的HcoEpic在TNF-α刺激后分泌的IL-1β和IL-18水平更高。以上结果表明PTTG1缺失加重了结肠炎肠上皮细胞的焦亡。见图5。
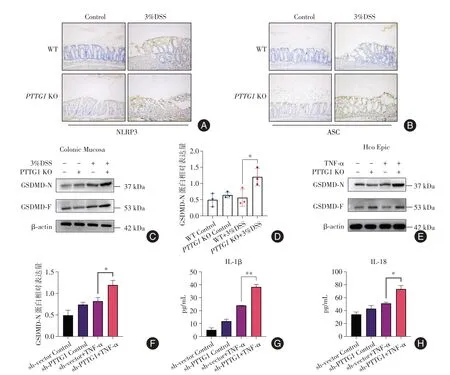
图5 PTTG1缺失加重了结肠炎肠上皮细胞的焦亡Fig.5 PTTG1 deletion aggravates IECs pyroptosis in colitis
3 讨论
UC是一种病因不明的慢性炎症性肠病[10]。目前认为一些因素可能参与UC的发生发展,包括免疫反应失调、肠道微生物群改变、遗传易感性和环境因素[1]。对UC潜在机制的进一步研究对于寻找新的治疗技术和药物具有重要意义。本研究利用3%DSS建立小鼠急性结肠炎模型和HcoEpic探索UC的发生机制。
IECs的异常死亡在UC的发病机制中起着重要作用[2]。既往研究[11-13]发现,与UC有关的细胞异常死亡形式主要有自噬、凋亡、铁死亡等。最近,文献报道了一种程序性炎症性细胞死亡的新形式-焦亡。典型的焦亡途径依赖于caspase-1来裂解GSDMD。裂解后,GSDMD-N形成跨膜孔,引起细胞裂解死亡,同时也作为炎症因子分泌的通道,释放促炎因子IL-1β和IL-18[14-15],参与多种炎症疾病。文献报道,发育期大鼠海马组织中微小RNA-223[16]及糖尿病肾病中肾小球足细胞长链非编码RNA H19[17]过表达均可能通过抑制NLRP3/Caspase-1通路来减轻相应细胞的焦亡,从而减轻细胞炎症损伤。既往有研究显示,上皮源性的GSDMD在IBD患者和实验性结肠炎小鼠结肠组织中均表达增加[18-19]。尽管传统观点认为全长段的GSDMs不发挥生物效应,但是一些研究发现全长段的GSDMs(如IECs中的GSDMB-FL和GSDMDFL)可能具备生物活性[19]。与上述研究相一致,在DSS诱导的急性结肠炎小鼠结肠黏膜组织和TNF-α刺激的HCoEpiC细胞中,我们也发现了GSDMD-F和GSDMD-N表达的增加。
PTTG1在各种生物过程中发挥着重要作用,如细胞复制、DNA损伤修复和代谢调控[7]。此外,PTTG1已被证明参与了基因毒性应激后的DNA损伤修复、对抗细胞凋亡和促进细胞存活[20]。一项研究[9]发现了PTTG1在焦亡中的作用,PTTG1可抑制酒精诱导的肝细胞焦亡,从而缓解酒精性肝损伤。目前尚未有关于PTTG1在结肠炎中的作用的研究。在本研究中,我们在急性结肠炎模型的小鼠结肠黏膜组织中发现PTTG1表达水平下调。我们建立了PTTG1 WT和PTTG1 KO小鼠急性结肠炎模型以及沉默PTTG1在HCoEpiC细胞中的表达来观察PTTG1的作用,结果显示,PTTG1 KO实验组小鼠的结肠炎症程度明显加重,PTTG1的缺失可以促进肠上皮细胞焦亡的发生。
综上所述,PTTG1的缺失上调结肠炎肠上皮细胞焦亡的水平,加重肠道的炎症反应,可能为UC的发病机制提供新的理论依据,为UC的治疗提供新的靶点。
