RNF99通过TAK1/NF-κB信号通路参与泛素化与脓毒症性休克的潜在联系
2024-03-26张弛胡赛王静夏凤强程晓英甘泽英
张弛 胡赛 王静 夏凤强 程晓英 甘泽英
长沙市第四医院(湖南师范大学附属长沙医院)重症医学科(长沙 410006)
脓毒症是一种全球性的致命疾病,并导致住院患者死亡,主要是由于感染引起的过度炎症[1]。由于宿主对感染的防御失调,脓毒症会导致器官功能障碍[2]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是导致脓毒症发病和死亡的重要因素[3]。研究[4]表明,大约10%的脓毒症患者死亡;但脓毒症休克患者病死率一般超过40%。虽然已经提出了几种机制来促进ARDS的改善,包括炎症、活性氧累积以及转录和代谢失调,但是没有成功应用于对抗这些机制的具体措施[5]。考虑到呼吸功能的核心作用以及脓毒症患者缺乏特异性和因果性治疗方法,了解潜在机制并确定预防ARDS和治疗该患者群体的适当治疗策略至关重要。通常,先天免疫和获得性免疫都参与介导对组织损伤的反应,这是由于病原体相关的分子模式通过核因子-κB(nuclear factor-κB,NF-κB)活化和随后肺中促炎细胞因子的产生,表明免疫细胞中的NF-κB活化是ARDS发展的关键[6]。此外,越来越多的证据[7]表明肺泡上皮细胞中的NF-κB信号也与ARDS有关。因此,免疫细胞和肺泡上皮细胞中的NF-κB信号传导是ARDS的潜在治疗靶点。尽管NF-κB信号受泛素化调节,泛素化在脓毒症ARDS中的作用尚未被研究[8]。环指蛋白99(Ring finger protein 99,RNF99)是E3连接酶三聚体家族的新成员。有研究[9]发现,巨噬细胞中RNF99参与调节NF-κB介导的炎症反应。重要的是,据报道[10],RNF99可以负调节NFκB介导的神经炎症,减轻神经元损伤。然而,肺泡上皮细胞中RNF99在脓毒性ARDS发展中的作用尚未得到全面的研究。为了阐明RNF99在脓毒性ARDS发展中的潜在作用,我们在肺泡上皮细胞中进行了RNF99过度表达和敲除研究,并使用LPS在小鼠中诱导脓毒性ARDS。本研究的目的是检测:(1)RNF99是否抑制肺泡上皮细胞中的NF-κB信号;(2)RNF99特异性表达是否改善LPS诱导的小鼠肺部炎症损伤。
1 材料与方法
1.1 细胞培养和处理小鼠肺泡上皮细胞系MLE12购自美国ATCC,并在37 ℃下在含有2%新生小牛血清的DMEM/F12培养基(美国Gibco公司)中培养。用LPS处理(5 μg/mL,美国Sigma公司)刺激不同时间(0、2、6、12、24 h)诱导MLE12损伤。使用Lipofectamine 3000(美国Invitrogen公司)进行质粒和siRNA转染以过表达或敲低RNF99。在转染前,MLE12在Opti-MEM(美国Invitrogen公司)中孵育2 h。孵育后,用质粒或siRNA转染MLE12,并孵育4 ~ 6 h。更换培养基后,将MLE12保存在含有2%新生小牛血清的DMEM/F12中孵育24 h,用于后续实验。
为了考察RNF99转染对MLE12细胞中磷酸p65和p65蛋白表达的影响,将MLE12细胞分为:载体组(Vector)、RNF99组、LPS+Vector组、LPS+RNF99组。各组MLE12细胞分别转染Vector或RNF99质粒,LPS+Vector组、LPS+RNF99组细胞在转染后用LPS(5 μg/mL)刺激24 h。为了考察si-RNF99转染对MLE12细胞中磷酸p65和p65蛋白表达的影响,将MLE12细胞分为:阴性组(si-NC)、si-RNF99组、LPS+si-NC组、LPS+si-RNF99组。各组MLE12细胞分别转染si-NC或si-RNF99,LPS+si-NC组、LPS+si-RNF99组细胞在转染后用LPS(5 μg/mL)刺激24 h。
1.2 蛋白质印迹分析通过蛋白质印迹分析从肺组织或MLE12细胞提取的蛋白质表达。将左上肺匀浆并在RIPA缓冲液(北京Solarbio公司)中溶解。用BCA蛋白检测试剂盒(美国Thermo Fisher Scientific公司)测量蛋白浓度。等量的蛋白质通过10% SDS-PAGE凝胶分离,转移到聚偏二氟乙烯膜(美国Millipore公司)后,室温下用5%脱脂牛奶封闭膜1 h,然后与第一抗体在4 ℃孵育过夜。在室温下与过氧化物酶偶联的第二抗体(1∶5 000,英国Abcam公司)孵育1 h后,通过ECL化学发光系统(美国Thermo Fisher公司)观察条带。实验使用的第一抗体如下:小鼠单克隆抗-TAK1、兔多克隆抗IκBα和小鼠单克隆抗-TRAF6购自美国Santa Cruz Biotechnology公司;小鼠单克隆RNF99购自美国BD Biosciences公司;兔单克隆抗p65、兔单克隆抗磷酸p65(Ser536)和兔多克隆抗β-微管蛋白购自美国Cell Signaling Technology公司。
1.3 免疫沉淀将来自MLE12细胞的300 μg全细胞裂解物用蛋白A/G珠预澄清30 min。预清除的细胞提取物以4 500g离心2 min,上清液与2 μg抗体在4 ℃孵育过夜。小鼠单克隆抗TAK1、小鼠单克隆抗TRAF6用于免疫沉淀。正常兔或小鼠IgG用作阴性对照。孵育后,将上清液与蛋白A/G珠混合,并在4 ℃孵育2 h。对样品进行8% SDSPAGE分离,并用小鼠抗RNF99抗体进行免疫印迹。采用Signal-SeekerTM泛素化检测试剂盒(美国Cytoskeleton公司)进行泛素化蛋白的选择性分离。使用抗TRAF6抗体进行蛋白质印迹分析来评估泛素化蛋白。
1.4 实验动物治疗本研究中使用的成年雄性C57BL/6J小鼠(6周龄,体质量22 ~ 24 g)购自湖南斯莱克景达实验动物有限公司。所有小鼠饲养在湿度为50% ~ 60%、温度为24 ~ 26 ℃且光照/黑暗周期为12 h的受控环境中。
将40只小鼠随机分成WT+PBS、WT+LPS、RNF99特异性表达(TG)+PBS和TG+LPS组,每组10只。WT+LPS组和TG+LPS组小鼠用1%戊巴比妥钠(40 mg/kg,美国Sigma公司)进行麻醉,通过腹膜内注射30 mg/kg LPS诱导脓毒症[11]。WT+PBS组、TG+PBS组小鼠腹膜内注射相同剂量的PBS。TG+LPS组小鼠和TG+PBS组小鼠在腹膜内注射LPS前3 d,将基于AAV的RNF99过表达质粒(1 × 1012μg/mL,60 μL)滴注到小鼠的肺中,用于特异性表达RNF99。在施用LPS后12 h处死小鼠,并通过蛋白质印迹分析和组织学分析进行评估。
1.5 组织学分析将小鼠的整个左肺固定在4%多聚甲醛中,包埋在石蜡中,并切成4 μm的切片。然后将切片进行H&E染色和CD68(武汉Servicebio公司)IHC染色。对于IHC染色,组织切片首先在60 ℃烘烤2 h,然后用二甲苯脱蜡,并通过乙醇梯度再水合。然后通过在柠檬酸盐缓冲液中于95 ℃加热30 min并冷却至室温,对载玻片进行抗原修复。阻断内源性过氧化物酶活性和血清封闭后,将切片与适当的一抗和二抗一起孵育,然后用DAB显色溶液进行DAB显色反应。细胞核复染和脱水后,用倒置显微镜拍摄组织切片图像。
1.6 统计学方法采用SPSS 22.0进行统计分析。所有数据均表示为均数±标准差。两组之间的统计比较采用t检验。多组间比较采用重复测量方差分析或单因素方差分析,随后通过Bonferroni校正进行两两比较测试。以P< 0.05为差异有统计学意义。
2 结果
2.1 LPS刺激MLE12细胞后RNF99的表达图1A所示,在LPS刺激后,MLE12细胞中RNF99的蛋白表达水平连续下降(F= 12.75,P< 0.001)。为了检测RNF99和NF-κB通路关键调节因子之间的相互作用,在MLE12细胞中进行了内源性免疫沉淀。见图1B,RNF99与TRAF6和TAK1相互作用。
2.2 RNF99过表达抑制MLE12细胞NF-κB信号通路与Vector组相比,RNF99组MLE12细胞中TRAF6和TAK1的蛋白表达水平显著降低(P< 0.05)(图2A)。泛素化TRAF6蛋白在RNF99敲低的MLE12细胞中增加(图2B)。与LPS+Vector组相比,在LPS+RNF99组MLE12细胞中p65的磷酸化水平明显降低(P< 0.05,图2C)。

图2 RNF99过表达抑制MLE12细胞NF-κB信号通路Fig.2 RNF99 overexpression inhibits NF-κB signaling pathway in MLE12 cells
2.3 RNF99基因敲除加剧MLE12细胞NF-κB信号的激活与si-NC组相比,si-RNF99组MLE12细胞中RNF99、IκBα的蛋白表达水平显著降低(P<0.05)(图3A)。与LPS+si-NC组相比,在LPS+si-RNF99组MLE12细胞中p65的磷酸化水平明显增加(P< 0.05,图3B)。
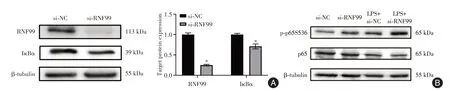
图3 RNF99敲低增强LPS刺激后MLE12细胞的NF-κB信号通路Fig.3 RNF99 knockdown enhances NF-κB signaling pathway in MLE12 cells stimulated by LPS
2.4 小鼠肺组织中RNF99与NF-κB信号调节因子的相互作用与WT组小鼠相比,TG组小鼠肺组织中RNF99的蛋白水平显著增加(P< 0.05),TRAF6和TAK1的蛋白表达水平显著降低(P< 0.05,图4A)。进行免疫沉淀以阐明肺组织中RNF99和TAK1/TRAF6之间的相互作用。如图4B所示,RNF99与肺组织中的TRAF6和TAK1相互作用。接下来,我们检查了LPS注射(50 mg/kg)后RNF99的内源性表达水平的变化,并发现RNF99的蛋白表达水平降低(图4C)。
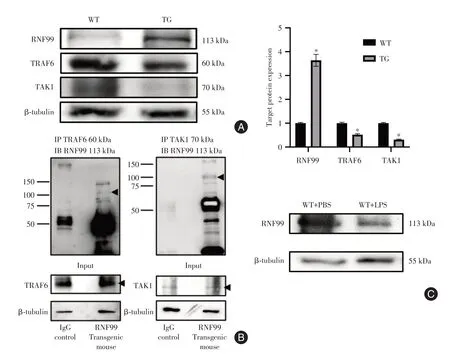
图4 RNF99与体内NF-κB信号传导的关键调节因子相互作用Fig.4 Interaction between RNF99 and key regulatory factors of NF-κB signal transduction in vivo
2.5 RNF99过度表达减轻腹腔注射LPS诱导的小鼠肺部炎症损伤与WT+PBS组小鼠相比,WT+LPS组小鼠肺组织中出现中性粒细胞浸润、隔膜增厚、肺泡水肿,CD68巨噬细胞染色百分比显著增加(P< 0.05)。TG+LPS组小鼠肺组织中中性粒细胞浸润、隔膜增厚、肺泡水肿较WT+LPS组减轻,并且CD68巨噬细胞染色百分比显著降低(P< 0.05)。此外,TG+LPS组小鼠肺组织中p65的磷酸化水平显著低于WT+LPS组小鼠(P< 0.05,图5)。
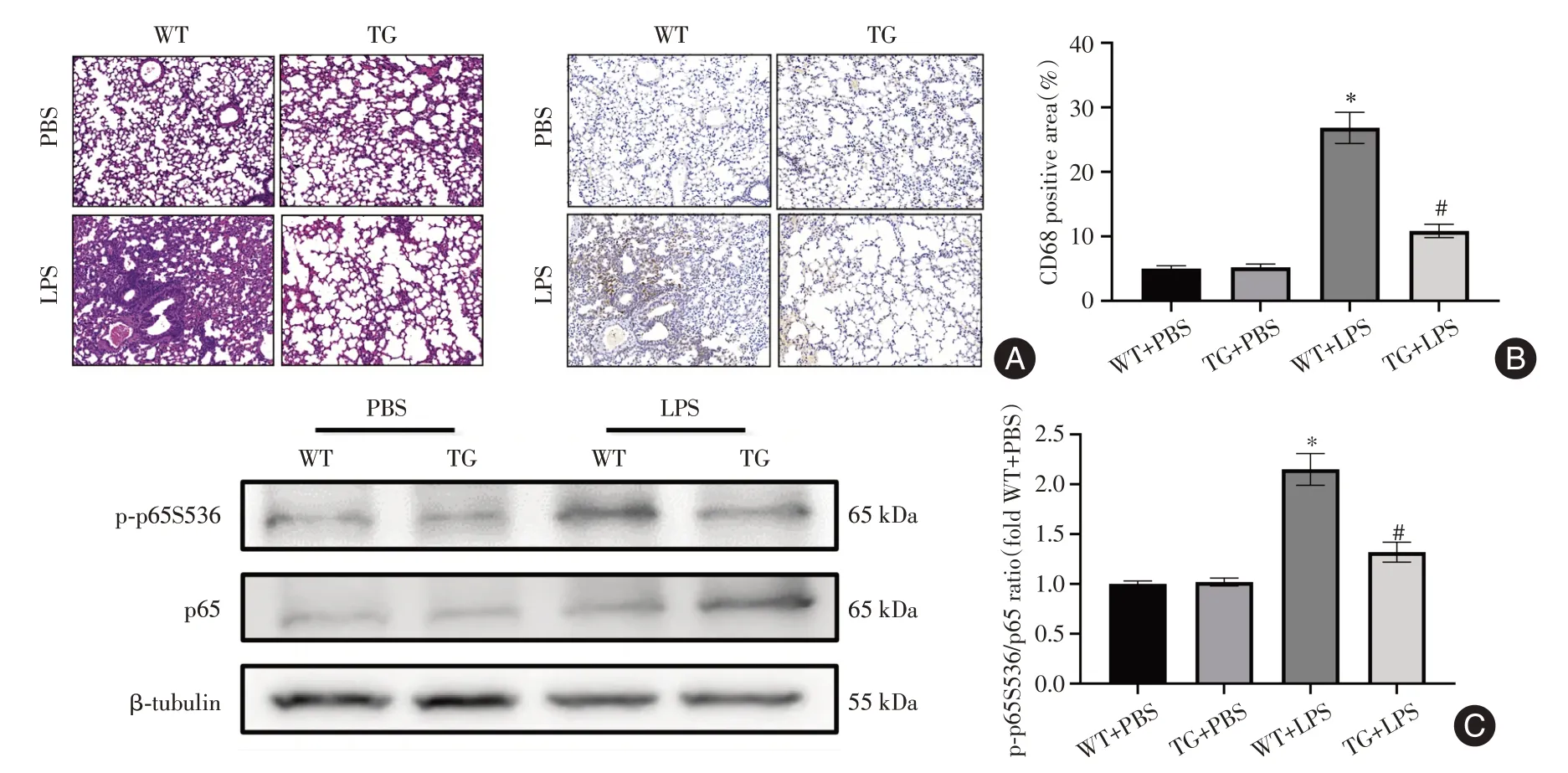
图5 RNF99过度表达减轻腹腔注射LPS诱导的小鼠肺部炎症和损伤(n = 6)Fig.5 Overexpression of RNF99 reduces lung inflammation and injury induced by intraperitoneal injection of LPS in mice(n = 6)
3 讨论
泛素化在NF-κB介导的炎症性疾病中起着关键作用,许多E3泛素连接酶都参与其中,如RNF99[8,12-13]。以前对RNF99的研究主要集中在肿瘤进展中涉及的生物学过程[14]。然而,对RNF99在脓毒性ARDS炎症免疫反应中的作用的认识仍然有限。本研究的主要发现如下:(1)MLE12细胞对LPS的反应性降低了RNF99蛋白的表达;(2)RNF99与TRAF6和TAK1相互作用,并在体内外调节它们的蛋白表达;(3)TG小鼠表现出比WT小鼠更低的TRAF6和TAK1蛋白表达水平,并减轻腹腔注射LPS诱导的小鼠肺部炎症损伤。我们的结果表明,RNF99在脓毒性ARDS的发展中起着保护作用。
RNF99首先在具有异常免疫表型的突变小鼠中被鉴定,并被报道通过抑制免疫细胞中的NF-κB途径在炎症停止中发挥关键作用[9]。因此,RNF99蛋白的表达可能在炎症中起重要作用。据报道[15],RNF99的E3连接酶活性受其表达水平和磷酸化的调节,通过与衔接蛋白如c-Jun N-末端激酶相互作用,缓解了WW-接头对RNF99 HECT结构域的自身抑制性构象。研究[16]发现,在巨噬细胞细胞中,通过自身泛素化,RNF99在氧化应激(如阿霉素和过氧化氢刺激)的反应中下调。在本研究中,我们发现在LPS刺激后,MLE12细胞中RNF99蛋白的表达水平连续下降。此外,体内腹腔注射LPS后,RNF99蛋白表达水平降低。这些结果表明RNF99在脓毒性ARDS中下调。
已证实许多机制可以激活NF-κB途径。其中,LPS与Toll样受体4结合后可通过TRAF6传导信号激活NF-κB途径[17]。TRAF6是一种环型E3连接酶,与TAK1复合并催化K-63多泛素链,后者可以作为连接信号蛋白复合物的支架[17]。活化的TAK1通过磷酸化IκB激酶(IKK)β导致NF-κB活化[18]。因此,TRAF6和TAK1是LPS诱导的NF-κB信号通路的关键成分[19]。在目前的研究中,我们发现RNF99抑制了MLE12细胞中TRAF6的蛋白表达水平。有研究[20]表明,通过抑制TRAF6蛋白表达和随后的NF-κB活化,脓毒性ARDS得到改善,表明TRAF6蛋白表达的重要性。因此,TRAF6表达减少可能有助于抑制LPS诱导的RNF99过表达小鼠的NF-κB活化。
TAK1是丝裂原活化蛋白激酶家族的成员,能够磷酸化NF-κB信号通路的下游靶标,包括IKKβ[21]。包含TAK1结合蛋白1、2和3的TAK1复合物通过E3连接酶与K-63连接的泛素链连接,并在细胞刺激后被激活,表明泛素化在调节TAK1激活中的重要性[22]。研究[9]已经证明,RNF99顺序催化TAK1上K48连接的泛素链,并在CYLD去除K63连接的泛素化后通过蛋白酶体途径将其降解。在目前的研究中,我们证明了RNF99过度表达可以抑制肺部中TAK1的表达。据报道,NF-κB激活会引发炎症风暴,并通过增加细胞因子分泌来促进肺部炎症损伤[6]。LPS刺激后,WT和TG小鼠之间的肺组织中中性粒细胞浸润、隔膜增厚、肺泡水肿和巨噬细胞浸润存在显著差异。因此,RNF99可能通过降低TAK1的蛋白表达水平来抑制NF-κB信号的激活,进而减轻肺损伤。
综上所述,RNF99通过与NF-κB信号通路的关键调节因子(TRAF6/TAK1)相互作用来调节NF-κB信号通路,并改善小鼠腹腔注射LPS后肺损伤。因此,RNF99可能成为脓毒症患者预防脓毒性ARDS的一个新的治疗靶点。然而,本研究没有对TRAF6和TAK1的泛素化进行完全评估,因为其涉及K63-连接和K48-连接的泛素化和去泛素化的复杂过程。需要进一步的研究来揭示RNF99抑制脓毒性ARDS的确切机制。
