Eupatilin通过Sesn2-Nrf2保护线粒体功能在脓毒症脑损伤中的作用
2024-03-26王加栋黄方舟黄艳陈管雄刘军黄佩琦
王加栋 黄方舟 黄艳 陈管雄 刘军 黄佩琦
长沙市第四医院 (湖南师范大学附属长沙医院)急诊急救中心 (长沙 410006)
脓毒症相关脑病(sepsis-associated Encephalopathy ,SAE)作为ICU中最常见的一类脑病,定义为各种感染体因弥漫性脑功能障碍引起的炎症反应[1]。临床数据显示,SAE可影响15% ~ 70%的患者,导致严重的认知功能障碍[2-3]。在实验性SAE中,盲肠结扎和穿孔(cecal ligation and puncture ,CLP)手术诱导的活性氧和炎症介质的过量产生可通过血液传播并穿过血脑屏障,最终导致大脑皮层和海马损伤伤[4-5]。目前对SAE的潜在机制仍知之甚少,其在认知功能方面的影响仍是值得关注的临床问题。Sestrin2(Sesn2)是Sestrin家族的成员,是一种重要的应激诱导蛋白,在各种应激下被诱导,包括缺血、缺氧、高糖、DNA损伤、氧化应激和内质网应激[6]。据报道,Sesn2正调节核因子红系-2相关因子2(Nuclear factor erythroid-2-related factor 2,Nrf2)的激活[7]。Nrf2被认为是内源性抗氧化防御和线粒体生物发生的主要调节因子。研究表明,Nrf2激活剂减轻SAE大鼠模型的神经炎症和氧化应激并改善认知障碍[8]。此外,Sesn2的升高减少了活性氧的积累,而Sesn2的基因缺失则加剧了线粒体功能障碍[9]。Sesn2过度表达在缓解CLP诱导的SAE中的确切作用和机制仍然未知。本研究通过CLP诱 导的SAE小鼠模型确定Sesn2激动剂Eupatilin是否通过激活Sesn2-Nrf2通路改善线粒体损伤并保护SAE相关认知功能障碍,旨在加深我们对SAE中线粒体功能的认识,并为进一步 研究提供了有价值的候选靶标。
1 材料与方法
1.1 动物和分组处理120只6周大的雄性C57BL/6J小鼠购自重庆恩斯维尔生物科技有限公司(动物生产许可证:SCXK(渝)2019-0004S),并饲养在特定的无病原体环境中,光照/黑暗周期为12 h,光、温度和湿度可控,食物和水可随意获得。按照计算机随机分组方法将小鼠随机分为3组,每组40只:假手术(Sham)组、CLP组、CLP + Eupatilin组。参照文献方法,建立由CLP诱导脓毒症模型,该模型可导致急性多菌性腹膜炎[10]。用1%戊巴比妥钠(40 mg/kg,美国Sigma公司)麻醉小鼠,将腹腔切开1 cm。暴露盲肠并在回盲部下方结扎。用22号针头两次穿刺诱导轻度脓毒症。假手术动物进行相同的开放手术,但没有CLP。CLP + Eupatilin组小鼠经尾静脉注射10 mg/kg Eupatilin(德国Phoenix Pharmaceuticals公司),每天1次,连续3 d,给药剂量参照文献方法[11]。动物实验方案经本院伦理委员会审批同意(审批号:伦审2021-07)。
1.2 神经行为测试通过修改的神经病学严重程度评分(mNSS)来确定小鼠神经行为。mNSS是对运动、感觉、反射和平衡的综合测试。不能完成任务或反射能力不足的小鼠得1分。累积分数在13 ~ 18之间表示严重受伤;7 ~ 12表示中度伤害;1 ~ 6表示轻伤[12]。
1.3 莫里斯水迷宫试验Morris水迷宫(Morris Water Maze,MWM)用于评估空间学习和记忆功能[13]。具体操作为,训练小鼠在不透明的水中寻找一个隐藏的平台,为期5 d,每天从伪随机位置开始进行4次获取实验。逃避潜伏期,即找到隐藏平台的时间,是空间学习和记忆的指标。在训练试验的第6天,进行探寻试验(拆除水下平台),让小鼠在水池中搜索1 min。在目标区域的时间和探测轨道上平台之间的时间被用作参考记忆的指标。在训练过程中,使用MicroPublisher自动跟踪系统(西班牙Panab公司)获取并分析行为数据。
1.4 尼氏染色法MWM测试结束后,处死小鼠,将分离的脑切片用10%福尔马林固定24 h,用乙醇脱水,石蜡包埋,在载玻片上切成5 μm厚的切片。组织切片用0.5%乙酸甲酚紫染色,用DFC420光学显微镜(德国Leica公司)观察,以计数海马CA1区的神经元数目。
1.5 透射电子显微镜将1 mm3的海马切片在1%四氧化锇中固定1 h,然后在2%乙酸铀酰中染色,并在4 ℃下包埋在100%丙酮中过夜,切成100 nm的切片。由HT-7500透射电子显微镜(日本Hitachi公司)捕获图像。
1.6 蛋白质印迹分析使用RIPA裂解缓冲液(上海Beyotime公司)从海马、皮质组织或HT22细胞中提取粗蛋白质。采用双辛可宁酸试剂测定蛋白质浓度。取20 μg样品进行SDS-PAGE电泳,然后转移到PVDF膜(美国GE Healthcare公司)上。用5%脱脂奶粉封闭膜1 h,并与针对GPX4(1∶1 000,英国Abcam公司)、ACSL4(1∶500,美国abclonal公司)、Sestrin2(1∶500,英国Abcam公司)、Nrf2(1∶1 000,美国Protentech公司)、GAPDH(1∶1 000,美国Santa Cruz公司)一抗在4 ℃孵育过夜。然后将膜与HRP偶联的二抗(1∶5 000,英国Abcam公司)一起温育1 h,并在用PBS洗涤后用ECL化学发光系统(美国Thermo Fisher公司)观察条带。使用Image J软件来量化信号。
1.7 免疫荧光处死小鼠,将脑组织剥离进行蔗糖梯度脱水,最后用低温恒温器切成5 μm切片。将切片与Sestrin2(1∶200,英国Abcam公司)、Nrf2(1∶200,美国Protentech公司)、Iba1(1∶200,美国R&D公司)和CD68(1∶200,美国Santa Cruz公司)第一抗体稀释在封闭缓冲液中,然后在4 ℃下与适当的荧光缀合的第二抗体(1∶200,美国Jackson Immuno-Research公司)一起孵育2 h。最后,对切片进行DAPI染色(1∶5 000,北京Solarbio公司)以观察细胞核,并使用荧光显微镜(德国Zeiss公司)成像。
1.8 细胞培养小鼠海马神经元细胞系(HT22细胞)购自美国典型培养物保藏中心(ATCC),在补充100 U/mL青霉素/链霉素和10%胎牛血清(FBS)的DMEM培养基(美国Gibco公司)中培养。为了探讨Sesn2-Nrf2通路在抗线粒体损伤中的作用,将HT22细胞随机分为对照组(Con)、脂多糖组(LPS)、脂多糖+Eupatilin处理组(LPS+Eupatilin)、脂多糖+Eupatilin+Nrf2 siRNA处理组(LPS+Eupatilin+si-Nrf2)。对照siRNA(si-con)或NRF 2 siRNA(si-NRF 2;均购自上海GenePharma有限公司)在LPS刺激前用Lipofectamine 2000TM试剂(美国Invitrogen公司)转染HT-22细胞48 h。将LPS(1 μg/mL,美国sigma Aldrich公司)加入细胞培养基中24 h。在LPS+Eupatilin组和LPS+Eupatilin+ si-Nrf2组中,在LPS刺激前1 h,将细胞与Eupatilin(50 μmol/L)一起孵育[14]。
1.9 末端脱氧核苷酸转移酶介导的缺口末端标记(terminal-deoxynucleoitidyl transferase mediated nick end labeling,TUNEL)染色用PBS洗涤细胞3次,并用4%多聚甲醛固定细胞,和用0.5%Triton X-100处理。然后将细胞与50 μL TUNEL反应混合物(瑞士Roche公司)在37 ℃孵育1 h,用4′,6-二脒基-2-苯基吲哚(DAPI)进行核染色。在荧光显微镜下观察TUNEL阳性细胞。
1.10 线粒体膜电位(mitochondrial membrane potential,MMP)根据线粒体膜电位检测试剂盒(美国Sigma公司)的使用方法,使用JC-1作为荧光探针快速检测HT22细胞中的MMP。通过荧光显微镜捕获荧光,并使用Image-Pro Plus 6.0软件进行数字化。
1.11 统计学方法分别采用GraphPad Prism 8和SPSS 21.0软件作图和分析数据。所有定量数据均表示为平均值±标准差。通过单向方差分析评估差异(ANOVA三组或更多组)。当只比较两组时,使用不成对t检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 脓毒症降低大脑中 Sesn2 的激活在CLP手术后7 d,与Sham小鼠相比,CLP小鼠的海马[(1.00 ± 0.03) vs.(0.34 ± 0.04)]和皮质[(1.00 ±0.02) vs.(0.55 ± 0.05)]中Sesn2显著下调(P < 0.01)(图1)。

图1 各组中海马和皮质Sesn2的代表性蛋白质印迹和定量数据Fig.1 Representative protein imprinting and quantitative data of seahorse and cortex Sesn2 in each group
2.2 Sesn2激动剂减少CLP小鼠脓毒症诱导的认知功能障碍和神经功能缺损图2A显示CLP组的存活率约为40%。与CLP组相比,CLP+Eupatilin组的存活率显著增加(P < 0.05)。与Sham组相比,CLP组小鼠表现出相对较高的神经损伤评分(P < 0.05),而CLP+Eupatilin组小鼠的神经损伤评分较CLP组显著降低(P < 0.05)(图2B)。与Sham组相比,CLP组小鼠的空间学习能力显著受损(P < 0.05),而CLP+Eupatilin组缓解了SAE诱导的学习障碍(图2C、D)。训练后24 h进行探寻试验。与Sham组相比,CLP组中的小鼠具有更少的平台穿越次数(36 ± 3 vs.15 ± 1)和更短的目标停留时间(4.3 ± 0.5 vs.2.2 ± 0.3),而CLP + Eupatilin组中小鼠停留在目标区域时间(25 ± 2 vs.15 ± 1)和平台穿越次数(3.2 ± 0.3 vs.2.2 ± 0.3)显著高于CLP组(P < 0.05)(图2E、F)。

图2 Sesn2激动剂减少CLP小鼠脓毒症诱导的认知功能障碍和神经功能缺损(n=8)Fig.2 Sesn2 agonist reduces cognitive dysfunction and neurological deficit induced by sepsis in CLP mice( n=8)
2.3 Sesn2激动剂减轻脓毒症诱导的SAE小鼠海马神经炎症并激活Sesn2-Nrf2通路尼氏染色的结果显示,与Sham组相比,CLP组小鼠海马组织中神经元明显减少(17 ± 2 vs.9 ± 2,P < 0.05),而CLP + Eupatilin组小鼠海马组织中神经元较CLP组显著增加(14 ± 1 vs.9 ± 2,P < 0.05)(图3A)。透射电镜显示,CLP组切片中,线粒体皱缩,膜密度压缩,嵴减少,外膜破裂更明显。相反,CLP + Eupatilin组线粒体相对正常,嵴清晰(图3B)。结果表明,Eupatilin改善了CLP诱导的线粒体功能障碍。免疫荧光分析显示,与Sham组相比,CLP组小鼠海马组织中Sesn2和Nrf2的共定位率显著降低(16.5± 1.8 vs.8.8 ± 1.3,P < 0.05),而CLP+Eupatilin组小鼠海马组织中Sesn2和Nrf2的共定位率显著高于CLP组(13.2 ± 1.5 vs.8.8 ± 1.3,P < 0.05)(图3C)。CLP组CD68/Iba-1阳性小胶质细胞数量显著增加(1.0 ± 0.1 vs.10.2 ± 1.5,P < 0.05),大量小胶质细胞被激活,呈阿米巴样,胞体大,突起短,而CLP +Eupatilin组被激活的小胶质细胞数量显著减少(6.3 ± 0.8 vs.10.2 ± 1.5,P < 0.05)(图3D)。

图3 Sesn2激动剂减轻脓毒症诱导的SAE小鼠海马神经炎症并激活Sesn2-Nrf2通路(n = 4)Fig.3 Sesn2 agonist can reduce the inflammation of hippocampus induced by sepsis and activate Sesn2-Nrf2 pathway( n = 4)
2.4 Sesn2通过Nrf2通路抑制LPS诱导的神经元凋亡和线粒体损伤与Con组相比,LPS组细胞凋亡和MMP水平显著增加(P < 0.01),而LPS + Eupatilin组细胞凋亡和MMP水平显著低于LPS组(P < 0.05)。然而,Nrf2敲低(LPS + Eupatilin + si-Nrf2组)逆转了Eupatilin的抗细胞凋亡作用和线粒体保护作用(图4A、B)。此外,与LPS组相比,LPS + Eupatilin组细胞中GPX4的表达显著增加(P < 0.05),和ASCL4的表达显著降低(P < 0.05)。然而,Nrf2敲低(LPS+ Eupatilin + si-Nrf2组)逆转了Eupatilin对GPX4、ASCL4的表达影响(图4C)。
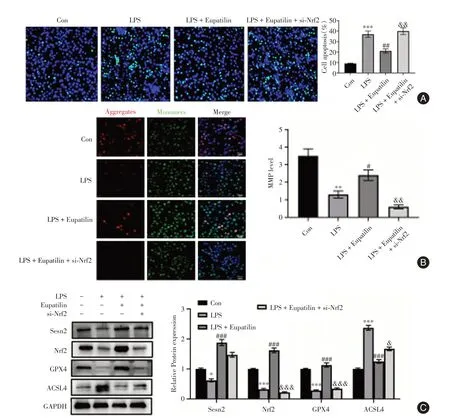
图4 激活Sesn2-Nrf2通路抑制LPS诱导的神经元凋亡和线粒体损伤(n = 3)Fig.4 Activation of Sesn2-Nrf2 pathway inhibits LPS-induced neuronal apoptosis and mitochondrial damage (n = 3)
3 讨论
海马体是与学习和记忆相关的关键区域,对缺血、缺氧和炎症非常敏感。SAE诱发的认知障碍与神经元功能障碍和海马突触可塑性有关[15]。本研究表明CLP导致SAE小鼠海马出现明显的病理改变、线粒体功能障碍和胶质细胞活化。此外,CLP小鼠的海马和皮质中Sesn2显著下调,而采用Sesn2激动剂Eupatilin治疗能显著减轻CLP诱导的海马病理损伤,减少小胶质细胞活化和神经炎症,从而改善SAE的神经功能缺损。这一结果与早期的研究一致,即Sestrin2激活可防止脑缺血再灌注损伤中的铁死亡,并改善神经功能缺损[16]。此外,Eupatilin治疗明显提高了CLP小鼠海马组织中Sesn2和Nrf2的共定位率,表明激活Sesn2-Nrf2通路可能涉及SAE的保护机制。
Sestrin2(Sesn2)是Sestrin家族的成员,在各种应激下被诱导,包括缺血、缺氧、高糖、DNA损伤、氧化应激和内质网应激[17]。据报道,Sesn2正调节核因子红系-2相关因子2(Nrf2)的激活[7,18]。Nrf2被认为是内源性抗氧化防御和线粒体生物发生的主要调节因子,在氧化应激下其通过转移到细胞核中,并调节细胞核中一系列抗氧化防御基因的表达[19]。研究表明,Nrf2激活剂可以改善脓毒症大鼠的记忆障碍[20-21]。在体内,我们观察到Sesn2-Nrf2通路可能在CLP诱导的线粒体功能障碍中起调节作用。线粒体是高度动态的细胞器,经历不断的分裂和融合,这些形态变化是有效的能量代谢、钙缓冲和细胞存活调节所必需的[13]。由于神经元在突触中的高能量需求,特别容易受到线粒体功能障碍的影响[4]。本研究证实了Nrf2敲低逆转了Sesn2激活的抗细胞凋亡作用和线粒体保护作用。因此,Sesn2-Nrf2通路可通过抗线粒体功能障碍作用显著减轻CLP诱导的SAE小鼠的认知功能障碍。
神经元炎症也是SAE的一个重要特征,组织病理学上与脑功能障碍相关[22]。死亡细胞会释放炎症因子,从而放大组织损伤。线粒体功能障碍以及其他类型的调节性坏死是促炎的,然而,线粒体功能障碍症如何引起炎症仍不清楚。大量研究表明,小胶质细胞在SAE中起着重要作用,刺激和放大炎症反应[23]。本研究在CLP海马组织观察到CD68/Iba-1阳性小胶质细胞数量显著增加,大量小胶质细胞被激活,呈阿米巴样,胞体大,突起短,而Eupatilin显著减少了激活的小胶质细胞数量。这些发现将微环境串扰与SAE发展联系起来,并定义了可能作为SAE有效靶点的重要细胞和分子介质。
此外,我们还评估了线粒体功能障碍的其他重要调节因子。首先,氨基酸代谢与线粒体功能障碍密切相关。几种氧化还原酶利用谷胱甘肽减少脂质活性氧,包括GPX4[24]。其次,双烯丙基多不饱和脂肪酸(PUFAs)的过氧化作用也是促进线粒体功能障碍的另一个关键步骤[25]。在氧化应激下,增加PUFAs的合成可以促进脂质过氧化。酰基辅酶a合成酶长链家族成员4(ACSL4)是调节PUFAs合成的关键脂质代谢酶。ACSL4首先催化游离花生四烯酸(AA)-CoA之间的生化反应,然后促进它们酯化成磷脂,这是形成磷脂氢过氧化物所必需的。然后ALOX家族(主要是ALOX12)介导PUFA过氧化,导致大量脂质ROS的释放[25]。研究发现,脂质过氧化与各种神经系统疾病的发生有关,并伴有GPX4水平的降低[8]。本研究表明,Eupatilin能有效增加LPS诱导的海马神经元细胞(HT22)中GPX4的表达水平,并降低ACSL4的表达水平。基于这些研究,我们推测Eupatilin对SAE的抗氧化活性可能与抑制线粒体功能障碍有关。si-Nrf2转染的HT22细胞则降低了Eupatilin对LPS的抗线粒体功能障碍作用,导致更严重的细胞凋亡和线粒体功能障碍。
总之,本研究证明了Eupatilin通过激活Sesn2-Nrf2通路减轻SAE小鼠的认知功能障碍、神经功能缺损,并且通过减轻线粒体功能障碍来改善炎症微环境。这些数据有助于我们对SAE后线粒体功能障碍的理解,并为进一步研究提供了有价值的候选靶标信息。然而,因为Eupatilin并非Sesn2的特异性激动剂,目前的结果尚不能完全证明Eupatilin通过Sesn2-Nrf2保护线粒体功能在脓毒症脑损伤中的作用,未来的研究需要考虑使用Sesn2基因敲除小鼠。
