基于代谢组学探讨阿司匹林对小鼠急性炎症的干预作用
2024-03-25赵淑锐王耀楠吴英婷郑美青
赵淑锐 王耀楠 吴英婷 郑美青
(首都医科大学药学院,北京 100069)
0 引言
炎症是机体对各种致炎因子的刺激所产生的病理过程[1],具体表现为局部红、肿、热、痛和功能障碍等[2]。炎症见于多种疾病的病理过程,发病前期多以急性炎症为主,表现为以血管反应为中心的渗出性变化,久而不愈会渐渐转为慢性炎症。因此,开发安全有效的抗炎药物具有巨大的临床应用价值。
有研究表明,二甲苯虽然是低毒物质,但是其高浓度具有刺激作用。二甲苯、TPA、花生四烯酸等物质常被作为急性炎症模型的致炎因子[3,4]。二甲苯引起的耳肿胀急性炎症模型可能主要引起组胺、缓激肽等炎症介质的释放,引起局部血管扩张、毛细血管通透性增加、炎症细胞浸润,造成耳部急性渗出性炎症水肿[5]。由于二甲苯诱导的小鼠急性耳肿胀模型可以作为典型的化学性因素引发的急性炎症模型[6],且易于操作、没有特殊设备限制、建模时间短,成功率高等,因此常被用于抗炎药物的筛选和评价药理模型[7]。
阿司匹林(乙酰水杨酸),具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等多方面的药理作用。可以说阿司匹林在诸多疾病治疗过程中起着不可或缺的作用。为了进一步阐明其在机体炎症代谢过程中的影响,本实验初步进行了阿司匹林在小鼠急性炎症治疗过程中的代谢组学研究。
实验拟采用UPLC Q-TOF/MS 代谢组学技术,探讨阿司匹林在二甲苯诱导的小鼠急性耳肿胀实验中血浆代谢物的差异,分析其影响的相关代谢通路,明确其抗炎的作用机制,为相关抗炎新药研究提供参考。
1 材料与方法
1.1 实验动物
体重20±2g (±SD g)的ICR雄性小鼠,购买于北京维通利华动物实验技术有限公司。
1.2 试剂与仪器
色谱柱:Aquity UPLCTMBEH C18(2.1×50mm,1.7μm),Waters;高速冷冻离心机:HITACHI himac CR22GⅡ;涡旋振荡器:IKA MS3 digital;多功能样品浓缩仪:北京普利泰科仪器有限公司,EVA30A;超高效液相色谱: Acquityi-class,waters公司;四级杆飞行时间质谱联用仪: Synapt G2-Si,waters公司;超声波清洗器:昆山市超声仪器有限公司,KQ-500E型;甲醇(Fisher,LC/MS);乙腈(Fisher,LC/MS);超纯水,甲酸(Fisher, LC/MS)。
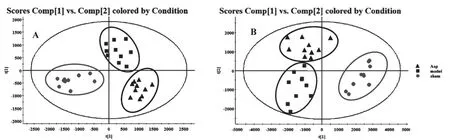
图1 基于UPLC-MS数据所得PCA得分图
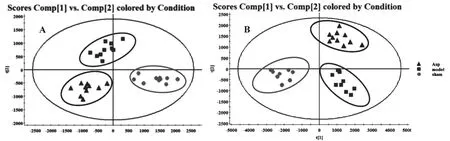
图2 基于UPLC-MS数据所得PLS-DA得分图
1.3 试验方法
30只体重20±2g (x±SDg) 的小鼠,在静息饲养一天后均衡随机分为3组,分别为实验组(阿司匹林Asp组,灌胃给药20mg/kg),模型组(model组,生理盐水),正常对照组(shame组,不做任何处理正常饲养)。采用序灌法分别对给药组和对照组小鼠给药,给药30min后按照给药顺序依次在小鼠的右耳外廓均匀涂抹30μL二甲苯溶液,进行耳肿胀造模。小鼠右耳外廓涂完二甲苯后变红,并逐渐发白变厚。造模2h后,按照给药顺序依次摘眼球取血处死小鼠,将小鼠左右耳分别贴耳根剪下,小心重合叠放,选用型号为YLS025A电动耳肿打耳器(圆孔直径7mm)在两耳的相同位置打孔,将得到的圆形耳片分别称重,记录[8]。依据如下公式计算肿胀度:
肿胀度(mg)=右耳圆片重量-左耳圆片重量
实验数据统计采用t检验进行分析,以x±SDmg表示。
1.4 血浆样品提取
实验结束后小鼠摘眼球取血,所有血液样本均收集在肝素化EP管中。样品采集后于4℃,3000转/分钟离心10分钟,取上清液100μL于1.5mL离心管内,加入300μL甲醇涡旋30秒,将所有样品在4℃下15000rpm离心,持续15分钟。每样品取上清300μL,转移到1.5 mL离心管中,低温下经氮气吹干。吹干后,用100μL甲醇复溶样品,4℃下15000转/分钟离心,持续15分钟。取上清液转移至进样小瓶。每个样品取10μL混合在一起作为质量控制(QC)。
1.5 UPLC/MS分析方法
色谱分离使用Acquity UPLCTMBEH C18色谱柱(2.1mm×100mm,1.7μm,美国Waters公司)。流动相A为0.1%的甲酸水溶液,流动相B为0.1%的甲酸乙腈,采用梯度洗脱(见表1),柱温35℃,流速为350μL/min,进样量为2μL。质谱采用电喷雾离子源,正、负离子模式进行检测。仪器参数:毛细管电压1000V,去溶剂气流速800L/h,温度450℃,源温度120℃,锥孔气流速50L/h,喷雾气压6bar,碎裂电压20~45V,取样锥孔电压6V,采集模式为MSEcontinuum,分辨率模式,带电粒子的质量数与电荷数之比(m/z)数据采集范围100~1000,低能量通道碎裂电压6V,高能量通道碎裂电压选择梯度电压20~60V。
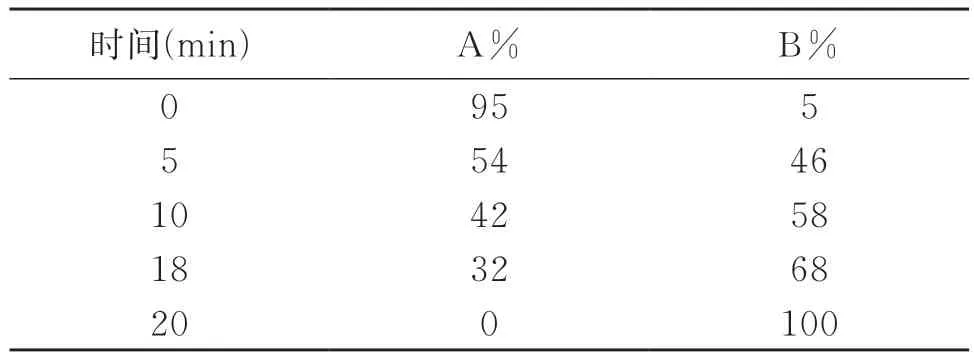
表1 液相梯度洗脱条件
2 结果与讨论
2.1 阿司匹林对二甲苯诱导的小鼠急性耳肿胀影响
由实验结果可以看出(见表2),生理盐水空白对照组的耳肿胀度为13.41±2.38mg,阿司匹林通过灌胃给药方式,在200mg/kg剂量下耳肿胀度为7.61±1.22mg;结果经t检验,阿司匹林组与生理盐水组相比,P< 0.01二者之间统计学上存在显著性差异。
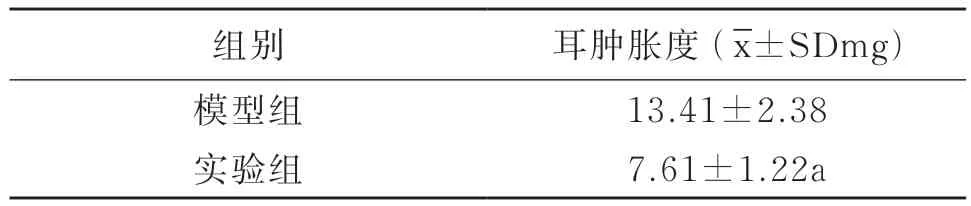
表2 各组耳肿胀度结果
基于UPLC-MS所得到的质谱数据。运用QI软件对数据进行归一化以及峰对齐结处理。通过对正常对照组,模型组组,和实验组数据进行无监督的PCA分析。结果发现正负两种离子模式下的数据PCA评分图(见图1)显示正常对照组(shame)和模型组(model)和实验组(Asp)之间的分离是明显的,表明3组具有完全不同的代谢组成。为了评估二甲苯诱导的急性炎症小鼠代谢组学的系统变化,基于正常对照组(shame)、模型组(model)、实验组(Asp)建立PLS-DA模型。在PLS-DA数据分析的得分图中可以更加明显的观察到3组的分离趋势(见图2)。
设定变量投影重要度参数VIP(Variable important for the projection),VIP 值越大,差异越显著。PLS-DA分析选定VIP 值≥1。以这种方式,在ESI正离子模式中鉴定了576种化合物物,并且在ESI负离子模式中鉴定了512种化合物。通过化学搜素引擎(chemspider)对这些选择的化合物的精确质量和质量碎片的数据进行数据库(KEGG,HMDB,Nature Chemistry,Nature Chemical Biology)搜索。结果,最终保留了9种推定的代谢物用于进一步代谢组学分析。9个相对标准偏差P<0.01的代谢物与其他细节一起列于表3中。

表3 潜在代谢物差异标志物
基于鉴定的具有显著性差异的代谢物标志物,将鉴定的9种生物标志物输入到MetPA (http:// metpa.metabolomics.ca./MetPA) 数据库中,构建代谢通路,使用代谢组学分析软件(MetaboAnalyst)对阿司匹林调节的代谢途径和网络进行更详细的分析(见图3)。

图3 阿司匹林主要影响的代谢通路
2.2 讨论
选定潜在的目标代谢物通路分析impact-value≥0.10,揭示了标记的代谢产物对于阿司匹林干预二甲苯导致的小鼠急性炎症的代谢的重要性。由分析结果看阿司匹林干预二甲苯导致的小鼠急性炎症中主要影响了4条代谢途径,包括抗坏血酸和醛酸代谢,甘油磷脂代谢,葡萄糖醛酸酯的相互转化代谢,花生四烯酸代谢。
文献报道[9]炎症可以引起磷脂代谢的紊乱,脂质是细胞膜的结构成份,其具有激活和参与信号转导途径、维持电化学梯度和转运蛋白等生物功能[10,11], 其代谢紊乱也会导致炎症的发生[12]。甘油磷脂也是花生四烯酸的前体物质,花生四烯酸代谢是炎症代谢网络的核心。机体炎症刺激后释放花生四烯酸,然后被氧化并进一步修饰以形成各种类二十烷酸,包括前列腺素,血栓素和白细胞三烯[13]。生理盐水组中的花生四烯酸代谢物5-HPETE水平与正常对照组相比有所升高,阿司匹林治疗干预后,5-HPETE水平有所下调。从实验结果可以推测阿司匹林存在潜在调节甘油磷脂代谢的功能。
在抗坏血酸代谢和葡萄糖醛酸酯相互转化的过程中,D-葡萄糖醛酸在一系列酶的作用下可转化为抗坏血酸。抗坏血酸作为强效的水溶性抗氧化剂,其可以抑制白细胞中的过氧化物酶/过氧化氢/卤化物系统的活化,进一步影响白细胞的运动[11]。实验结果发现生理盐水组中的D-葡萄糖醛酸水平明显高于正常对照组,表明机体受到刺激释放更多的抗坏血酸以抑制炎症反应。文献报道[14]酵母诱导的发热模型中炎症反应强烈,并发现D-葡萄糖醛酸水平升高。阿司匹林干预后,D-葡萄糖醛酸水平下降,表明阿司匹林可能逆转了D-葡萄糖醛酸水平。
3 结语
本实验通过采用代谢组学的研究方法,考察阿司匹林在二甲苯导致的ICR小鼠的耳肿胀模型中影响的代谢途径。阿司匹林逆转了9种急性炎症的血浆代谢物标志物。抗炎活性主要通过调节血浆中的抗坏血酸和醛酸代谢,甘油磷脂代谢,葡萄糖醛酸酯的相互转化代谢,花生四烯酸代谢。这一结果为以后相关抗炎新药作机制研究提供一定的思路及依据。
