日本沼虾StAR 基因克隆及其低氧胁迫下表达分析
2024-03-25赵倩倩孙盛明
郑 诚,薛 程,赵倩倩,孙盛明,2*
(1.上海海洋大学,农业农村部淡水水产种质资源重点实验室,上海 201306;2.上海海洋大学,水产种质资源发掘与利用教育部重点实验室,上海 201306)
类固醇激素能够在动物的性别分化发育中起到关键作用,其合成以胆固醇为前体,通过一系列类固醇合成酶进行催化,最后形成性类固醇激素和皮质醇素[1]。StAR编码的类固醇急性调节蛋白是一种在线粒体膜上的转运蛋白,首次由 Clark等[2]从小鼠(Mus musculus)睾丸间质细胞中纯化分离得到,其主要功能是完成胆固醇从线粒体外膜向线粒体内膜的转运过程,这不仅是类固醇激素合成的起始阶段,也是类固醇激素合成过程中关键的调控步骤[3]。迄今为止,StAR已经在多种鱼类研究中相继报道,如虹鳟(Oncorhynchus mykiss)[4]、波纹绒须石首鱼(Micropogonias undulatus)[5]和塞内加尔鳎(Solea senegalensis)[6]。已有研究表明,StAR在青鳉(Oryzias latipes)幼鱼孵化后才有表达,要远远落后于其他类固醇合成酶基因的表达[7],而尖齿胡鲇(Clarias gariepinus)StAR在性别分化时期中也极其微量的表达[8]。针对上述问题有学者发现,尼罗罗非鱼(Oreochromis niloticus)StAR具有2 种亚型StAR1 和StAR2,并观察到StAR2 可能是由StAR1 重复产生的旁系同源基因,StAR2 负责在雌性决定/分化早期尼罗罗非鱼的性腺中产生雌激素(即雌二醇),并在性腺组织转录组分析中表明StAR2 可能是雌二醇(estradiol,E2)产生以诱导卵巢分化的必要因素,而两者都参与了雄激素11-酮基睾酮(11-keto testosterone,11-KT)的产生以促进睾丸分化和维持[9]。
目前在水生动物类固醇激素研究中主要聚焦在鱼类,而经济甲壳动物的类固醇激素合成路径及其机制研究却鲜有问津,甲壳动物是否与鱼类存在相似的类固醇合成途径及其关键节点蛋白,这是值得深入探讨的问题,为此本实验以日本沼虾(Macrobrachium nipponense)为研究对象,探讨日本沼虾StAR在类固醇激素合成中的具体功能。日本沼虾俗称青虾、河虾,隶属于十足目(Decapoda)长臂虾科(Palaemonidae)沼虾属(Macrobrachium),是我国重要淡水养殖经济虾类之一。近年来,相关课题组在日本沼虾人工养殖技术和群体遗传多样性方面的研究均取得了一定进展[10-13],然而日本沼虾对养殖水体溶解氧含量要求较高,日本沼虾不耐低氧的生物学特性已经成为高密度集约化养殖的限制因素[14-15]。低氧(hypoxia)是指水环境中溶解氧(DO)浓度低于2.8 mg/L 的现象[16],其对水生动物生长、存活和繁殖的影响已有大量报道[17-19]。已有研究表明,低氧也会干扰鱼类内分泌系统,会通过减少类固醇生成相关基因表达量,从而抑制类固醇激素合成和性腺发育[20-21],那么低氧是否针对甲壳动物也发挥内分泌干扰物的作用,从而影响日本沼虾StAR基因表达与定位,这值得我们深入研究。
本实验通过对日本沼虾StAR基因的克隆、序列特征与原核表达分析,探讨低氧下日本沼虾StAR基因表达模式,并采用Western blot 与免疫组化技术验证了低氧胁迫下日本沼虾StAR 蛋白在精巢组织中的表达与定位,研究结果为探究低氧下日本沼虾类固醇激素合成途径及其机制奠定基础。
1 材料与方法
1.1 实验方法及样品采集
性腺成熟的日本沼虾购于上海海洋大学附近的东海农场,暂养于上海海洋大学水产与生命学院E 楼循环水养殖玻璃缸(100 cm×50 cm×60 cm)中,实验室暂养7 d [水温(25±2) °C,pH (7.72±0.20),溶解氧充足,每天早晚定时喂食商品饲料]后,用于急性低氧胁迫实验。对照组和实验组 [对照组溶解氧,(6.6±0.2) mg/L;实验组溶解氧设置浓度参照已有文献报道[17,22],(2.0±0.2) mg/L]分别设置3 个玻璃缸,每个玻璃钢放20 尾健康活泼的雄性日本沼虾[(3.5±0.4) g]。对实验组养殖缸充氮气使得水体溶解氧浓度调节至2.0 mg/L,后续每隔2~3 h 采用便携式溶氧仪(YSI 公司ProODO/T Cable Assy,美国)定期监测溶解氧含量,具体方法参照Sun 等[23]。低氧胁迫实验均在胁迫阶段1、3、6、12、24、48、96 h 分别采集精巢组织,每个时间点在对照组和低氧处理组分别取6 尾虾的精巢组织,同时解剖健康日本沼虾获取脑、鳃、肝胰、心脏、肌肉、肠道及精巢等组织,立刻放入液氮中,转入-80 ℃冰箱中保存。
1.2 RNA 提取与cDNA 合成
使用TRIzol 法提取RNA,使用NanoDrop 2000C (Thermo Scientific,美国)测定OD260/OD280的值,比值控制在1.8~2.0,之后通过1%琼脂糖凝胶电泳检测各组织总 RNA 的完整性。后续用反转录试剂盒Hifair®Ⅱ 1st Strand cDNA Synthesis Kit(gDNA digester plus)将所提RNA 反转录成cDNA,保存于-40 °C 冰柜中备用,用于随后StAR不同组织和不同低氧阶段的表达分析。
1.3 日本沼虾StAR 基因 cDNA 全长克隆
根据本实验室已构建的日本沼虾精巢cDNA文库,通过组装拼接和比对分析,获得一个类固醇急性调节蛋白StAR序列片段。以性腺 cDNA 为模板进行 PCR 扩增,获得cDNA 序列片段后,应用Primer premier 5.0 软件分别设计5′ RACE 和3′RACE 的特异性扩增引物(表1),以日本沼虾精巢cDNA 为模板,结合套式聚合酶链反应扩增出StAR基因的5'端和3'端。聚合酶链反应体系为50 μL,反应条件:94 ℃ 2 min;94 ℃ 30 s,56 ℃30 s,72 ℃ 30 s,35 次循环;72 ℃ 5 min。用1%琼脂糖凝胶电泳分析PCR 产物,经连接、转化后,将阳性菌落送生工生物工程(上海)股份有限公司测序。
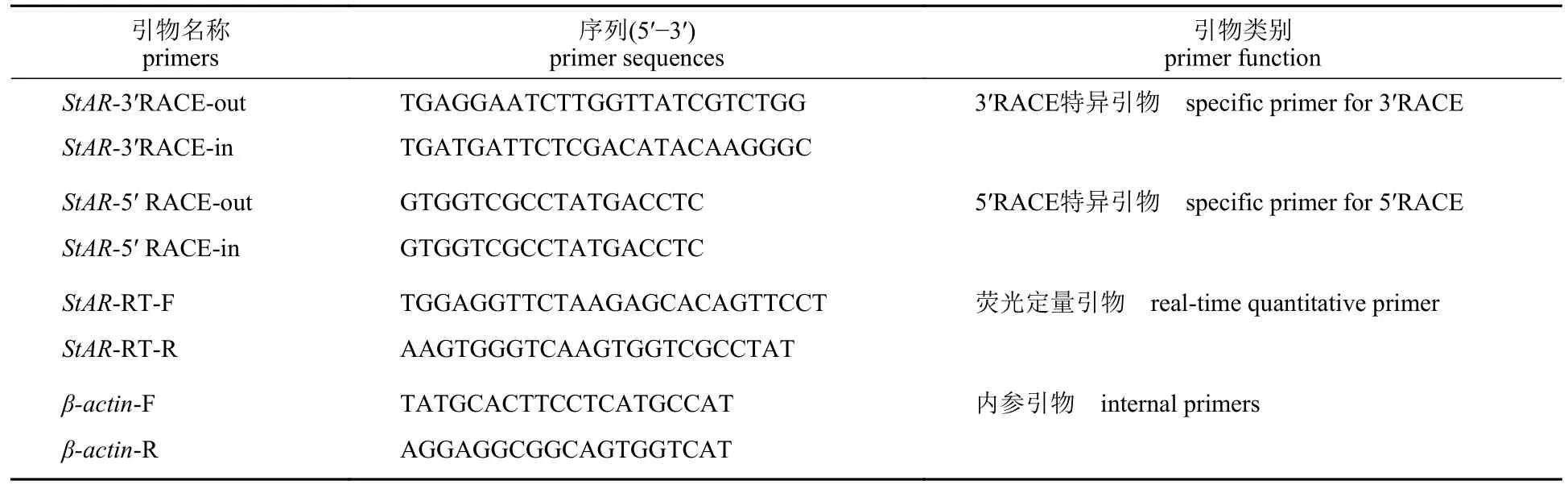
表1 实验所用引物Tab.1 Primers used in the experiment
1.4 日本沼虾StAR 基因序列与进化分析
利用cDNA 末端快速扩增技术克隆获得StAR基因cDNA 全序列,运用生物信息学手段通过NCBI 网站(https://www.ncbi.nlm.nih.gov/orffinder/)进行序列开放阅读框(ORF)分析、使用 DNAMAN软件进行氨基酸同源序列比对,通过MEGA5.0 软件采用邻近法 (Neighbor-Joining)构建系统法构建进化树、通过SMART(https://ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白质结构域分析,利用EXPASY Proteomics Server(https://web.expasy.org/protparam/)分析氨基酸序列参数,分别通过TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)和NovoPro(https://novopro.cn/tools/signal)进行蛋白跨膜区和信号肽预测等分析。
1.5 日本沼虾StAR 基因的组织表达分析
本研究采用了半定量RT-PCR 方法检测了StAR在脑(BR)、鳃(GI)、肝胰腺(HP)、心脏(HE)、肌肉(MU)、肠道(IE)及精巢(TE)中的表达分布。设计StAR的特异性引物StAR-RT-F 和StAR-RT-R,以β-actin为内参,进行PCR 反应,反应体系20 μL,包 含TaKaRa 的Premix EXTaq(ExTaqTM version 2.0 plus dye)10 μL,各组织cDNA 模板(0.1~1.0 μg/μL)1 μL,上下游引物各0.4 μL,RNase free H2O 9.2 μL。反应程序为98 ℃ 10 s,60 ℃ 30 s,72 ℃ 1 min,共35 个循环,将所扩增的PCR 产物进行1%核酸凝胶电泳得出结果。
1.6 qRT-PCR
qRT-PCR 使用YEASEN 的染料法荧光定量试剂盒,设计StAR的特异性引物StAR-RT-F 和StAR-RT-R,内参为β-actin,反应体系20 μL,包含Hieff UNICON®Power qPCR SYBR Green Master Mix 10 μL,上下游引物各0.4 μL,cDNA 9.2 μL(RNase free H2O 稀释),反应程序:95 ℃ 30 s;95 ℃10 s,60 ℃ 30 s,共40 个循环。每个处理设置3个技术重复平行样,并且进行3 次生物重复。熔解曲线由 BIO-RAD iQ5 的实时分析软件分析,荧光定量实验数据用2-△△CT法分析并计算相对表达水平,以平均值±标准误表示(mean ± SE,n=3)。作图采用Graphpad prism 软件,方差分析和多重比较采用SPSS 19.0 软件和t检验法,显著性差异水平设为P<0.05。
1.7 多克隆抗体制备
质粒构建及StAR 蛋白纯化 选择日本沼虾StAR序列合适区域设计特异性引物并通过 PCR扩增出足够量的 PCR 产物,目的片段 PCR 扩增后回收凝胶电泳产物,并与表达载体 pET-28a 同时用NdeI、XhoI 进行双酶切,构建重组质粒连接液转入TOP10 感受态中,检测筛选出阳性克隆进行测序验证,获得重组质粒。将重组质粒转入大肠杆菌(Escherichia coli)感受态细胞,热激后涂布在含有对应抗生素的平板上进行培养,挑取单克隆到含有抗生素的液体培养基中培养,并当OD 值达到 0.6 时,加入IPTG 诱导剂诱导4 h 后取出菌液,超声波破碎,4 ℃、10 000 r/min 离心10 min,分离上清液和沉淀,进行后续的聚丙烯酰胺凝胶电泳(SDS-PAGE) 验证及蛋白纯化。
多克隆抗体制备及抗体效价检测 初免抗原为蛋白抗原与等体积弗氏完全佐剂混匀乳化,二免、三免、四免抗原为蛋白抗原与等体积弗氏不完全佐剂混匀乳化。一免二免间隔20 d,之后都间隔14 d,总共4 次,免疫结束后进行采血离心获得抗体血清,使用ELISA 法检测抗血清效价,以免疫前的兔血清作为阴性对照,梯度稀释含有抗体的血清,利用酶标仪(Multiskan FC,Thermo Scientific,美国)检测 450 nm 条件下各样品的OD 值。当处理组/阴性对照组的光吸收值比值≥2时判定为阳性,抗体效价即为 ELISA 反应阳性血清最大稀释度。
1.8 Western blot 分析
采用Western blot 方法分析低氧下日本沼虾精巢中StAR 表达模式[9],根据本实验StAR 蛋白分子量配置10%的分离胶及5%的浓缩胶,将已定量蛋白上样(20 μg/孔)并进行SDS-PAGE 凝胶电泳,转膜采用NC 膜湿转法。使用3% BSATBST 稀释一抗[实验组为本实验室制备的StAR抗体;对照组是β-Actin 抗体[β-Actin (13E5) Rabbit mAb (Cell Signaling Technology,美国)],使用5%脱脂奶粉-TBST 稀释HRP 山羊抗兔IgG (武汉博士德生物工程有限公司),利用化学发光凝胶成像仪(Tanon 5 200 Multi,中国)进行拍照观察。
1.9 免疫组织化学
在低氧胁迫实验中1、3、6、12、24、48 h分别选取2 尾雄性日本沼虾,解剖取出精巢组织,4%多聚甲醛固定组织后用无水乙醇脱水,石蜡包埋后切片,对切片做免疫组化实验。首先对切片进行脱蜡复水操作,然后放到EDTA 抗原修复液中100 ℃ 20 min,并自然冷却至室温,用PBST洗去修复液。之后加3%的 H2O2-甲醇溶液室温下孵育10 min,以阻断内源性过氧化物酶的活性;用3%~5%的BSA 溶液封闭30 min,去除封闭液后便用自制StAR 抗体[1∶100 磷酸盐缓冲溶液(PBS)稀释]进行孵育,4 ℃过夜;用PBS 漂洗3 遍,每次5 min;加反应增强液PV-9 000(ZSGBBIO,中国),37 ℃孵育20 min;洗去并滴加HRP 山羊抗兔IgG(1∶1 000 PBS 溶液稀释,体积比),室温孵育2 h;洗二抗用PBS 漂洗3 遍,每次5 min;加显色剂DAB 10~30 s;之后充分水洗,染苏木素、水洗、乙醇分化、脱水透明并封片,静置后荧光显微镜(ECLIOSE Ci-L,Nikon)下拍照观察。
2 结果
2.1 日本沼虾 StAR 基因cDNA 序列特征
通过RACE-PCR 技术对日本沼虾StAR基因cDNA 序列进行拼接后,获得全长为3 361 bp 的序列(图1),其中 5′-UTR 323 bp,3′-UTR 2 129 bp,开放阅读框909 bp,编码302 个氨基酸,编码蛋白质分子量为35.29 ku,理论等电点为6.03,通过NovoPro 网站对日本沼虾的StAR 氨基酸序列进行预测,发现其信号肽不存在。日本沼虾StAR基因cDNA 序列已经提交到GenBank,登录号为MW263908。

图1 日本沼虾StAR 基因cDNA 序列及其编码的氨基酸序列红色碱基代表该序列的起始密码子和终止密码子,黑框的为加尾信号,polyA 尾用下划线标出。Fig.1 Nucleotides and deduced amino acid sequences of StAR gene cDNA of M.nipponenseThe red bases represent the start and stop codons of the sequence,the black box is the tailing signal,the polyA tail is underlined.
2.2 StAR 氨基酸序列比对及进化分析
通过NCBI 数据库中查找并下载不同物种StAR 氨基酸序列,与克隆得到的日本沼虾StAR序列使用 DNAMAN 软件进行氨基酸同源序列比对(图2),通过MEGA5.0 软件采用邻近法 (Neighbor-Joining)构建系统法构建进化树。结果显示,日本沼虾 StAR 与三疣梭子蟹(Portunus trituberculatus)、凡纳滨对虾(Litopenaeus vannamei)、日本囊对虾(Marsupenaeus japonicus)相似性最高,并与鱼类、两栖类、哺乳类形成了不同分支,亲缘关系较远(图3),这与日本沼虾的分类地位相一致。
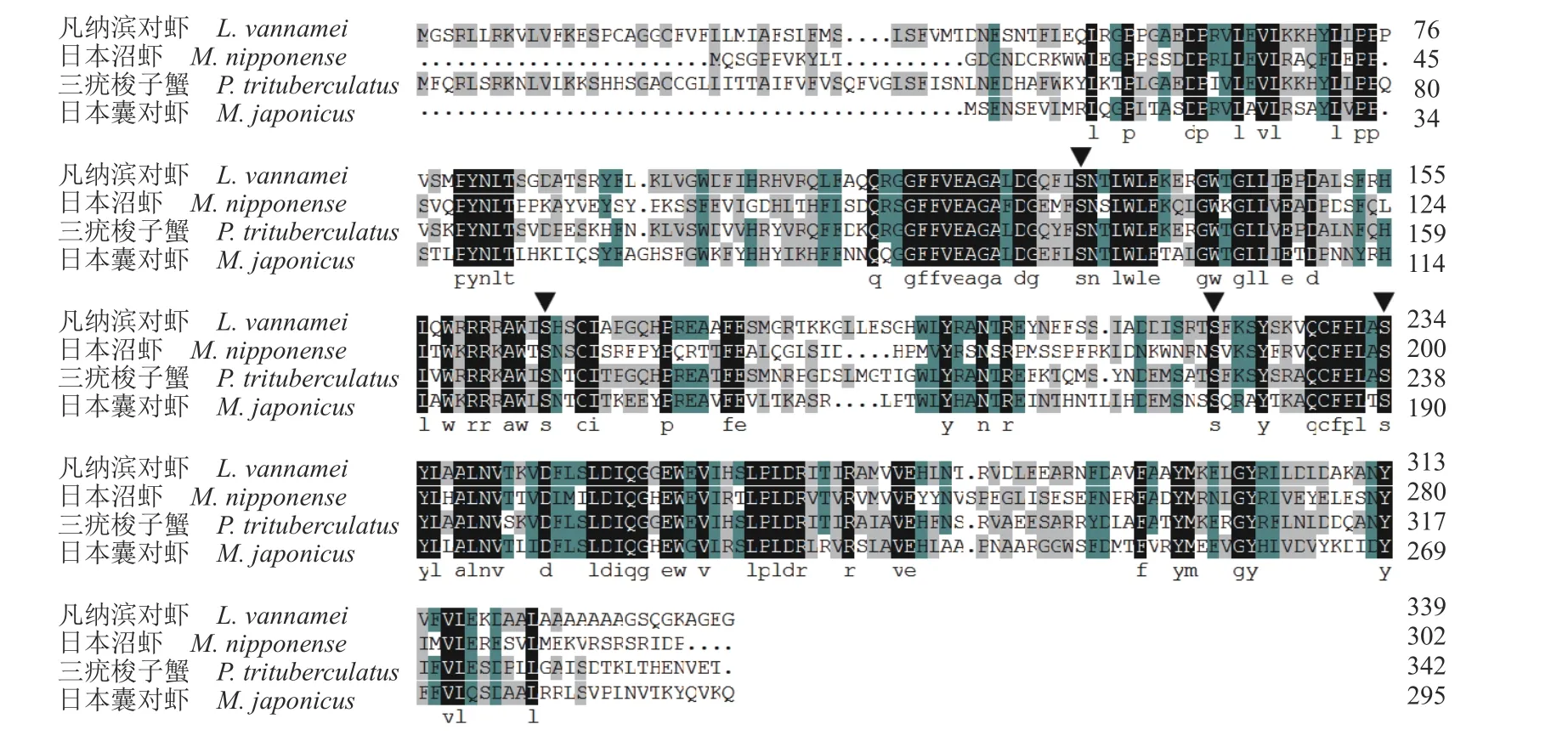
图2 日本沼虾StAR 和其他物种StAR 氨基酸同源序列比对日本沼虾(MW263908),三疣梭子蟹 (MPC99197.1),凡纳滨对虾 (XP_027230069.1),日本囊对虾(XP_042893986.1);三角标注的为保守的磷酸化位点。Fig.2 Alignment results of StAR amino acid sequences of M.nipponense and other seven speciesM.nipponense (MW263908),P.trituberculatus (MPC99197.1),L.vannamei (XP_027230069.1),M.japonicus (XP_042893986.1);conserved phosphorylation sites are marked with triangles.
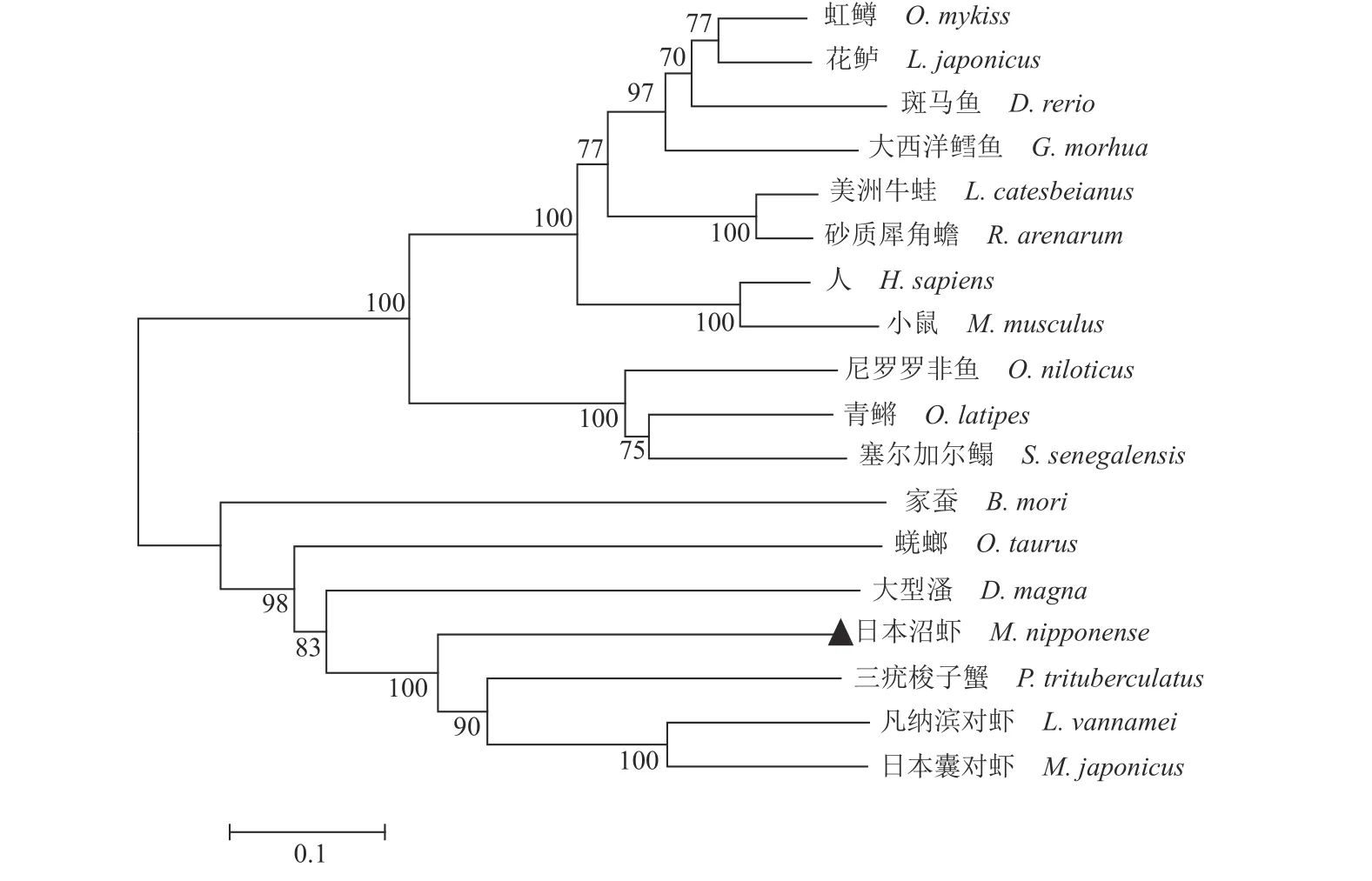
图3 日本沼虾StAR 与其他物种StAR 的系统进化树所涉及物种及GenBank 登录号:日本沼虾 MW263908,虹鳟 NP001117674,斑马鱼 NP571738,大西洋鳕AAP44112,鸡AAK50433.2,美洲牛蛙ACJ53927,砂质犀角蟾AMD33476,人 NP000340,大型溞 XP_032788316.1,花鲈 AFN73130.1,三疣梭子蟹 MPC99197.1,尼罗罗非鱼 StAR2 XP003445653,青鳉StAR2 ENSORLP00000011263,塞尔加尔鳎 StAR2 EU921450,凡纳滨对虾XP_027230069.1,日本囊对虾XP_042893986.1,家蚕 AAL51081.1,蜣螂 XP_022906085.1。Fig.3 Phylogenetic tree based on the sequence of M.nipponense StAR and StAR from other speciesthe species involved and the GenBank accession number: M.nipponense MW263908,O.mykiss NP001117674,Danio rerio NP571738,Gadus morhua AAP44112,Mus musculus AAK50433.2,Lithobates catesbeianus ACJ53927,Rhinella arenarum AMD33476,Homo sapiens NP000340,Daphnia magna XP_032788316.1,Lateolabrax japonicus AFN73130.1,P.trituberculatus MPC99197.1,Oreochromis niloticus StAR2 XP003445653,Oryzias latipes StAR2 ENSORLP00000011263,Solea senegalensis StAR2 EU921450,L.vannamei XP_027230069.1,M.japonicus XP_042893986.1,Bombyx mori AAL51081.1,Onthophagus taurus XP_022906085.1.
2.3 重组质粒酶切验证及融合蛋白表达检测
根据引物设计的酶切位点对筛选得到的阳性重组表达质粒进行酶切处理,并进行1%琼脂糖凝胶电泳,结果与预期条带符合(图4-a),验证后命名为 pET28a-StAR。将重组质粒培养诱导,收集菌体制样准备SDS-PAGE 检测,结果显示,出现分子量约34 ku 的目的条带,且与预期分子量大小一致(图4-b)。融合蛋白经过纯化,SDSPAGE 电泳检测理论分子量相接近位置出现明显条带,可初步确定融合蛋白成功得到了纯化(图4-c)。

图4 重组质粒酶切验证及融合蛋白表达(a) M.marker,1.双酶切后的目的基因,2.构建好的表达质粒;(b) M.protein marker,1.诱导前总蛋白,2.20°C 上清液,3.20°C 沉淀,4.37°C 上清液,5.37°C 沉淀;(c) M.protein marker,1.纯化后蛋白。Fig.4 Recombinant plasmid digestion verification and fusion protein expression detection(a) M.marker,1.target gene after double digestion,2.constructed expression plasmid;(b) M.protein marker,1.total protein before induction,2.supernatant at 20 °C,3.20 °C pellet,4.37 °C supernatant,5.37°C pellet;(c) M.protein marker,1.purified protein.
2.4 抗体血清效价检测
通过ELISA 法检测,抗体效价值≥2.5×阴性值,制备的日本沼虾StAR 多克隆抗体的效价为 ≥5.12×105(表2),可以进行后续的Western blot 和免疫组化实验。

表2 ELISA 法检测StAR 抗体血清效价Tab.2 Detection of StAR polyclonal anti-serum titer by ELISA method
2.5 日本沼虾StAR 基因表达分析
不同组织中表达分析 本研究采用了半定量RT-PCR 方法检测在脑、鳃、肝胰腺、心脏、肌肉、肠道、精巢中的表达分布,结果显示,日本沼虾StAR在肝胰腺和心脏中表达较低外,其他组织表达均为较高水平,这表明StAR在日本沼虾组织中分布广泛(图5)。

图5 日本沼虾StAR 基因组织分布1.脑,2.鳃,3.肝胰腺,4.心脏,5.肌肉,6.肠道,7.精巢。Fig.5 Distribution of StAR genes in M.nipponense1.brain,2.gill,3.hepatopancreas,4.heart,5.muscle,6.intestine,7.testis.
实时荧光定量PCR 与Western blot 分析
以小时为单位,通过 qRT-PCR 检测日本沼虾不同低氧阶段的精巢 组织中StAR基因表达情况。结果显示,StAR表达量随着低氧胁迫时间增加总体呈降低趋势,与对照常氧组相比,低氧胁迫组日本沼虾StAR表达量在48 h 之前仍保持显著升高(P<0.05),而在低氧96 h 时StAR表达量显著降低(P<0.05)(图6-a)。Western blot 结果证实StAR蛋白表达量在低氧96 h 也明显降低,与PCR 结果所呈现的趋势相似(图6-b)。

图6 低氧胁迫不同时间段精巢组织StAR 转录水平(a)和蛋白丰度(b)表达变化(b) 0.对照,1.低氧1 h,3.低氧3 h,6.低氧6 h,12.低氧12 h,24.低氧24 h,48.低氧48 h,96.低氧96 h。Fig.6 Temporal expression of StAR transcriptional levels (a) and protein abundance (b) in testis tissue under hypoxia stress at different time periods(b) 0.control,1.hypoxia 1 h,3.hypoxia 3 h,6.hypoxia 6 h,12.hypoxia 12 h,24.hypoxia 24 h,48.hypoxia 48 h,96.hypoxia 96 h.
免疫组化定位表达分析 利用制备的多克隆抗体为一抗,通过免疫组化实验分析低氧下日本沼虾精巢组织中 StAR 蛋白定位表达情况。结果显示,StAR 蛋白在精细胞、间质细胞中均有表达(图版),这与最早在小鼠睾丸间质细胞中发现相一致。
3 讨论
综合文献报道,StAR 蛋白主要功能是完成胆固醇从线粒体外膜向线粒体内膜的转运过程,这是类固醇激素合成过程中关键的调控步骤[24-26]。其中蛋白激酶A(PKA)介导的丝氨酸磷酸化的潜在位点,对于调节StAR 活性有重要意义[27],如人等哺乳动物中的StAR 蛋白Ser195和 Ser194的突变会降低类固醇生成的速率[28-29]。已有研究证实StAR基因在类固醇激素合成起始阶段起关键性作用,而类固醇激素是性别分化与发育的关键[1-2],但迄今为止,StAR基因在甲壳动物中的相关研究鲜有报道,更少会在低氧胁迫条件下对该基因的表达进行探讨。本研究克隆得到日本沼虾StAR基因 cDNA 全长序列,全长3 361 bp,其中开放阅读框909 bp,编码302 个氨基酸。其中Ser99、Ser135、Ser186和Ser200几个磷酸化位点在甲壳类StAR 序列中相对保守,表明其可能参与调节StAR 活性。日本沼虾StAR基因与甲壳类亲缘关系最近,并与节肢动物门中昆虫聚成一支,这基本上与传统的动物系统发生和分类次序一致。从实验结果中可以看出StAR基因在各组织都有表达,但具有组织表达丰度差异性,其在精巢中表达较高,与硬骨鱼类和哺乳类物种StAR基因组织表达模式相吻合[5,30-31]。
已有学者发现低氧能够抑制青鳉精巢发育和精子发生[32],并证实低氧作为一种特殊的应激源发挥类似内分泌干扰物的效应,会通过抑制斑马鱼StAR基因的表达从而抑制类固醇激素的生成[33-34]。研究表明,StAR基因在低等脊椎动物鱼类雄性生殖中起到至关重要的作用[5,35],且在对尼罗罗非鱼StAR基因研究中发现,旁系同源基因StAR2 会影响卵巢发育分化,而StAR1 和StAR2都会参与11-酮基睾酮的合成从而在精巢发育分化中发挥重要作用[9,36]。本实验qRT-PCR 结果显示,低氧48 h 时日本沼虾精巢组织中StAR基因表达量显著高于对照,其原因可能是短期低氧胁迫下日本沼虾能够通过诱导StAR基因mRNA 的转录水平上升,来抵消低氧应激所带来的负面效应。然而,随着低氧胁迫时间的增加,日本沼虾精巢组织中StAR基因表达量总体呈现下降趋势,表明长期低氧胁迫能够显著降低日本沼虾的StAR基因的转录水平,可能会影响性激素分泌,这与模式动物小鼠与斑马鱼的研究结果相类似[21,34]。
本实验还构建了StAR 的原核表达系统以及抗体制备,选择大肠杆菌表达系统成为表达StAR 蛋白的首选,其优点在于操作简单,为在蛋白水平验证StAR 在低氧胁迫响应的表达模式奠定了基础。通过Western blot 实验结果也证实,低氧胁迫48 h 前日本沼虾StAR 蛋白表达量水平与对照组相比较高,但其表达量水平随低氧胁迫时间增加呈现下降趋势,这与低氧条件会抑制小鼠间质细胞StAR 表达水平导致睾酮合成减少等研究结果相一致[37-38],可能是由于长期低氧胁迫会诱导精巢中生殖细胞凋亡,精巢中精母细胞及精子数量显著降低[23],从而导致在精巢中StAR 表达量降低。此外,本研究通过免疫组化实验,检测到 StAR 蛋白在低氧下日本沼虾精巢组织中的精细胞、间质细胞中均有表达,鉴于精巢间质细胞与雄激素合成以及分泌调节密切相关[39-40],这表明日本沼虾StAR基因可能在类固醇合成路径及精子发生过程中均发挥重要作用,但具体作用途径及其机制仍需进一步研究。
综上所述,本研究系统分析了StAR基因的序列结构域、组织表达特征以及低氧胁迫后该基因的表达模式;并进行StAR基因原核表达及其抗血清的制备,采用Western blot 与免疫组化在蛋白水平进行表达与定位分析,为解析低氧下日本沼虾类固醇激素合成的分子机制奠定了基础。
(作者声明本文无实际或潜在的利益冲突)
