重型创伤性脑损伤去骨瓣减压应用改良Paine点穿刺监测脑室内颅内压的优势
2024-03-25田和平钟琦王耿焕周海航
田和平,钟琦,王耿焕,周海航
嘉兴学院附属第二医院神经外科,浙江嘉兴 314000
重型创伤性脑损伤(traumatic brain injury,TBI)具有发病率高、病情紧急、恶化进展快、病死率高等特点[1],由于原发性损伤难以避免,纠正继发性损伤是重型TBI 救治的关键[2-3]。颅内压(intracranial pressure,ICP)增高导致的脑灌注压降低,是重型TBI引起继发性损伤的主要原因[4]。重型TBI患者格拉斯哥昏迷评分(Glasgow coma scale,GCS)<9分,多伴有难治性颅内高压,其治疗的关键是降低增高的ICP[5]。去 骨 瓣 减 压 术(decompressive craniectomy,DC)可有效地降低ICP,是重型TBI患者救治的重要手段[6-7]。目前认为,重型TBI行DC术后,大部分患者的ICP仍会升高至危险水平,导致脑灌注压下降;对重型TBI患者DC术后行ICP监测十分必要,能够为TBI 患者基于脑灌注压的治疗决策提供重要依据[8-9]。有创ICP 监测有多种术式,脑室内ICP 监测探头置入是目前DC 术中常用的方法,传统采用DC术中对侧切口颅骨钻孔经Kocher 点穿刺,但发生置管感染和术后出血等并发症的危险较大[10]。2020 年以来,本院开展了重型TBI 患者经DC 切口内改良Paine 点行脑室内ICP 监测探头置入的研究,并与传统的DC 对侧切口颅骨钻孔经Kocher 点穿刺进行对比,旨在为DC术中重型TBI的ICP监测提供更好的方案。
1 资料与方法
1.1 研究对象 选择2020 年4 月-2022 年4 月于嘉兴市第二医院行DC 联合脑室内ICP 监测术的重型TBI患者48例进行回顾性分析。纳入标准:(1)年龄18~75岁;(2)急性TBI,术前(受伤至手术开始)时间<12 h;(3)术前中重度意识障碍,GCS 评分4~8 分;(4)行单侧额颞顶部DC 联合脑室内ICP 监测探头置入术;(5)患者家属签字同意手术治疗方案。排除标准:(1)术前双瞳孔散大固定或CT 检查提示原发性脑干损伤;(2)术前存在休克或合并严重的重要脏器损伤;(3)既往患有严重的脏器功能不全或凝血功能障碍;(4)既往有神经功能缺损病史;(5)临床资料不完整;(6)多种原因导致的ICP 值显示异常(如负值、偏离值等)。
按照脑室内ICP 监测探头置入术式的不同,分为观察组(23例)和对照组(25例)。观察组行DC切口内经改良Paine 点ICP 探头置入术;对照组行DC 对侧切口颅骨钻孔经Kocher 点ICP 探头置入术。本研究经嘉兴学院附属第二医院临床伦理委员会审核批准(JXEY-2022ZFYJ162)。
1.2 手术方法
1.2.1 DC 术前根据患者的病情、头颅CT 表现,参考专家共识[11],行经额颞顶部DC 及颅脑血肿清除术。术中以蝶骨嵴为中心“T”字形或放射状切开硬脑膜,后以自体颞肌筋膜修补,放置硬膜外负压引流管,逐层严密缝合,关颅[12]。
1.2.2 改良Paine 点穿刺脑室ICP 探头置入术 DC术中,缝合硬脑膜前,行DC 切口内改良Paine 点脑室穿刺。自额部头皮切口用金属通条(ICP 监护系统提供)穿5~6 cm皮下隧道至对侧额部,并引入调零后的脑室型ICP 监护探头(Codman,美国)至切口内。设置穿刺点:前颅窝底内侧眶板上方2.5 cm,侧裂静脉前直角转额部4.5 cm[13];避开皮质血管电凝切开穿刺点皮层约0.5 cm,进针方向为垂直于脑表面,穿刺深度为5~7 cm(穿刺至5 cm时有突破但无脑脊液流出,可将带芯脑室型ICP 探头继续前进1~2 cm 至脑脊液流出停止,导管置入深度应<7 cm[14]),见脑脊液流出后关闭并固定外接颅外引流装置(威海世创医疗器械公司)及通过传输线连接外部监护仪进行实时ICP监测。
1.2.3 DC对侧切口颅骨钻孔经Kocher点脑室ICP探头置入术 DC 术前或术后,于DC 对侧行经额脑室钻孔引流术。设置穿刺点:冠状缝前和中线旁各2.5 cm 处;以穿刺点为中心做一平行于中线的直行切口长3~5 cm,显露颅骨后穿刺点处钻孔1 枚,切开硬脑膜,电凝局部皮质脑组织,自头皮直切口用金属通条(ICP监护系统提供)穿5~6 cm皮下隧道至钻孔侧颞部,并引入调零后的脑室型ICP 监护探头(Codman,美国)至切口内,进针方向为与矢状面平行对准两外耳道假想连线,穿刺深度约为5 cm,见脑脊液流出后关闭并固定外接颅外引流装置及通过传输线连接外部监护仪进行实时ICP监测。
1.3 术后处理 两组患者术后均入住神经外科重症监护病房监护治疗,保持患者头部抬高30°,以利于颈内静脉回流,使用镇痛镇静剂(丙泊酚、右美托咪定);适当过度通气,保持动脉二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)在30~35 mmHg;目标温度管理,通过水循环降温毯保持核心体温32~35℃并维持5 d,后以0.25℃/h 的速度进行复温,复温后控制核心体温<37.5℃[15];根据ICP 变化酌情使用质量分数20%甘露醇0.25~0.50 g/kg,同时可加用甘油果糖、呋塞米及白蛋白等。颅外引流瓶开口高于外耳道约15 cm处开放引流管,控制引流量30~200 ml/d;根据ICP 调整脱水剂药物应用,目标为ICP<20 mmHg;当ICP 持续>25 mmHg 且药物及释放脑脊液无法降低时,及时复查头颅CT,存在手术指征的患者急诊再次给予合适的手术方案治疗。病情平稳,ICP<20 mmHg 并停止引流1~2 d拔除ICP传感器。手术切口及ICP传感器进入头皮处每1~2 d换药并更换敷料1次[16]。
1.4 观察指标 (1)疗效相关指标,包括手术用时、术后甘露醇使用剂量与使用时间、ICP 监测持续时间。(2)并发症指标,包括术后再出血率、颅内感染率。术后再出血诊断标准:探头置入后24 h 内复查头颅CT发现探头置入所经途径出现或新出现的点斑状出血、脑内血肿或同侧硬膜下血肿,并经2 名神经外科医师及1 名影像科医师共同诊断出血与探头置入存在相关性[10]。颅内感染诊断参照《神经外科中枢神经系统感染诊治中国专家共识(2021 年版)》:①临床表现,如发热或低体温、颅高压症状、脑膜刺激征、意识和精神状态改变;②血液相关检查,如白细胞计数>10.0×109/L、中性粒细胞比例>0.8;③脑脊液相关检查,如脑脊液浑浊、白细胞计数>100×106/L、中性粒细胞比例>0.7、脑脊液糖含量降低(<2.2 mmol/L);④影像学检查,CT检查显示脑室系统扩张或有液平面;⑤脑脊液或ICP 探头细菌培养阳性。符合①-④为临床诊断,符合①-⑤为病原学诊断[17]。(3)预后相关指标。采用格拉斯哥预后评分(Glasgow outcome score,GOS)评估两组术后3个月时的治疗结果,将患者生存状态分为良好、中残、重残、植物生存、死亡;其中良好或中残被认为预后良好,重残、植物生存、死亡均被认为预后不良。
1.5 统计学处理 采用SPSS 22.0 软件进行统计分析,计量资料符合正态分布时以±s表示,组间比较采用t 检验;计数资料以例(%)表示,组间比较采用χ2检验,其中术后再出血率、颅内感染率、病死率比较采用Fisher 精确概率检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较 两组患者的年龄、性别、损伤原因、术前GCS 评分、术前时间、主要脑损伤类型、脑疝占比、合并对侧脑损伤占比等差异均无统计学意义(P>0.05),具有可比性(表1)。
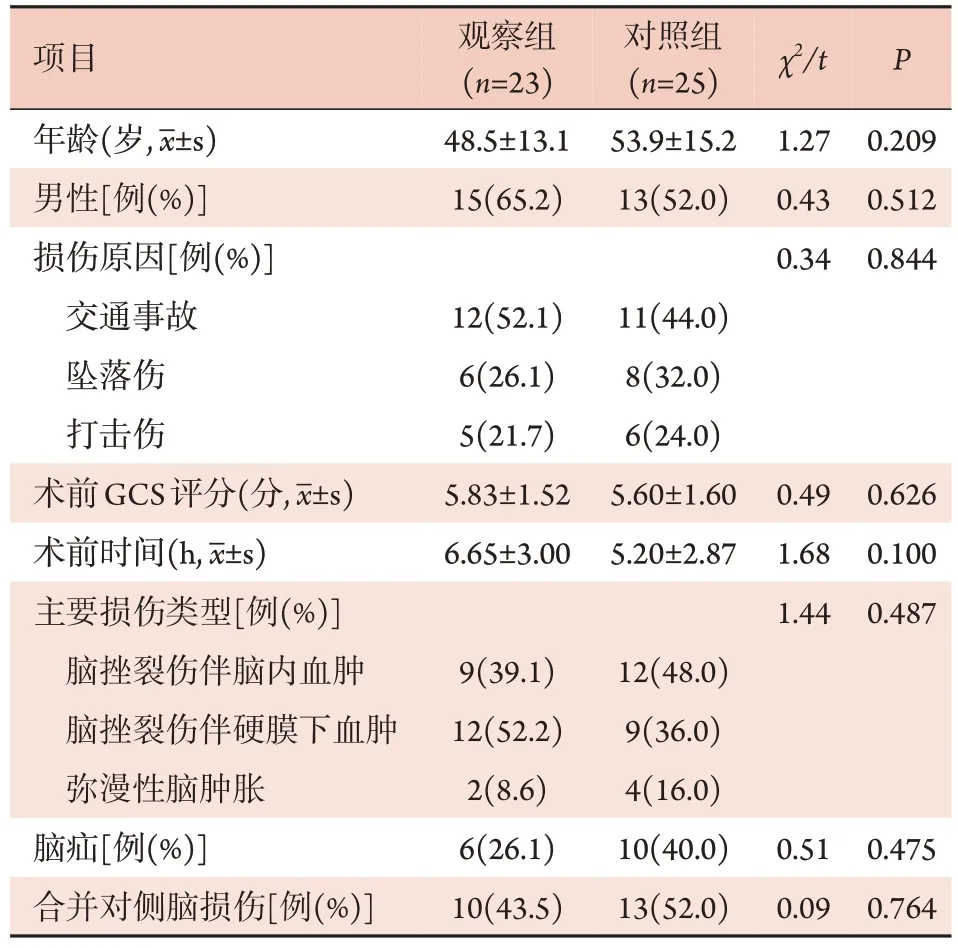
表1 两组TBI患者术前一般资料比较Tab.1 Comparison of preoperative general data between the two groups of TBI patients
2.2 两组疗效相关指标及并发症指标比较 观察组手术用时明显短于对照组(P<0.05);两组ICP监测持续时间、甘露醇使用剂量及使用时间比较差异均无统计学意义(P>0.05)。观察组术后再出血率、颅内感染率均明显低于对照组(P<0.05,表2)。
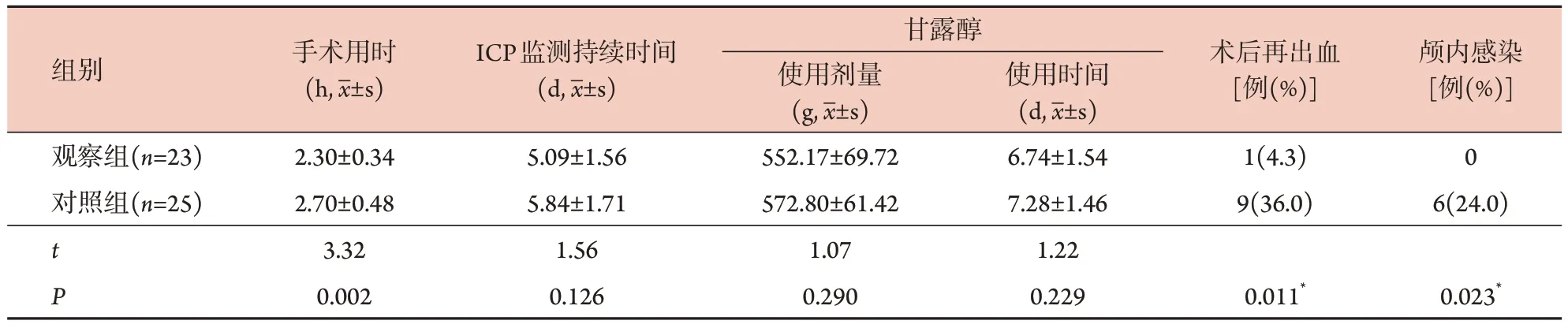
表2 两组重型TBI患者疗效相关指标、并发症指标比较Tab.2 Comparison of efficacy and complications in two groups of patients with severe TBI
2.3 两组预后相关指标比较 术后3 个月内,观察组因肺部感染死亡1 例,因消化道出血死亡1 例(病死率为8.7%);对照组因颅内感染死亡1例(病死率为4.0%);两组3 个月内病死率比较差异无统计学意义(P=0.601)。
术后3 个月时,观察组预后良好18 例(78.3%),预后不良5 例(21.7%);对照组预后良好19 例(76.0%),预后不良6 例(24.0%);两组术后3 个月时GOS评分比较差异无统计学意义(P>0.05,表3)。
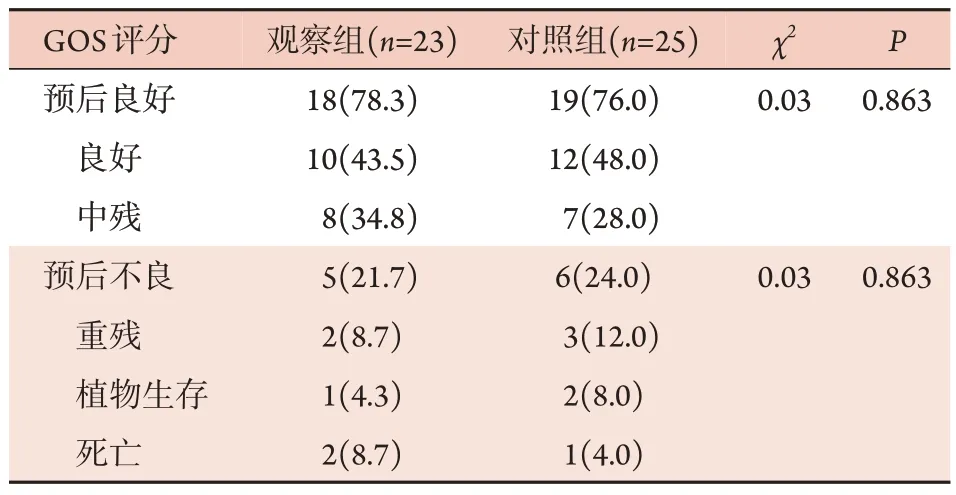
表3 两组重型TBI患者术后3个月GOS评分比较[例(%)]Tab.3 Comparison of Glasgow outcome score between two groups of patients with severe TBI 3 months after surgery [n(%)]
2.4 重型TBI 典型病例 患者男,47 岁,因“外伤后神志不清3.5 h”于2021年9月3日急诊入院。入急诊室时生命体征:血压132/84 mmHg,心率88 次/min,呼吸频率20 次/min,血氧饱和度(SpO2)100%;GCS 评分5 分;双瞳孔等大等圆,直径2 mm,对光反射迟钝。立即予以头颅CT 检查示:“左侧额叶创伤性脑出血,双侧额颞部硬膜下血肿,蛛网膜下腔出血”(图1)。以“重型闭合性TBI”急诊完善术前准备,全身麻醉,行“左侧脑内血肿、硬膜下血肿清除术+DC+改良Paine 点脑室内ICP 探头置入术”;术后收住神经重症监护病房行“镇静镇痛、控制体温、抗炎、营养神经”治疗。术后根据ICP 监测指导脱水剂的使用,总计甘露醇使用剂量540 g,使用时间8 d,ICP监测持续时间5 d,未发生术后再出血及颅内感染,术后3 个月时GOS 评分为中残。
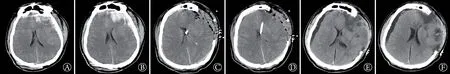
图1 重型TBI患者应用改良Paine点行去骨瓣减压术脑室内ICP探头置入的CT图像Fig.1 CT images of typical cases of intraventricular ICP probe placement during decompressive craniectomy through modified Paine point in a patient with severe TBI
3 讨 论
重型TBI 约占所有TBI 的10%,但在TBI 相关的死亡、残疾和费用中所占比例较高。重型TBI 患者死亡多与ICP升高有关[18]。因此,目前ICP监测在重型TBI 治疗中的应用较为广泛,已得到多数神经外科医师的认同,我国及美国TBI救治指南及ICP监测专家共识均推荐其用于指导重型TBI 患者的治疗[19-20]。DC 术可有效缓解重型TBI 后高颅压,使ICP下降,改善脑供血及脑氧合[21],但术后患者ICP常有反弹的现象,其主要原因可能为在开颅手术后脑部血液循环通路重新建立导致脑血管床扩张、充血,也可能由于术后血肿复发、新血肿形成或脑水肿等因素,引发ICP增高。这种反复出现的ICP增高如未及时发现、处理,会显著增高患者术后的残疾率和病死率[22]。传统方法采用观察患者临床症状、手触摸减压窗张力和CT扫描对ICP进行评价,难以及时、有效地反映ICP 的变化情况。因此对准备行DC 术的重型TBI 患者,如评估术后可能发生ICP 增高,可进行术中ICP 监测。中国台湾高雄长庚医院的Huang 等[6]回顾性分析该院接受DC 术的重型TBI患者187 例,Kaplan-Meier 生存曲线分析显示,ICP监测组明显优于非ICP 监测组,表明DC 术后实施ICP监测可降低患者住院病死率,建议对重型TBI常规使用ICP监测。
目前,有创ICP 监测的手段包括硬膜内、硬膜外、脑实质、脑室等部位置入探头,其中基于脑室外引流的脑室内ICP 监测被认为是金标准,是相对可靠、经济、准确的ICP 监测方法,能通过引流脑脊液来实现降低ICP的目的[23]。在重型TBI行DC术中,传统使用对侧切口颅骨钻孔经Kocher 点穿刺实现脑室ICP 探头置入术,此类方法操作简单,但颅内感染率较高,且有一定的出血率[8]。既往研究报道,传统脑室内ICP监测颅内感染率为0~27%,出血并发症发生率为0.7%~41%,极少数患者出血需手术干预[24]。自Park等发布改良Paine点穿刺法以来,其广泛应用于开颅动脉瘤夹闭术中,通过引流脑脊液降低ICP,有利于手术空间显露、减轻脑组织损伤[25]。本研究基于改善传统脑室内ICP 监测的高并发症,采用改良Paine 点穿刺实现脑室ICP 探头置入术,探讨其在重型TBI患者DC术中的可行性。与传统DC 对侧切口颅骨钻孔经Kocher 点穿刺对比,其优势体现在:(1)手术用时短,应用改良Paine 点在常规DC 术的骨窗范围内即可进行侧脑室穿刺,可减少因扩大或另做切口造成的手术时间延长。(2)降低穿刺出血率,穿刺出血是脑室穿刺手术的严重并发症之一[26],多次穿刺脑室为并发穿刺出血的主要危险因素[27],传统Kocher 点颅骨钻孔仅依赖头皮体表标志进行盲穿,成功与否与术者经验、技巧密切相关。重型TBI 患者术前多存在中线偏移,脑室变形移位,穿刺点、穿刺深度、穿刺方向均存在个体差异,Kocher点置管难以精确控制穿刺方向和深度,易发生穿刺偏斜、过深、损伤脑组织等,导致穿刺失败。据报道Kocher 点穿刺行脑室探头置入发生导管错位率达4%~20%[23],而多次穿刺重新置管易导致穿刺路径脑组织损伤,甚至继发术后再出血[28]。改良Paine点根据术中脑组织结构定位,于侧脑室额角外侧刺入且穿刺方向与侧脑室额角长轴一致,不易受脑室变形、移位的影响[14],故术中穿刺成功率较高,可避免多次穿刺脑损伤出血。(3)颅内感染率降低,Dimitriou 等[29]的研究显示,颅内感染的发生与探头反复置入、监测持续时间有关;Lozier 等[30]认为,脑室外引流并发颅内感染的主要危险因素为脑脊液漏,其次与探头留置时间、脑室冲洗等有关。本研究中两组ICP 监测持续时间无统计学差异。表明传统Kocher点穿刺导管错位率高,探头反复置入,引流管易被脑组织或穿刺出血血凝块堵塞,需通过冲洗来保持引流管通畅,而引流管堵塞和引流管反复冲洗是脑室内ICP 监测感染相关的危险因素[23];另外,传统DC 对侧切口颅骨钻孔Kocher 点穿刺术中切开脑膜,置管成功后无法严密修补脑膜,术后ICP 较高时脑脊液可通过脑膜切口渗入皮下易发生脑脊液漏,而应用改良Paine点穿刺无需增加脑膜切口,术后可严密缝合脑膜,有利于降低脑脊液漏发生率。
ICP监测可准确掌握重型TBI的ICP变化,进而根据ICP 波动情况来实时调节脱水剂的用时、用量[31]。甘露醇是目前应用广泛的治疗脑水肿、降低ICP 水平的药物。本研究中,观察组与对照组甘露醇的应用剂量及时间无统计学差异,提示在重型TBI 患者DC 术中应用改良Paine 点行脑室内ICP 监测,同样能发挥传统脑室ICP 监测指导术后治疗的作用,从而避免甘露醇给患者带来的心、肾不良反应及水、电解质失衡等并发症。
作为一种有创ICP 监测技术,应用改良Paine 点脑室ICP 监测的安全性尚不明确。目前认为,早期Paine 点穿刺部位有接近Broca 语言功能区、损伤尾状核的风险[32]。本研究利用患者术后3 个月的GOS评分评估不同脑室ICP穿刺对重型TBI患者神经功能预后的影响,结果显示,与传统DC 对侧切口颅骨钻孔Kocher 点比较,应用改良Paine 点行脑室ICP 监测的患者预后良好率或预后不良率差异均无统计学意义。这是因为,改良Paine 点定位点较早期Paine点更远离Broca区,在该点穿刺可提供从尾状核及胼胝体之间进入脑室的路径[32],有利于减轻Broca语言功能区及尾状核头部的损伤[13],因此是安全可靠的。另外,与传统Kocher点脑室ICP监测相比,DC术中应用改良Paine 点行脑室ICP 监测也未增高患者的病死率。
综上所述,重型TBI 患者DC 术中行脑室内ICP监测,应用改良Paine 点穿刺与传统DC 对侧切口颅骨钻孔经Kocher 点穿刺可同样发挥脑室内ICP 监测指导脱水剂使用的作用,更重要的是其可缩短手术用时,降低术后再出血率及导管相关颅内感染率,且不增加患者的不良预后,是可靠的手术方式,值得基层医院推广。
