灵芝miRNA对人皮肤成纤维细胞衰老的作用研究
2024-03-24余雯斌徐晓渊盛清
余雯斌 徐晓渊 盛清


摘要: 为探究灵芝中miRNA对细胞衰老的干预作用及影响,利用过氧化氢(H2O2)诱导人皮肤成纤维细胞(Human skin fibroblasts,HSF)構建了细胞衰老模型,将灵芝特有的miRNA Glu-miR-01和Glu-miR-03转染HSF衰老细胞,分析细胞衰老相关氧化应激指标,并通过Western blotting检测衰老相关蛋白表达水平的变化。结果显示:构建HSF细胞衰老模型的最适条件为H2O2浓度0.8 mmol/L,诱导时间3 h;Glu-miR-01和Glu-miR-03均能促使衰老细胞中超氧化物歧化酶(Superoxide dismutase,SOD)和总抗氧化能力(Total antioxidant capacity, T-AOC)水平上升,丙二醛(Malondialdehyde,MDA )含量下降,细胞衰老相关β-半乳糖苷酶(Senescence associated-β-Galactosidase,SA-β-gal)染色阳性率降低,线粒体膜电位升高;衰老信号通路中P53、P21和P16蛋白的表达显著降低,Rb蛋白表达显著升高。该结果表明灵芝中Glu-miR-01和Glu-miR-03对HSF衰老细胞具有保护作用,并对衰老相关的p53/p21/Rb信号通路具有调控作用,为阐明灵芝miRNA对细胞衰老的分子作用机制提供了理论依据。
关键词: 灵芝;miRNA;过氧化氢;氧化应激;细胞衰老;p53/p21/Rb信号通路
中图分类号: Q936
文献标志码: A
文章编号: 1673-3851 (2024) 01-0120-10
引文格式:余雯斌,徐晓渊,盛清. 灵芝miRNA对人皮肤成纤维细胞衰老的作用研究[J]. 浙江理工大学学报(自然科学),2024,51(1):120-129.
Reference Format: YU Wenbin,XU Xiaoyuan,SHENG Qing. Effect of Ganoderma lucidum miRNA on the senescence of human skin fibroblasts[J]. Journal of Zhejiang Sci-Tech University,2024,51(1):120-129.
Effect of Ganoderma lucidum miRNA on the senescence of human skin
fibroblasts
YU Wenbin,XU Xiaoyuan,SHENG Qing
(College of Life Sciences and Medicine, Zhejiang Sci-Tech University, Hangzhou 310018, China)
Abstract: To investigate the intervention effect and impact of miRNA in Ganoderma lucidum (G. lucidum) on cell aging, we used hydrogen peroxide (H2O2) to induce human skin fibroblasts (HSF) and constructed a cell senescence model. The HSF senescent cells were transfected with miRNA Glu-miR-01 and Glu-miR-03, which were unique to G. lucidum, and the oxidative stress indexes related to cell aging were analyzed. The change of the expression levels of age-related proteins was detected by Western blotting. The results indicated that the optimal conditions for establishing the HSF cell senescence model were 0.8 mmol/L H2O2 and 3 h induction time. Both Glu-miR-01 and Glu-miR-03 could enhance the activity of superoxide dismutase (SOD) and total antioxidant capacity(T-AOC), reduce the content of malondialdehyde (MDA), decrease the positive rate of senescence-β-galactosidase (SA-β-gal) staining and increase mitochondrial membrane potential in senescence cells. In the aging signaling pathway, the expression of P53, P21 and P16 proteins was significantly downregulated, while the expression of Rb protein was significantly upregulated. These findings suggest that Glu-miR-01 and Glu-miR-03 from G. lucidum exert protective effects on HSF senescent cells, and regulate the p53/p21/Rb signaling pathway associated with aging. This provides a theoretical basis for elucidating the molecular mechanism of G. lucidum miRNA on cell senescence.
Key words: Ganoderma lucidum; miRNA; hydrogen peroxide; oxidative stress; cell senescence; p53/p21/Rb signaling pathway
0引言
灵芝(Ganoderma lucidum)是一种大型药用真菌,担子菌纲多孔菌科灵芝属[1]。灵芝作为药食同源的传统中药已有两千多年的历史,具有滋补强壮、延年益寿等功效,对多种不同疾病都有有益作用[2]。目前,对灵芝发挥药效的物质基础和作用机理研究主要集中在灵芝多糖、灵芝三萜及部分甾醇类物质等领域[3-5],而对其核酸、蛋白质等初级代谢产物尤其是各种RNA的活性研究相对较少[6-10]。microRNA(miRNA)是一类含有18~25个核苷酸的非编码小RNA(Non-coding small RNA),在动植物和微生物中普遍存在,能够调控特定基因的转录后表达,在细胞增殖、分化和衰老等过程中起着重要的作用[11]。研究发现,miRNA参与不同细胞类型和环境老化过程,可作为重要的衰老生物学标志物[12];miR-126等25种外泌体miRNA对血管细胞增殖、迁移、凋亡、炎症和分化等衰老相关功能具有调控作用[13]。miRNA通过p53/p21/Rb通路、p16-pRb通路、PI3K/AKT/mTOR通路和SIRT1通路等多个与细胞衰老相关的信号通路参与细胞衰老的生物过程[14-15]。在衰老过程中,miRNA的表达改变与包括癌症和心血管疾病在内的衰老性疾病有关,使用miRNA的治疗方法将促进衰老相关疾病的治疗或预防[16-17]。
2012年,Zhang等[18]首次发现,植物miRNA可以通过口服摄入调控人体内的基因表达;自此以来,越来越多的证据表明,外源miRNA可以调控动物体内相关基因的表达,发挥重要的生物学作用[19]。通过连续灌胃可显著增加小鼠外周血和肺中金银花miR2911的表达量,且合成的 miR2911 模拟物能显著抑制H1N1 病毒的复制[20];红景天煎煮液中的miRNA在体内和体外实验中均表现出较强的抗纤维化作用等[21]。Huang等[22]在对10种草药的研究中发现,每种草药中有大量小RNA能够进入哺乳动物的血液和肺部,能以序列特异性的方式对哺乳动物基因进行跨界调控。
灵芝具有极高的药用价值,是延缓衰老的珍品[23];《神农本草经》记载,灵芝“久服轻身不老,延年神仙”[24]。现代药理研究表明,灵芝多种活性成分具有延缓衰老的作用[25],但其延缓衰老的分子机制尚有待进一步阐明。中药miRNA可以发挥跨界调控作用,那么灵芝中的miRNA对衰老会有怎样的作用和影响?Li等[26]首次报道了灵芝miRNA的鉴定研究,从灵芝子实体中分离并确证了132个已知miRNA和34个灵芝特有的miRNA;靶基因预测发现,灵芝中的miRNA针对人生命过程的靶基因多达111个,多数miRNA具有不止一个靶基因,或一个靶基因可以受多个miRNA调控,而丰度较高的灵芝特有miRNA Glu-miR-01、Glu-miR-03能够靶向与衰老相关信号通路中的关键基因。
本文研究灵芝特有miRNA Glu-miR-01,Glu-miR-03对细胞衰老的作用。通过探究灵芝miRNA模拟物(miRNA mimics)对过氧化氢(H2O2)诱导的人皮肤成纤维细胞衰老的作用,检测其对细胞衰老相关指标的变化、衰老相关通路关键蛋白的表达水平的影响等,探明灵芝miRNA作为灵芝新活性成分对延缓细胞衰老的作用及机制,为阐明灵芝miRNA跨界调控的分子机制奠定基础。
1实验部分
1.1材料
1.1.1细胞
人皮肤成纤维HSF细胞(美国模式培养物集存库,ATCC)。
1.1.2miRNA模拟物
Glu-miR-01模拟物(Glu-miR-01 mimics)、Glu-miR-03模拟物(Glu-miR-03 mimics)和阴性对照(Negative control)(上海吉玛制药技术有限公司)按表1中序列制备。
1.1.3试剂
3%过氧化氢(H2O2)、噻唑蓝(MTT)、二甲基亚砜(DMSO)和胰酶(Trypsin)(美国Sigma公司),DMEM高糖培养基、双抗(青霉素、链霉素)和PBS(维森特生物技术(南京)有限公司),超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒和总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所),胎牛血清(美国Gibco公司),细胞衰老相关β-半乳糖苷酶(SA-β-gal)染色试剂盒、线粒体膜电位(JC-1)检测试剂盒(上海碧云天生物技术有限公司),ECL显色液(美国Advansta公司),LipofectamineTM3000转染试剂(美国Thermo Fisher Scientific公司),SDS-PAGE凝胶快速制备试剂盒(上海雅酶生物医药科技有限公司)。
1.1.4抗体
p53(DO-1)抗体(1∶500)、p16INK4a(JC8)抗体(美国Santa Cruz公司,1∶500),p21Waf1/Cip1(DCS60)抗体(1∶2000)、Rb(4H1)抗体(美国Cell Signaling Technology公司,1∶2000),α-tubulin抗體(1∶5000)和羊抗兔IgG(HRP标记,美国Proteintech公司,1∶5000)。
1.2HSF细胞衰老模型的构建
采用H2O2诱导HSF细胞的方法构建氧化应激导致的HSF细胞衰老模型,具体参见文献[27]。将HSF细胞铺板过夜,设置H2O2浓度梯度为0.2、0.4、0.6、0.8、1.0 mmol/L和1.2 mmol/L,H2O2诱导的时间梯度为3、6、12 h和24 h,对 HSF 细胞进行 H2O2 诱导;经不同浓度、不同时间诱导后,观察细胞形态的改变,采用MTT实验检测细胞活力的变化,以确定H2O2最适浓度与诱导时间;收集细胞后检测SOD、MDA和T-AOC等氧化应激指标的变化,以确定HSF细胞衰老模型的成功构建。
1.3细胞中灵芝miRNA表达量的检测
将灵芝miRNA mimics转染HSF细胞后,收集细胞,提取细胞总RNA,以总RNA为模板,使用特异性茎环引物,将RNA 逆转录成cDNA。快速启动通用SYBR Green Master的RT-qPCR程序,程序设置为:95 ℃处理10 min,然后95 ℃处理15 s,随后转为60 ℃处理15 s,最后72 ℃处理30 s,共40个循环,以人源5.8 S 为内参检测miRNA的相对表达量。茎环引物和反转录引物序列见表2。使用ABI 7500 Software(V2.3)软件进行数据分析。
1.4灵芝miRNA对衰老细胞活力影响的检测
采用MTT法评价Glu-miR-01和Glu-miR-03对H2O2诱导的HSF衰老细胞的活力影响。将HSF细胞接种于96孔板中,细胞密度为2.5×104/孔。用质量浓度为0.75、3.5 μg/mL和7.5 μg/mL的Glu-miR-01 mimics、Glu-miR-03 mimics和对应阴性对照,分别转染HSF细胞,每个浓度6个复孔。参照LipofectamineTM 3000转染试剂说明书操作:取HSF细胞,弃去旧培养基,每孔加入2 mL无血清DMEM培养基。将转染试剂、Glu-miR-01 mimics、Glu-miR-03 mimics以及阴性对照分别用无血清DMEM培养液按说明书比例稀释混匀。将稀释后的转染试剂分别与已稀释的Glu-miR-01 mimics/Glu-miR-03 mimics/阴性对照按照1∶1比例混匀。室温静置孵育15~20 min。将孵育充分的混合物分别加入设定孔中,继续培养24 h后更换培养基,每孔加入200 μL含有0.8 mmol/L H2O2的培养基;诱导3 h后吸去培养基,再加入浓度为5 mg/mL的20 μL MTT溶液,在CO2培养箱中于37 ℃孵育4 h后加入150 μL DMSO溶液,摇匀,待结晶充分溶解后,使用酶标仪于波长570 nm处测定每个孔的吸光度值(OD)。细胞活力(Cell viability, CV)计算如式(1)所示:
CV/%=OD实验OD对照×100(1)
其中:CV为细胞存活率,%;OD实验为实验组在570 nm处的吸光度;OD对照为对照组570 nm处的吸光度。
1.5衰老相关氧化应激指标和细胞SA-β-gal的检测
氧化应激相关细胞衰老的特征性指标主要包括SOD、MDA和T-AOC等[28]。SOD是生物体内清除超氧阴离子自由基的一种重要的抗氧化酶,可以保护氧自由基机体免受氧自由基的损害;MDA是脂质与氧自由基形成的产物之一,其含量代表脂质过氧化的程度;T-AOC是指各种抗氧化物质和抗氧化酶等构成的总抗氧化水平,用于评价生物活性物质的抗氧化能力。选择培养的HSF细胞接种于6孔板,使每孔细胞密度为 1×106个,分为0.8 mmol/L H2O2诱导的模型组、实验组即0.8 mmol/L H2O2诱导+转染Glu-miR-01 mimics(Glu-miR-03 mimics)的Glu-miR-01组(Glu-miR-03组)、0.8 mmol/L H2O2诱导+转染阴性对照的阴性对照组,在转染miRNA mimics 24 h后,吸去旧培养基,每组都分别加入1 mL含有0.8 mmol/L H2O2的DMEM培养基,培养3 h后收集细胞,进行SOD、MDA和T-AOC等氧化应激相关指标检测。
细胞衰老相关β-半乳糖苷酶(SA-β-gal)是检测细胞衰老的常用指标,利用衰老细胞中SA-β-gal活性水平上升进行细胞染色[29]。正常细胞中仅观察到零星的SA-β-gal阳性细胞;研究发现,长时间暴露于H2O2可导致细胞过早衰老,表现为细胞增殖受到抑制,SA-β-gal染色增强[30]。细胞衰老相关SA-β-gal的检测参照以上分组并按照试剂说明书进行。
1.6细胞线粒体膜电位的检测
线粒体膜电位(ΔΨm)用于评估线粒体的活力,线粒体膜电位ΔΨm的变化反映细胞衰老变化。荧光探针JC-1可用于检测线粒体膜电位ΔΨm,细胞活力强时,ΔΨm较高,呈现红色荧光,而ΔΨm较低时呈绿色荧光,提示细胞衰老凋亡[29]。选择培养的HSF细胞接种于6孔板,使每孔细胞密度为 1×106个,分为正常细胞的正常组、0.8 mmol/L H2O2诱导的模型组、实验组即0.8 mmol/L H2O2诱导+转染Glu-miR-01 mimics(Glu-miR-03 mimics)的Glu-miR-01(Glu-miR-03)组、0.8 mmol/L H2O2诱导+转染阴性对照的阴性对照组,在转染miRNA mimics 24 h后,弃去旧培养基,除正常组外分别加入含有0.8 mmol/L浓度H2O2的DMEM培养基,培养3 h后使用线粒体膜电位试剂盒检测每组细胞的线粒体膜电位ΔΨm变化。
1.7细胞中蛋白质表达量的检测(Western blotting)
细胞衰老的作用机制包括p53、p21Cip1/Waf1、p16INK4a等衰老相关分子标志物的调控,以及Rb蛋白的磷酸化状态(pRb /tRb)等[31]。p53受到DNA損伤和端粒侵蚀的刺激,导致P21表达增加,Rb蛋白去磷酸化,最终导致细胞复制性衰老[32]。P53的失活则促进衰老细胞的增殖,而P21缺乏则延缓衰老过程,提示p53/p21/Rb通路可能是调控细胞衰老的主要途径之一。选择在培养的HSF细胞,将Glu-miR-01 mimics和Glu-miR-03 mimics转染至细胞中,24 h后加入0.8 mmol/L H2O2诱导细胞,3 h后收集细胞。用细胞裂解液提取总蛋白。采用 SDS-PAGE分离总蛋白,用免疫印迹法将总蛋白转移到PVDF膜上。用5%脱脂牛奶与吐温(pH 7.4)在室温下封闭2 h后,用p53抗体、p16INK4A抗体、p21Waf1/Cip1抗体、Rb抗体在4 ℃过夜孵育,以羊抗兔IgG(HRP标记)作为二抗,使用ECL显色液检测蛋白表达。
1.8统计分析
所有数据都是以平均值±SD表示3个独立实验的平均值,采用GraphPad Prism 6.0软件进行单因素方差A检验和LSD检验。当p值<0.05时,差异显著。
2结果与讨论
2.1H2O2诱导HSF细胞衰老模型的细胞活力变化
细胞衰老是由细胞内氧自由基堆积产生导致[33],正常有氧代谢产生的活性氧(Reactive oxygen species,ROS)对生物分子造成损害,并最终导致组织功能下降和衰老[34]。氧化应激导致的细胞衰老一直被视为衰老研究中经典的体外模型,H2O2是产生ROS的主要成分,H2O2诱导产生的氧化应激可引起人体皮肤成纤维细胞氧化损伤[35]。图1为不同浓度H2O2诱导下HSF细胞的活力变化。图1表明:当H2O2的浓度大于等于1.0 mmol/L时,经3 h诱导后细胞存活率CV约为50%,但经6 h以上诱导后,细胞存活率CV逐渐降低至20%以下,细胞大多数已经死亡。通过比较,最终选择0.8 mmol/L为最适浓度,3 h为最适作用时间,确定为H2O2诱导氧化应激构建细胞衰老模型的最适条件。
2.2HSF细胞衰老模型中氧化应激指标的变化
图2为H2O2刺激下HSF细胞内各氧化应激指标含量的变化。由图2可知,相比于正常细胞組,在0.8 mmol/L H2O2诱导3 h的模型组中,SOD和T-AOC的水平显著降低(p<0.01),而MDA含量相对于正常组显著增加(p<0.05)。这些氧化应激指标的显著改变,表明采用0.8 mmol/L H2O2、处理3 h的条件进行诱导的HSF细胞衰老模型构建成功,可用于后续实验。
2.3灵芝miRNA在HSF细胞中的转染效率
因为阴性对照组带有荧光标记(FAM),并且其核酸结构与合成的miRNA mimics相似,所以其荧光强度可以近似反映出Glu-miRNA的转染效率,图3为转染miRNA mimics 后细胞荧光强度,以及Glu-miR-01和Glu-miR-03在HSF细胞中的相对表达水平,由图3(a)—(b)可知,Glu-miRNA的转染效率相对较高;如图3(c)—(d) 相对表达水平检测实验结果显示,相比于对照组,实验组中Glu-miR-01 和Glu-miR-03表达水平都有显著升高,表明HSF细胞中Gas-miR-01 和Glu-miR-03都有较高的转染效率。
2.4灵芝miRNA对HSF衰老细胞活力的影响
为了探究转染灵芝miRNA对HSF细胞模型的影响是否具有剂量依赖性,在转染不同浓度miRNA mimics后,对H2O2诱导的HSF细胞模型细胞活力的变化进行检测。结果如图4所示。由图4可知,相比于只有正常细胞的正常组,模型组的HSF细胞由于一定浓度H2O2的诱导,细胞存活率CV明显下降至正常组的50%~60%;而转染灵芝miRNA mimics实验组相比于模型组的细胞存活率明显升高,并且不同浓度的Glu-miR-01mimics组细胞存活率CV显著高于阴性对照组(p<0.01);Glu-miR-03组具有相似的作用效果(p<0.05),说明转染的灵芝miRNA mimics可以逆转HSF的细胞活力,而跟剂量无关。
2.5灵芝miRNA对HSF衰老细胞中氧化应激指标和衰老细胞SA-β-gal生成的影响
图5和图6分别为Glu-miR-01、 Glu-miR-03对H2O2诱导的HSF细胞模型各个氧化应激指标的影响结果。图5表明:相较于H2O2诱导后HSF细胞的SOD和T-AOC活性降低,MDA含量升高,转染了灵芝miRNA mimics的HSF衰老细胞相应氧化应激指标发生了逆转。转染Glu-miR-01 mimics组SOD活力相对于只加入H2O2诱导的模型组显著升高(p<0.01),而MDA含量显著降低(p<0.01),T-AOC则明显上升(p<0.05)。由图6可知:Glu-miR-03 与 Glu-miR-01 具有一致的作用效果,SOD、MDA和 T-AOC 的变化亦呈显著性差异(p<0.05)。
SA-β-gal活性变化结果如图7所示。由图7可知:H2O2诱导的模型组中SA-β-gal染色阳性细胞显著增加,而转染Glu-miR-01 mimics和转染Glu-miR-03 mimics的HSF衰老细胞中SA-β-gal阳性占比均明显低于模型组。这说明灵芝特异miRNA对缓解HSF细胞衰老具有一定作用。
2.6灵芝miRNA对HSF衰老细胞中线粒体膜电位ΔΨm的影响
图8为灵芝miRNA对HSF细胞衰老模型中线粒体膜电位ΔΨm的影响结果。图8表明,正常细胞中,红色占比较高,而经H2O2处理的HSF中绿色荧光占比增加,表明衰老细胞增加,活力减弱,而经Glu-miR-01 mimics和Glu-miR-03 mimics分别处理HSF衰老细胞后,红色荧光增加,相比于模型组具有显著差异(p<0.05),表明灵芝miRNA mimics 逆转了HSF衰老细胞的线粒体活力。
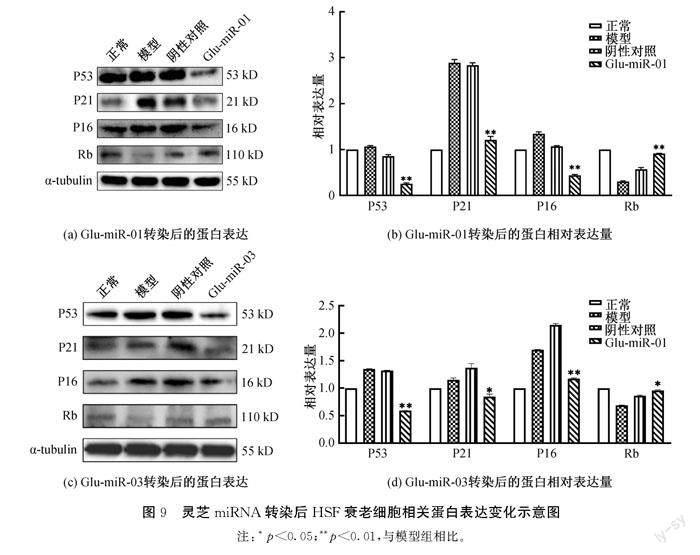
2.7灵芝miRNA对HSF衰老细胞中p53/p21/Rb信号通路的作用
越来越多的研究[14]证实,miRNAs可以参与衰老相关的信号通路如p53/p21/Rb通路的调节。因此,本文探究了灵芝miRNA对HSF衰老细胞中p53/p21/Rb信号通路相关蛋白的作用影响。图9为灵芝miRNA对H2O2诱导的HSF细胞衰老模型中p53/p21/Rb信号通路上相关蛋白表达水平的影响结果。图9表明:通过H2O2诱导的HSF衰老细胞所在模型相比于正常细胞组,P53、P21以及P16蛋白水平升高,Rb蛋白水平降低;转染灵芝Glu-miR-01后,各蛋白表达水平发生了改变;相比于模型组,P53、P21和P16蛋白水平明显下降,Rb蛋白水平显著上升,结果由图9(a)—(b)所示。转染Glu-miR-03的结果与之一致,结果如图9(c)—(d)所示。以上结果表明,灵芝miRNA mimics对衰老相关p53/p21/Rb信号通路的关键蛋白具有调控作用,提示灵芝特异miRNA可能通过调控p53/p21/Rb信号通路延缓HSF细胞衰老。
3结论
衰老是生命体发展必然的过程。氧化应激和氧自由基的堆积参与了衰老的发生发展,与衰老相关的信号通路有着密切的关系。本文探究了以延缓衰老著称的中药灵芝中特异miRNA对细胞衰老的作用及影响,主要结论如下:
a)灵芝特异Glu-miR-01和Glu-miR-03能够使HSF衰老细胞的SOD和T-AOC水平上升,MDA含量下降,并且能减少SA-β-gal阳性细胞的生成,提高衰老细胞的线粒体膜电位,从而增强细胞的抗氧化能力,对衰老细胞具有积极的修复作用。
b)灵芝Glu-miR-01和Glu-miR-03都能下调HSF衰老细胞中p53/p21/Rb信号通路上的关键蛋白P53、P21、P16表达,上调Rb蛋白的表达,证明灵芝Glu-miR-01和Glu-miR-03对衰老细胞的p53/p21/Rb信号通路具有调控作用。本文为阐明灵芝特异miRNA对延缓衰老的作用机制提供了理论依据,为进一步研究灵芝miRNA跨界调控的分子机制奠定了基础。
参考文献:
[1]Lindequist U, Rausch R, Füssel A, et al. Higher fungi in traditional and modern medicine[J]. Medizinische Monatsschrift Für Pharmazeuten, 2010, 33(2): 40-48.
[2]Sliva D. Cellular and physiological effects of Ganoderma lucidum (Reishi) [J]. Mini Reviews in Medicinal Chemistry, 2004,4(8):873-879.
[3]江艳, 王浩, 吕龙, 等. 灵芝孢子粉多糖Lzps-1的化学研究及其总多糖的抗肿瘤活性[J].药学学报, 2005,40(4):347-350.
[4]Zhang H, Li W J, Nie S P, et al. Structural characterisation of a novel bioactive polysaccharide from Ganoderma atrum[J].Carbohydrate Polymers, 2012,88(3):1047-1054.
[5]Liu Y W, Gao J L, Guan J, et al. Evaluation of antiproliferative activities and action mechanisms of extracts from two species of Ganoderma on tumor cell lines[J].Journal of Agricultural and Food Chemistry, 2009,57(8):3087-3093.
[6]Min B S, Gao J J, Nakamura N, et al. Triterpenes from the spores of ganoderma lucidum and their cytotoxicity against meth-A and LLC tumor cells[J].Chemical & Pharmaceutical Bulletin, 2000,48(7):1026-1033.
[7]陳若芸, 于德泉. 用二维核磁共振技术研究赤芝孢子内酯A和B的结构[J].药学学报, 1991,26(6):430-436.
[8]陈若芸, 于德泉. 赤芝孢子粉三萜化学成分研究[J]. 药学学报, 1991,26(4):267-273.
[9]Min B S, Gao J J, Hattori M, et al. Anticomplement activity of terpenoids from the spores of ganoderma lucidum[J]. Planta Medica, 2001,67(9):811-814.
[10]侯翠英, 孙义廷, 杨琳, 等. 灵芝(赤芝孢子粉)化学成分的研究再报[J]. Journal of Integrative Plant Biology, 1988,30(1):66-70.
[11]Martinez I, Almstead L L, DiMaio D. microRNAs and senescence[J]. Aging, 2011,3(2):77-78.
[12]Hooten N N, Fitzpatrick M, Wood W H, et al. Age-related changes in microRNA levels in serum[J]. Aging, 2013,5(10):725-740.
[13]Du S S, Ling H, Guo Z Y, et al. Roles of exosomal miRNA in vascular aging[J]. Pharmacological Research, 2021, 165: 105278.
[14]荆霞, 熊兴东, 刘新光.miRNAs与细胞衰老相关的信号通路[J].中国生物化学与分子生物学报, 2013,29(5):412-418.
[15]Zeng X L, Yang X N, Liu X J. Resveratrol attenuates cigarette smoke extract induced cellular senescence in human airway epithelial cells by regulating the miR-34a/SIRT1/NF-κB pathway[J].Medicine, 2022, 101(46): e31944.
[16]Li W G, Chen L N, Li W, et al. Unraveling the characteristics of microRNA regulation in the developmental and aging process of the human brain[J]. BMC Medical Genomics, 2013, 6: 55.
[17]Hodzic M, Naaldijk Y, Stolzing A. Regulating aging in adult stem cells with microRNA[J]. Zeitschrift Für Gerontologie Und Geriatrie, 2013,46(7):629-634.
[18]Zhang L, Hou D X, Chen X, et al. Exogenous plant MIR168a specifically targets mammalian LDLRAP1: evidence of cross-Kingdom regulation by microRNA[J]. Cell Research, 2012,22(1):107-126.
[19]Luo Y, Wang P J, Wang X, et al. Detection of dietetically absorbed maize-derived microRNAs in pigs[J]. Scientific Reports, 2017, 7: 645.
[20]Zhou Z, Li X H, Liu J X, et al. Honeysuckle-encoded atypical microRNA2911 directly targets influenza A viruses[J]. Cell Research, 2015, 25(1): 39-49.
[21]Du J C, Liang Z, Xu J T, et al. Plant-derived phosphocholine facilitates cellular uptake of anti-pulmonary fibrotic HJT-sRNA-m7[J]. Science China Life Sciences, 2019,62(3):309-320.
[22]Huang F M, Du J C, Liang Z, et al. Large-scale analysis of small RNAs derived from traditional Chinese herbs in human tissues[J]. Science China Life Sciences, 2019, 62(3): 321-332.
[23]Chiu H F, Fu H Y, Lu Y Y. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: a randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers[J]. Pharmaceutical Biology, 2017,55(1):1041-1046.
[24]林志彬. 靈芝的抗衰老与抗阿尔茨海默病的药理研究进展[J]. 神经药理学报, 2018,8(1):9-15.
[25]张欣蕾, 王家传, 赵红. 中医药抗衰老的研究进展[J]. 深圳中西医结合杂志, 2023,33(2):129-133.
[26]Li B, Cheng X S, Zhang T, et al. The identification of microRNAs in Ganoderma lingzhi sporocarp[J]. Mycoscience, 2016, 57(4): 271-278.
[27]潘长伟, 赵峰, 郎宏鑫,等. 过氧化氢诱导人皮肤成纤维细胞衰老模型的建立[J]. 解剖科学进展, 2019, 25(2): 193-195, 199.
[28]Zhu Y, Han Y P, Wang W Y, et al. Mulberry leaves attenuate D-galactose-induced aging in vivo and in vitro[J]. Journal of Ethnopharmacology, 2023, 311: 116286.
[29]曹娟, 李玲玲, 姚瑶, 等. 氧化应激相关细胞衰老指标与骨关节炎的相关性探讨[J]. 中华全科医学, 2023,21(3):396-400.
[30]Dimozi A, Mavrogonatou E, Sklirou A, et al. Oxidative stress inhibits the proliferation, induces premature senescence and promotes a catabolic phenotype in human nucleus pulposus intervertebral disc cells[J]. European Cells & Materials, 2015, 30: 89-102;discussion103.
[31]Campisi J, d′Adda di Fagagna F. Cellular senescence: when bad things happen to good cells[J]. Nature Reviews Molecular Cell Biology, 2007,8(9):729-740.
[32]Feng C C, Yang M H, Zhang Y, et al. Cyclic mechanical tension reinforces DNA damage and activates the p53-p21-Rb pathway to induce premature senescence of nucleus pulposus cells[J]. International Journal of Molecular Medicine, 2018,41(6):3316-3326.
[33]Beausjour C M, Krtolica A, Galimi F, et al. Reversal of human cellular senescence: roles of the p53 and p16 pathways[J]. The EMBO Journal, 2003,22(16):4212-4222.
[34]Copeland J L. Exercise in older adults: the effect of age on exercise endocrinology[M].Endocrinology of Physical Activity and Sport. Totowa, NJ: Humana Press, 2013: 437-460.
[35]Haan J B D, Bladier C, Lotfi-Miri M, et al. Fibroblasts derived from Gpx1 knockout mice display senescent-like features and are susceptible to H2O2-mediated cell death[J].Free Radical Biology and Medicine, 2004,36(1):53-64.
(責任编辑:张会巍)
收稿日期: 2023-05-29网络出版日期:2023-07-14网络出版日期
基金项目: 浙江省基础公益研究计划项目(LGF18H250004)
作者简介: 余雯斌(1995—),男,杭州人,硕士研究生,主要从事中药分子药理方面的研究。
通信作者: 盛清,E-mail:csheng@zstu.edu.cn
