MicroRNA检测方法研究进展
2024-03-23李文娜彭伟盼
李文娜,秦 怡,彭伟盼
(天津大学生命科学学院,天津 300072)
0 引 言
MicroRNA(miRNA)是一类大约19 ~24 个核苷酸的非编码小RNA,通过与目标mRNA 的3’-UTR 结合而抑制蛋白质的翻译。研究发现,miRNA 可直接与蛋白质相互作用,调节基因表达或影响表观遗传机制[1]。研究表明,miRNA的异常表达与多种癌症(例如乳腺癌、肺癌及口腔癌等)的发生发展密切相关,可作为一种非侵入理想的生物标志物用于肿瘤等疾病的检测[2]。然而,miRNA具有序列短、同源性高及易降解等特点,实现其精准检测具有较大挑战性[3]。因此,在过去的几十年里,研究者投入了大量精力开发miRNA 检测方法[4]。目前,miRNA 检测技术可分为两类:传统检测与新型检测方法。其中,传统miRNA检测方法主要包括印迹杂交(Northern blot)技术[5,6]、微阵列分析技术[7,8]和定量聚合酶链反应(polymerase chain reaction,PCR)技术[5,9,10]。为了进一步提高检测的灵敏度和特异性,新型miRNA生物传感器往往依赖于信号放大策略,如基于纳米粒子的信号放大[11,12]及等温核酸扩增技术的信号放大[13,14]等技术。基于此,本文围绕传统检测方法与新型检测方法两个方面,总结miRNA检测方法的研究成果,并讨论了其在改进miRNA生物传感器设计方面的优势与局限性,最后,提出miRNA检测技术未来的发展趋势。
1 传统miRNA检测方法
传统miRNA检测方法主要包括Northern blot 技术、微阵列分析技术和qPCR技术。
Northern blot技术:该技术不仅可用于成熟miRNA 检测,还可用于其前体检测。如图1(a)所示,基本原理如下:RNA样本经电泳分离后,转移到硝化纤维素膜或尼龙膜上,设计含有miRNA 互补的序列及同位素或其他标记的DNA标记探针,利用对该探针的检测实现miRNA 定量[15~17]。Northern blot技术可实现miRNA 的相对分子大小和相对丰度检测,但存在半定量、灵敏度较低及操作复杂等弊端。
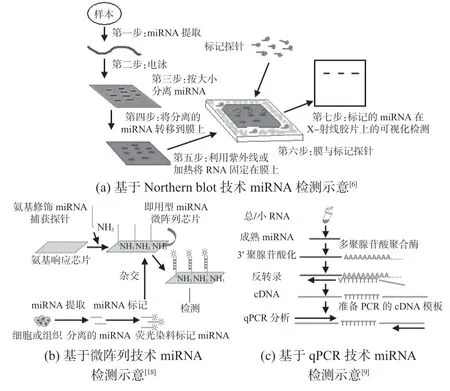
图1 传统miRNA检测方法
微阵列技术:该技术广泛应用于miRNA 的高通量检测。如图1(b)所示,首先,通过标记探针将目标miRNA逆转录为荧光团或生物素标记的cDNA。其次,利用目标miRNA序列相同的固相寡核苷酸与其配对并进行荧光检测[18]。如果杂交的cDNA被生物素化,链霉亲和素标记的荧光团可被标记;如果cDNA被荧光团标记,则可直接测量每孔的荧光强度,确定miRNA的表达水平。虽然微阵列技术一次性可分析数千个样本,但存在成本高、操作复杂及特异性差等弊端。
qPCR技术:该技术具有动态范围大及灵敏度高等优势,已成为miRNA 常规且可靠的检测技术。如图1(c)所示,目标miRNA通过茎环引物或聚胸腺嘧啶适配体逆转录转变成cDNA,利用PCR技术对cDNA进行实时荧光检测,从而确定miRNA 含量。qPCR 技术可实现miRNA 高灵敏检测,但其假阳性高及引物设计困难等弊端限制了其进一步应用。
2 新型miRNA检测方法
针对传统miRNA检测方法存在灵敏度低、特异性差且往往需要大型仪器辅助等缺陷。研究学者开发了多种新型miRNA生物传感器,实现miRNA低成本、高灵敏及高特异检测,在临床诊断和生物医学研究领域具有较大应用潜力。主要包括:基于等温核酸扩增技术信号放大的miRNA检测方法与基于纳米粒子信号放大的miRNA检测方法。
2.1 基于等温核酸扩增技术信号放大的miRNA检测方法
等温核酸扩增技术的出现,为miRNA高灵敏检测带来新契机,与传统PCR 方法相比,其更适用于目标物的及时快速检测。目前,滚环扩增(rolling circle amplification,RCA)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、基于双链特异性核酸酶(duplex-specific nuclease,DSN)扩增和无酶扩增等多种等温核酸扩增方法已被用于miRNA检测,如图2。通常利用SYBR Green 作为DNA 荧光嵌入染料,用于荧光实时检测,然而,SYBR Green 染料以剂量依赖方式降低扩增效率,易发生非特异性扩增。为实现扩增产物特异性检测,TaqMan 探针被用于检测扩增产物,但其依赖Taq 外切酶的耐高温活性。与TaqMan 相比,分子信标(molecular beacons,MBs)和一步式链置换(one-step strand displacement,OSD)报告分子在检测序列特异性核酸中具有更好的检测性能,并可阻碍假阳性产物的生成。
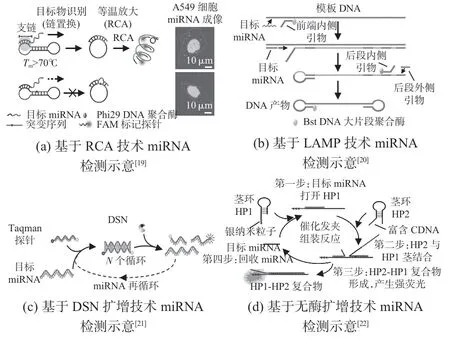
图2 基于等温核酸扩增技术信号放大的miRNA检测方法
2.1.1 基于RCA的miRNA检测方法
RCA技术因其高灵敏度、高特异性的优势,广泛应用于核酸检测中,其中,miRNA可作为启动RCA所需连接反应的理想模板。近年来,为提高特异性与扩增效率,研究学者基于Phi29 DNA聚合酶的强链置换活性,提出多种RCA改良技术,例如设计特殊的挂锁或哑铃探针、添加第二个引物等。如图2(a)所示,Deng R等人[19]通过将RCA与支链介导的链置换也称Toehold 介导DNA 链置换(Toehold mediated strand displacement,TMSD)反应技术相结合,开发了一种新型miRNA原位检测方法。该研究设计了哑铃状封闭探针在TMSD 和RCA 中均发挥了关键作用。目标miRNA通过启动TMSD过程介导探针结构的变化,从而触发RCA反应产生大量报告分子。与传统的RCA 反应,该系统依赖TMSD和哑铃状封闭探针的作用,与连接反应或酶识别无关,提高了检测的特异性。同时,基于RCA 的高效扩增,与荧光原位杂交技术相比,该检测平台具有较高的灵敏度。
2.1.2 基于LAMP的miRNA检测方法
LAMP是一种特异性强、灵敏度高及扩增效率高的等温核酸扩增技术[4],通过4~6 种不同的引物同时识别6~8种不同的目标序列,从而明显提高检测的特异性。在大多数基于LAMP的miRNA定量检测中,miRNA可作为触发器启动反应(图2(b)),当目标miRNA 存在时,引物在DNA聚合酶的作用下进行聚合延伸,并进行链置换合成高分子量的DNA产物。Tian W 等人[23]将RCA 与LAMP 相结合,设计了快速且超灵敏RCA-LAMP 技术实现miRNA检测。目标let-7a可直接以锁状探针连接为模板,进而触发RCA反应,产生重复串联的扩增产物。其次,RCA 产物可进一步作为模板,生成大量具有功能序列的双茎环DNA,作为后续LAMP反应的起始原料。该生物传感器通过目标物介导连接反应,依次触发RCA与LAMP级联反应,显著提高扩增效率与检测灵敏度,检测限低至10 amol/L。该传感器为miRNA的分析提供了广阔的应用前景,并可扩展至多种基因生物标志物的检测。
2.1.3 基于DSN扩增的miRNA检测方法
目前,上述RCA 与LAMP 反应仍依赖复杂的序列设计,包括茎环引物与模板。从整体上看,等温核酸扩增技术设计复杂,并存在可能发生副反应和检测背景高等问题。基于此,研究学者开发了以酶为基础的等温切刻扩增技术用于miRNA 检测。DSN 可水解DNA/RNA 或双链DNA(double strand DNA,dsDNA)中DNA结构,而对核苷酸序列无特殊要求。基于DSN的特性,miRNA可在该反应中实现循环使用,有效放大检测信号。如图2(c)所示,Yin B C等人[21]报道了一种基于DSN的简便快速的miRNA检测系统。该系统无需设计复杂探针、链延伸或置换等过程。该方法仅需目标miRNA 与Taqman 探针简单配对杂交,可实现序列特异性miRNA 的定量检测,检测限低至fmol/L级别,比传统MBs的检测限低近5 个数量级。该生物传感器灵敏高、特异性强、重现性强且操作简单,有望成为组织或细胞中多种miRNA定量分析常规工具,并为生物医学研究和临床早期诊断提供应用平台。
2.1.4 基于无酶扩增的miRNA检测方法
无酶扩增是一种由支链介导的DNA链置换反应,因其无需变温操作且无酶的优点,在miRNA检测等方面引起了广泛关注。其中,催化发夹组装(catalytic hairpin assembly,CHA)具有良好的信号放大能力及可忽略的背景干扰等优势,广泛应用于miRNA检测领域。如图2(d)所示,Kim H等人[22]基于目标物触发CHA 反应和DNA-银纳米团簇(DNA-Ag nanoclusters,AgNCs)的荧光增强技术,构建了一种简单、无酶及无标记的miRNA 检测策略,并可进一步应用于人血清样本检测。然而,该策略的灵敏度仍受到发夹组装效率差和目标与染料修饰的探针之间结合率低的限制。基于此,Zhen S J等人[24]利用捕获探针将染料修饰探针固定在氧化石墨烯(graphene oxide,GO)表面,构建了高灵敏miRNA生物传感器。当目标miRNA-21 触发CHA 反应,产生H1-H2探针时,染料修饰的探针才脱离GO 表面。通过收集荧光信号,实现miRNA 定量检测,检测限低至47 pmol/L。
2.2 基于纳米粒子信号放大的miRNA检测方法
近几年,随着纳米技术的蓬勃发展,纳米粒子,例如金纳米粒子(Au nanoparticles,AuNPs)、AgNCs、铜纳米粒子(Cu nanoparticles,CuNPs)和多壁碳纳米管-氧化石墨烯纳米带(MWCNTs-GONPs)等已成为改善传统检测方法性能的有力工具,可有效实现信号放大,提高检测灵敏度,广泛应用于miRNA检测研究领域,如图3所示。

图3 基于纳米粒子信号放大的miRNA检测方法
AuNPs具有强表面等离子体共振吸收和高消光系数等优良光学性质,广泛应用于生物检测技术的开发。基于AuNPs的比色检测技术,可实现miRNA快速简便且无需昂贵仪器辅助检测。通过Au-S键结合目标捕获探针,实现AuNPs核酸探针的制备。目标物存在时,通过触发分散的AuNPs发生聚集反应,产生强表面等离子体共振吸收,导致溶液颜色从红色变为紫色。Persano S 等人[25]基于AuNPs表面等离子体共振吸收特性,构建了比色生物传感器用于生物样品中miRNA 的检测。如图3(a)所示,当目标物存在时,触发等温切刻酶扩增反应,随后扩增产物和AuNPs、磁纳米粒子偶联,实现miRNA裸眼比色检测。该检测平台灵敏度高且特异性强,检测限低至amol/L 级别,同时可实现乳腺癌相关miRNA-10b检测,并应用于乳腺癌细细胞裂解液和乳腺癌小鼠模型的血清样本检测。同样地,Li R D等人[26]受Park K W等人[27]实验的启发,基于等温指数扩增反应(exponential amplification reaction,EXPAR)与AuNPs信号放大,构建了快速且灵敏的miRNA 比色生物传感器。在50 fmol/L ~10 nmol/L的线性范围内,该检测技术可实现miRNA定量,检测限低至46 fmol/L,同时具备区分同源miRNA之间单核苷酸差异能力。
AgNCs具有高生物相容性、光稳定性及亚纳米尺寸等优势,可在生物检测中作为新的信号转换器。与AuNPs不同,当富含鸟嘌呤的DNA序列与AgNCs结合时,可显著增强其荧光强度,避免了其与核酸之间的共价连接。研究学者基于等温扩增策略与AgNCs信号放大,构建了多种高灵敏miRNA生物传感器[19,28]。然而,由于AgNCs 对蛋白酶及酶促反应条件比较敏感,可能导致实验重复性差。为克服此弊端,科研工作者将AgNCs 与无酶扩增技术(如CHA[22]和SDA[29])结合,显著提高检测的灵敏度、特异性及稳定性。
CuNPs具有无毒、高生物相容性和易合成等优势,引起研究者的广泛关注,开发了多种生物传感器用于miRNA高灵敏检测[30,31]。如图3(b)所示,Park K W等人[27]基于目标辅助EXPAR技术结合聚(胸腺嘧啶)修饰荧光CuNPs作为信号探针,构建了快速且超灵敏miRNA检测平台。同样地,Borghei Y S等人[32]基于CuNPs荧光发射的变化,通过寡核苷酸置换CuNPs,成功实现人血清样品中miRNA-155检测。
近年来,碳纳米材料也被广泛应用于miRNA 检测领域,主要包括石墨烯和碳纳米管(carbon nanotubes,CNTs),其在硬度、机械性能、耐热性和导电性等方面均优于其他材料。如图3(c)所示,Wang J等人[33]将单链DNA捕获探针固定于MWCNTs-GONPs修饰的电极表面,通过DSN 辅助靶标循环扩增技术,实现了miRNA-21 高灵敏且高特异性检测,检测限低至0.034 fmol/L。
基于不同纳米粒子信号放大的miRNA检测方法如表1。
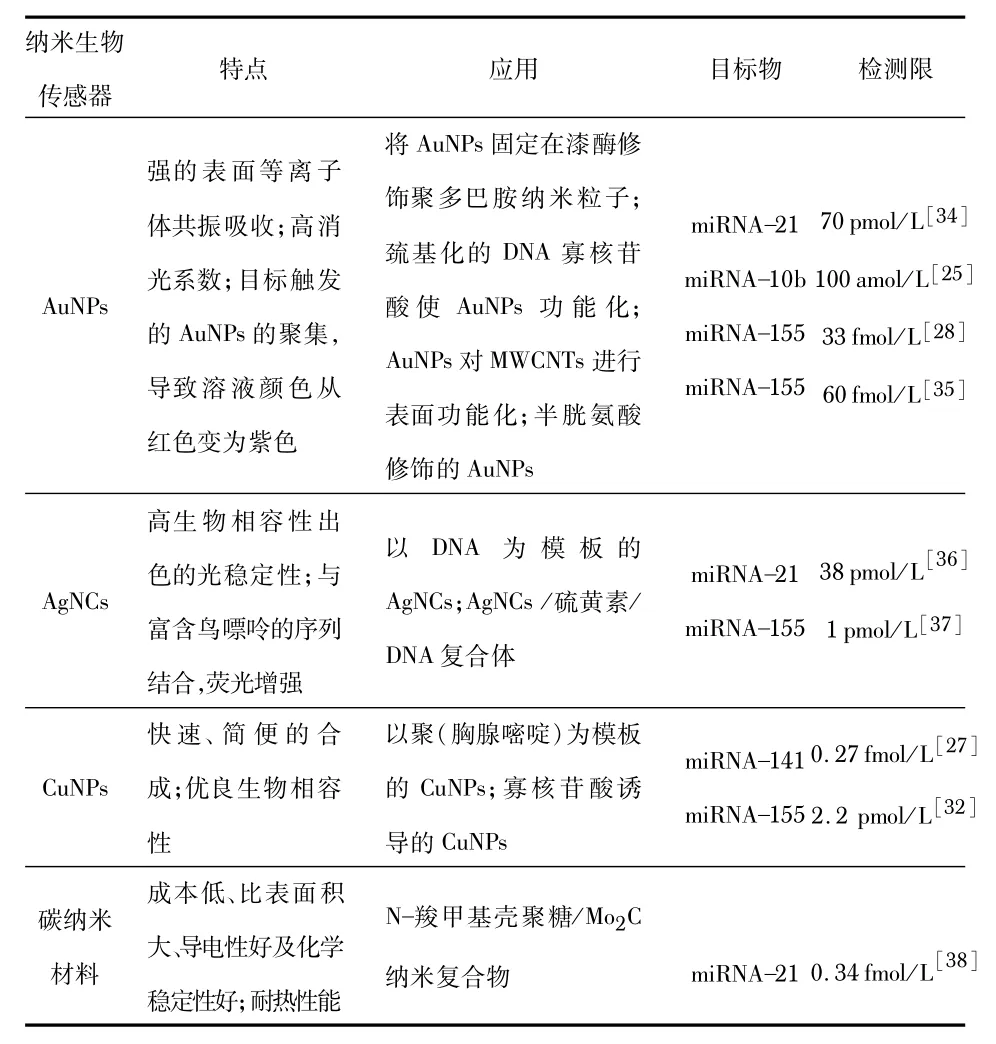
表1 基于不同纳米粒子信号放大的miRNA检测方法汇总
3 结束语
综上所述,本文围绕传统miRNA 检测方法与新型miRNA生物传感器2 个方面,总结了多种miRNA 检测策略,其进一步推动了等温核酸扩增策略与纳米技术在生物检测领域的应用,为相关疾病的诊断与预防提供了新思路。然而,上述策略仍存在较大改进空间,目前亟需开发更为便携和智能化的多功能核酸生物传感平台,助力于miRNA和纳米材料在临床诊断中的实际应用。
