高分辨MR 成像联合ADC值预测直肠癌新辅助放化疗后区域淋巴结转移的价值
2024-03-23李常虹顾华勇赵希鹏王艳丽刘桂芳
郭 成 李常虹 顾华勇 赵希鹏 刘 震 王艳丽 刘桂芳
1.青岛大学附属青岛市中心医院分子影像科 (山东 青岛 266042)
2.青岛大学附属青岛市中心医院放射科 (山东 青岛 266042)
对于局部进展期直肠癌,NCCN指南建议可先行新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)后再行根治术治疗,且临床研究已证实经nCRT后多数直肠癌患者可实现局部肿瘤退缩和降期,降低手术环周切缘阳性率[1-2]。Debove等[3]发现nCRT后效果显著者可行局部切除术,可获得与全直肠系膜切除术相似肿瘤治疗效果,且手术操作更简单、并发症少。此外,有研究发现术前临床完全缓解者采取等待观察治疗,其5年生存率与外科手术治疗者相似[4]。因此nCRT及后续治疗是直肠癌治疗领域研究的热点之一。但无论是局部切除术还是等待观察治疗均无法切除可能转移的淋巴结。国内外研究证实未切除转移淋巴结是疾病复发转移主要因素[5-6]。但Ferrari等[7]发现nCRT后直肠癌细胞的退缩在肠壁不同层次上分布不均,这可导致活检时假阴性率较高。而临床发现高分辨T2WI对肿瘤定位、描述周边组织结构等有着不可替代的位置[8]。弥散加权成像(diffusion-weighted imaging,DWI)技术通过获取的表观扩散系数(apparent diffusion coefficient,ADC)值来反映组织内水分子的弥散情况,间接提示机体生理病理变化状况,如炎症反应、癌细胞密度改变等,且ADC值被证实与肿瘤细胞等级相关[9]。基于此,本研究将高分辨MR成像与ADC值联合应用,以此预测nCRT后区域淋巴结转移情况,为临床最佳治疗方案选择提供指导。
1 资料与方法
1.1 一般资料经医学伦理委员会审准,纳入青岛大学附属青岛市中心医院2020年5月至2022年5月收治的直肠癌患者为研究对象。
纳入标准:属于腺癌的局部进展期直肠癌(肿瘤距离肛缘≤12cm、cT3-4Nx 或 cTx N+),符合相关诊断标准[10],未见明显的肝肾等远处转移病灶;拟行外科手术治疗(全直肠系膜切除),且术前接受nCRT治疗;患者知晓本研究并签署研究知情同意书。排除标准:放化疗前合并严重心、肺、脑等血管疾病;合并其他恶性肿瘤;遗传性家族性非息肉性结直肠癌;因肿瘤出血、穿孔、梗阻等并发症行急诊手术;卡氏功能状态量表评分[11]≤70分;存在可能影响MRI检查的因素,如置入心脏起搏器、佩戴节育器。剔除或脱落标准:nCRT后未行手术治疗或nCRT过程中断;术后病理证实为非局部进展期直肠癌;nCRT至手术期间病死;因各种原因未获得病理报告结果。
遵循上述标准,纳入95例患者,研究期间1例未完成nCRT治疗,2例放化疗后6~8周内未行手术治疗,最终93例完成研究全部过程。其中男62例,女31例;年龄48~66岁,平均(56.78±4.24)岁;伴糖尿病18例;伴高血压29例;伴饮酒史31例;伴吸烟史28例;治疗前癌胚抗原正常16例,异常77例;治疗前糖类抗原199正常20例,异常73例。
1.2 方法
1.2.1 治疗方案 所有患者经结肠镜活检确诊为局部进展期直肠癌后1周内接受nCRT治疗,治疗方案为常规放疗加卡培他滨同步化疗(长程放化疗)。放疗处方剂量为50.0Gy,2.0Gy/次,5次/周,共25次;放疗5周期间,给予卡培他滨(上海罗氏制药有限公司,上海罗氏制药有限公司,规格:500mg/片)口服,每次825mg/m2,2次/d,每周5d或7d。放化疗结束6~8周行标准全直肠系膜切除术治疗。
1.2.2 MRI检查 所有患者于nCRT前、结束后6~8周时均接受高分辨率MRI T2WI、DWI检查。检查仪器为高分辨磁共振成像仪(GE,MR750 3.0T)和与其配套的8通道相控腹部线圈,患者取仰卧位,足先进,患者均行常规T1WI、高分辨率矢状位T2WI、横断位T2WI、DWI序列扫描(如病灶累计肛门则加扫冠状位T2WI序列)。具体参数如下:(1)常规T1WI:采用三维容积式内插法屏气检查序列,TR:4.36ms,TE:1.94ms,层厚:5mm,FOV=655mm×420mm,AQM:320224。(2)矢状位T2WI:TR:5645ms,TE:92.48ms,层厚:3.5mm,层数:28,FOV=342mm×220mm,AQM:288320。(3)横断位T2WI:TR:5050ms,TE:92.48ms,层厚:5mm,层数:28,FOV=686mm×440mm,AQM:324384。(4)冠状位T2WI:TR:5300ms,TE:106.02ms,层厚:3.5mm,层数:20,FOV=374mm×240mm,AQM:288320。(5)DWI:TR:2000ms,TE:62.60ms,层厚:5mm,层数:56,FOV=686mm×440mm,AQM:128128,b值取0、1000s/mm2。增强扫描时应用高压注射器以3.5mL/s的流率注射对比剂钆特酸葡胺(法国加柏公司,国药准字H20110120,规格:15mL/剂)0.1mmol/kg,并应用20mL生理盐水冲管。
1.2.3 图像分析处理剂质量控制 将获得的原始图像传入工作站,由T1WI、T2WI序列定位病灶与淋巴结位置,并在DWI序列上进行相同位置对应;由2名有10年工作经验的磁共振医师在未知疾病情况下对勾画淋巴结感兴趣区(region of interest,ROI),ROI区需覆盖淋巴结大小,同时需避开周边低信号坏死区域,每个淋巴结需要取3个层面进行测量。获得淋巴结最大层面后测定其长径、短径、ADC值,最终取平均值。参数的变化百分比绝对值(∆%)=(放化疗后参数-放化疗前参数)/放化疗前参数的绝对值。
1.2.4 病理结果 全直肠系膜切除术中取病理标本,由一名有经验的病理科医师捡取nCRT前MRI相应位置的淋巴结标本,将淋巴结标本进行HE染色,由2名病理科医师独立阅片,镜下观察淋巴结转移情况,如2位诊断医师就同一张切片存在不同意见,需经讨论后统一。
1.3 统计学方法本研究应用SPSS 25.0软件处理数据,计量资料行Shapiro-Wilk检验,正态分布者以表示,行t检验;偏态分布以[M(P25,P75)]表示,行Mann-Whitney U检验;计数资料以例表示;影响因素以Logistic回归分析;绘制受试者工作曲线(receiver operating curve,ROC),以曲线下面积(area under curve,AUC)评估高分辨MR成像联合ADC值预测直肠癌nCRT后区域淋巴结转移的价值;(参照标准:AUC>0.9:预测效能较高;AUC值0.7<AUC≤0.9:预测效能中等;AUC值0.5<AUC≤0.7:预测效能较低;AUC值≤0.5:无预测效能);P<0.05为差异有统计学意义。
2 结 果
2.1 nCRT后区域淋巴结转移情况93例患者经术后病理证实共发生淋巴结转移24例(25.81%),检出淋巴结数量为(14.35±6.12)(1~23)/例,其中淋巴结转移阳性者淋巴结清扫数量为(13.13±3.05)枚,而阴性者淋巴结清扫数量为(12.87±3.40)枚,术中淋巴结清扫数量比较,差异无统计学意义(t=0.325,P=0.746)。
2.2 nCRT前后高分辨MR成像、ADC值分析转移组nCRT前后淋巴结短径均大于非转移组,nCRT前ADC值均小于非转移组(P<0.05);转移组∆短径%、∆ADC%值均小于非转移组(P<0.05);但两组nCRT前后长径及∆长径%值比较,差异无统计学意义(P>0.05)。见表1。

表1 nCRT前后高分辨MR成像、ADC值分析
2.3 变量预测直肠癌nCRT后区域淋巴结转移价值的Logistic回归分析经Logistic回归分析显示,∆短径%、∆ADC%是直肠癌患者nCRT后区域淋巴结转移的独立预测指标。见表2。
2.4 高分辨MR成像联合ADC值预测直肠癌患者nCRT后区域淋巴结转移价值以∆短径%、∆ADC%为作为检验变量,直肠癌患者nCRT后区域淋巴结转移情况为状态变量,绘制ROC曲线(见图1),结果显示,∆短径%、∆ADC%单独及联合预测直肠癌患者nCRT后区域淋巴结转移的AUC分别为0.748、0.852、0.879,具有一定的预测价值。见表3。
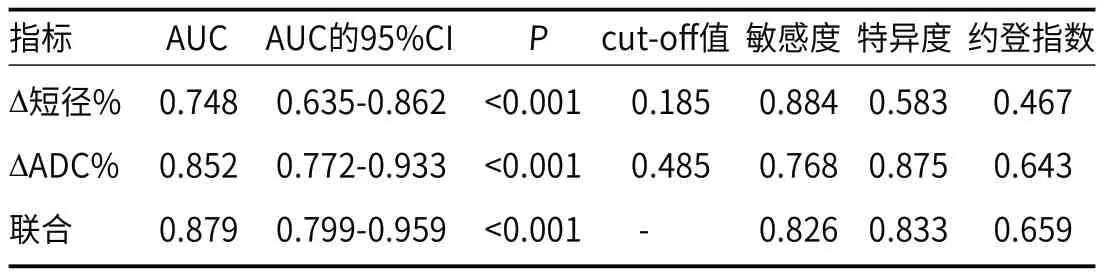
表3 高分辨MR成像联合ADC值预测直肠癌患者nCRT后区域淋巴结转移价值

图1A-图1F 患者,女,70岁,进行性排便困难1年余。直肠癌T3N1M0期,直肠左侧系膜区多发转移淋巴结,呈T2WI等信号(图1A),T1WI呈稍低信 号(图1B),DWI呈高信号(图1C);经新辅助放化疗后,肿大淋巴结明显缩小或消失(图1D-1E)。

图2 高分辨MR成像、ADC值预测直肠癌患者nCRT后区域淋巴结转移的ROC曲线
3 讨 论
nCRT对淋巴结的影响主要表现在两个方面,一是对淋巴结形态(数目、大小)的影响,二是对淋巴结分期的影响。而淋巴结的大小与分布是评估淋巴结转移的重要依据,当癌细胞向淋巴结扩散时通常会首先侵犯邻近淋巴结,然后扩散到更远的淋巴结[12]。因此,淋巴结的形态和分期有助于预测淋巴结转移情况。欧洲胃肠和腹部放射学会共识会议上,专家认为MRI是评估直肠癌术前分期、癌细胞形态、放化疗效果的首选技术。因此,选择有效的MRI技术或MRI序列探索适用于直肠癌后nCRT淋巴结转移的量化预测标准。
在轴位高分辨T2WI中小视野成像可精确的定位病灶位置与大小;同时其较高的组织分辨率可清晰显示直肠壁各层解剖学信息[13]。而有证据指出淋巴结大小与淋巴结转移关系密切,特别在直肠癌中,淋巴结短径被认为是淋巴结转移的一个重要因子[14]。本研究结果也发现,淋巴结转移者的短径nCRT前后均较长,证实了上述研究。临床研究认为高分辨MRI可通过观察淋巴结形态、边缘与信号特点来预测不同淋巴结短径转移情况,但阈值不统一,故评价其淋巴结转移情况效能各异[15]。而本研究以nCRT前后淋巴结短径的变化幅度作为观察指标,通过观察淋巴结大小改变来直接提示其是否转移。虽然这种量化方法预测整体淋巴结转移并不精确,但临床研究发现淋巴结短径>5mm预测直肠癌淋巴结转移的的准确度可达81.4%[16]。同时淋巴结大小的改变可提示原发病灶生长与转移、nCRT效果,而原发病灶大小、nCRT效果已被临床证实与直肠癌淋巴结转移密切相关[19]。因此通过淋巴结短径变化幅度对预测直肠癌nCRT后淋巴结转移具有一定的辅助价值。本研究通过Logistic回归分析也显示∆短径%是直肠癌nCRT后淋巴结转移的因子,同时该指标预测直肠癌nCRT后淋巴结转移的AUC为0.748,虽然具有一定的价值,但敏感度较低,故仍需结合其他方案进一步提高预测准确率。
DWI及其相应的ADC值可定性和定量反映细胞水平变化,在恶性病变中组织细胞增殖较正常组织细胞增殖速度快,倍增时间更短,细胞的密集程度更高,细胞之间的间隙较小等,导致组织细胞水分子随机扩散运动受限,促使病变的组织ADC值较正常组织降低[17]。目前临床根据上述特征鉴别疾病良恶性病变,同时也为淋巴结转移提供了研究方向[18]。本研究观察直肠癌nCRT前后的ADC值情况,结果发现发生淋巴结转移者治疗前后ADC值变幅相对较小,提示了ADC值变幅可能直肠癌nCRT后淋巴结转移有关。对于直肠癌患者来说,其ADC值的测量结果受多种因素的影响,如组织细胞自身结构、细胞膜通透性、微血管分布等,而淋巴结转移与肿瘤血流、微血管分布等关系密切。临床研究显示放化疗可损伤肿瘤组织,导致细胞膜的完整性和通透性变化,促使肿瘤细胞的活性受到影响甚至丧失,进而影响细胞内的水分子弥散运动[19]。可见ADC值改变可间接提示直肠癌nCRT效果,而直肠癌nCRT效果可直接影响淋巴结转移情况。因此,ADC值对定量预测淋巴结转移具有一定价值。本研究经Logistic回归分析及ROC曲线均证实了∆ADC%可有效预测直肠癌nCRT后淋巴结转移。
多项研究发现联合DWI和T2WI图像比单独应用DWI或T2WI可更好预测nCRT疗效[20-21]。综合考虑各种因素,本研究将高分辨MR成像与ADC值联合应用,结果证实∆短径%+∆ADC%预测直肠癌nCRT后淋巴结转移的AUC值相对较高,由此可见高分辨MR成像联合ADC值预测直肠癌nCRT后区域淋巴结转移更精确。但是影像学仍处于探索阶段,人工勾画ROI可能存在勾画误差,因此本研究还需更多样本量、建立多模态模型,提高预测nCRT后区域淋巴结转移的准确度,从而为临床精准治疗提供支持。
综上所述,分辨MR成像联合ADC值预测直肠癌nCRT后区域淋巴结转移具有一定的价值,其中淋巴结短径与ADC值变化可有效提示nCRT后区域淋巴结转移情况,对直肠癌精确治疗具有重要意义。
