双能量CT定量参数预测乳腺浸润性导管癌病理分级及乳腺癌分子亚型的研究*
2024-03-23赵玉年刘路路
仇 莉 赵玉年 朱 倩 刘路路 徐 峰,*
1.南京医科大学附属宿迁市第一人民医院 (江苏 宿迁 223800)
2.江苏省肿瘤医院 (江苏 南京 210018)
乳腺癌是一种严重危害女性健康的恶性肿瘤,近年来其发病率不断上升,且致死率较高[1]。浸润性导管癌(invasive ductal carcinoma,IDC)占据全部乳腺癌4/5,为其临床常见类型之一[2]。目前,临床上多采用病理学活检的方式对乳腺癌进行确诊,但由于其具有创伤性、无法准确反映乳腺癌的总体分化情况,故在临床应用中受到一定限制。近年来,双能CT在肿瘤领域得到了广泛应用[14-15],对肿瘤的诊疗具有重要的指导意义[3-5]。与传统CT相比,双能量CT开发了能量成像和物质分析功能,因此能够获取不同于传统CT的单能量图像、能谱曲线、基物质图像、有效原子序数等信息。基于此,本研究拟采用双能量双期增强CT技术,探究其相关定量参数对IDC病理分级、分子亚型的预测价值,现报道如下。
1 资料与方法
1.1 一般资料回顾性收集2022年1月至2023年6月在宿迁市第一人民医院手术后,病理诊断为乳腺浸润性导管癌并于双源CT机行胸部CT增强扫描的63例病例资料。全部患者均为女性,年龄为20~87岁,平均(61.24±8.97)岁。应用改良Scarff-Βloom-Richardson分级系统将浸润性导管癌患者分为高分化组(Ⅰ级、Ⅱ级)及低分化组(Ⅲ级)。
纳入标准:未接受过胸部放射治疗或乳腺手术;经病理学确诊为IDC,并且存在组织学分级;病灶为单发肿块型病变。排除标准:病理分型非IDC;检查前未接受过辅助治疗;图像中存在较多伪影,对病灶观察造成干扰。
本试验已获得宿迁市第一人民医院伦理委员会批准,并在研究正式开始前获取了经全部研究对象签字的知情同意书。
1.2 检查方法全部患者在治疗前均借助Simens Somatom Definition Flash CT机对进行常规胸部平扫、双能量双期增强扫描。在对患者进行正式检查前,叮嘱其开展屏气训练。取患者仰卧位,头部先进,扫描范围为整体胸部及软组织。扫描参数:低、高电压分别为40、140keV,电流90mAs,准直器宽6.4×0.06cm。将适当浓度的碘克沙醇作为造影剂,以2.4mL/s的速率进行注射。将ROI放置于主支气管分叉处的胸主动脉内部进行监测,当其达到100HU阈值时,延迟10s后开展动脉期扫描,结束后延迟30s后开展静脉期扫描。扫描结束后对双期能量CT扫描图像分别进行重建。
1.3 数据采集分析将获得的重建图像导入 Siemens Syngo工作站,并对其进行处理:(1)利用虚拟平扫软件获取碘图,选择其中病变增强程度较高的层面,在该层面及主动脉管腔中央分别勾画出两期大小基本相同,至少包含66.67%病变面积的ROI,且囊性、钙化及坏死区排除在外。对病变部位和主动脉的碘浓度(iodine concentration,IC)、归一化有效原子序数(effective atomicnumber,Zeff)进行记录,见图1、图2;(2)通过单能谱程序得到病灶能谱曲线,并进一步获取病灶在40-70kev的CT值,见图3、图4。
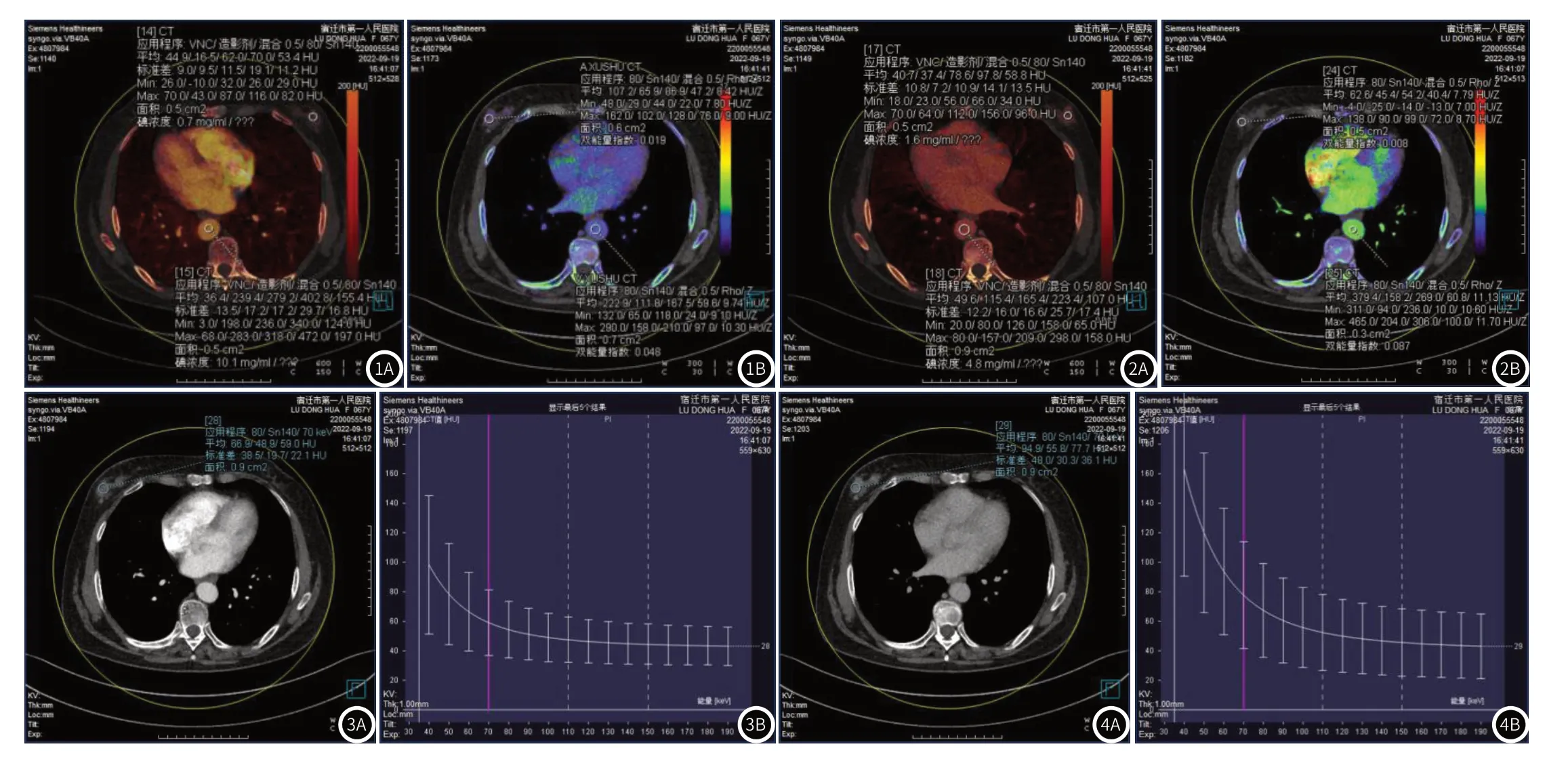
图1A-图1B 动脉期碘浓度及归一化原子序数,图1A为动脉期碘图(IC值为0.7,SIC值为0.069),图1B为动脉期原子序数图。 图2A-图2B 静脉期碘浓度及归一化原子序数,图2A为静脉期碘图(IC值为1.6,SIC值为0.333),图2B为静脉期原子序数图。图3A-图3B 能谱曲线及CT值,图3A为动脉期单能能谱曲线,图3B为病灶在40-70kev单能级时CT值。图4A-图4B 能谱曲线及CT值,图4A为静脉期单能能谱曲线,图4B为病灶在40-70kev单能级时CT值。
上述参数由一名具有5年以上胸部诊断经验的主治医师进行测定,先后测定3次取平均值,并计算病灶的SIC(标准化碘浓度)、nZeff(标准化有效原子序数)及(能谱曲线斜率)。计算公式如下:
1.4 分子分型根据2013 St.Gallen guidelines将IDC分为Luminal A 型、Luminal Β型、HER2过表达型(HER2-enriched)以及三阴型(basal-like)。
1.5 统计学方法采用SPSS 22.0对数据进行处理。计量数据采用Kologorov-Smirnov方法进行正态检验。若符合正态分布要求,则用(±s)表示,组间比较采用t检验。采Spearman秩和检验进行相关性进行分析,ROC曲线评估鉴别诊断效能。P<0.05,表示差异显著。
2 结 果
2.1 肿瘤一般情况63例IDC患者中,Luminal A、Β、HER2-enriched及basal-like型分别为18、31、7和7例,分别占比28.57%、49.21%、11.11 %、11.11%。不同分子亚型在病灶最大直径、是否有淋巴结转移方面差异不显著(P>0.05),而在组织学分级方面存在显著差异(P<0.05)。
全部IDC患者中,Ⅰ级14例,Ⅱ级31例,Ⅲ级18例,高分化组(Ⅰ、Ⅱ级)中,Luminal A型13例(28.89%)、Luminal Β型20例(44.44%)、HER2-enriched型7例(15.56%)、basal-like型5例(11.11%);低分化组(Ⅲ级)中,Luminal A型2例(11.11%)、Luminal Β型10例(55.56%)、HER2-enriched型2例(11.11%)、basal-like型4例(22.22%),见表1。
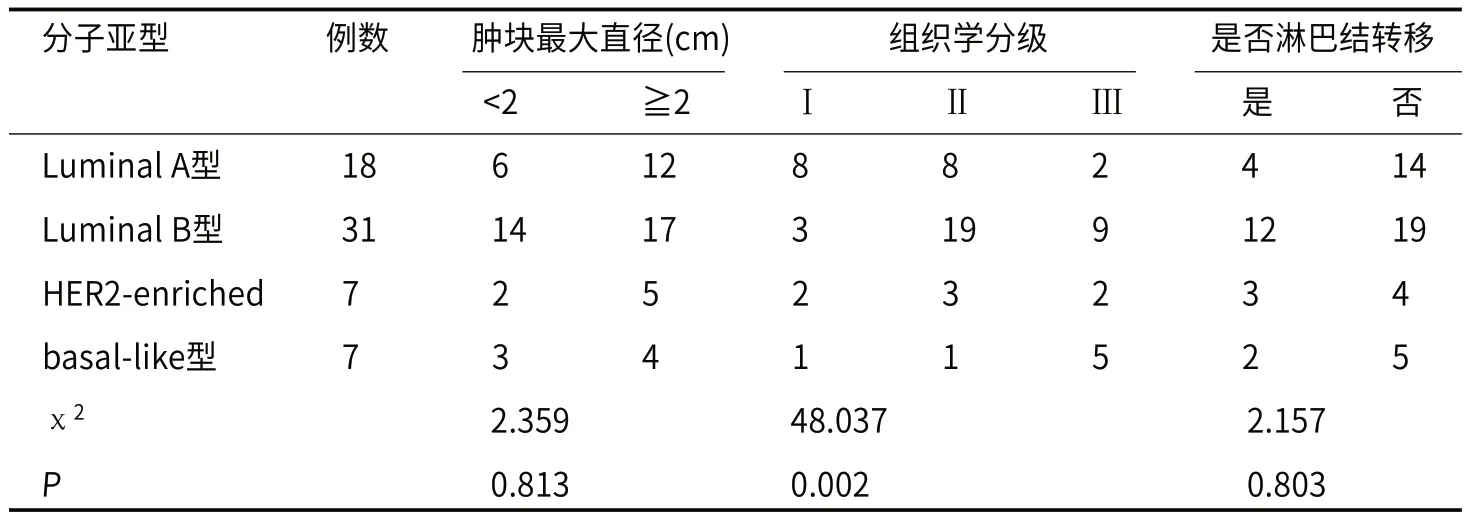
表1 IDC不同分子亚型一般临床资料(n)
2.2 不同分化程度IDC定量参数差异对高分化组、低分化组的各双能量CT定量参数进行比较,结果表明,动脉期中各定量参数均具有显著差异,而静脉期除值外,其余各定量参数均具有显著差异(P<0.05),见表2。
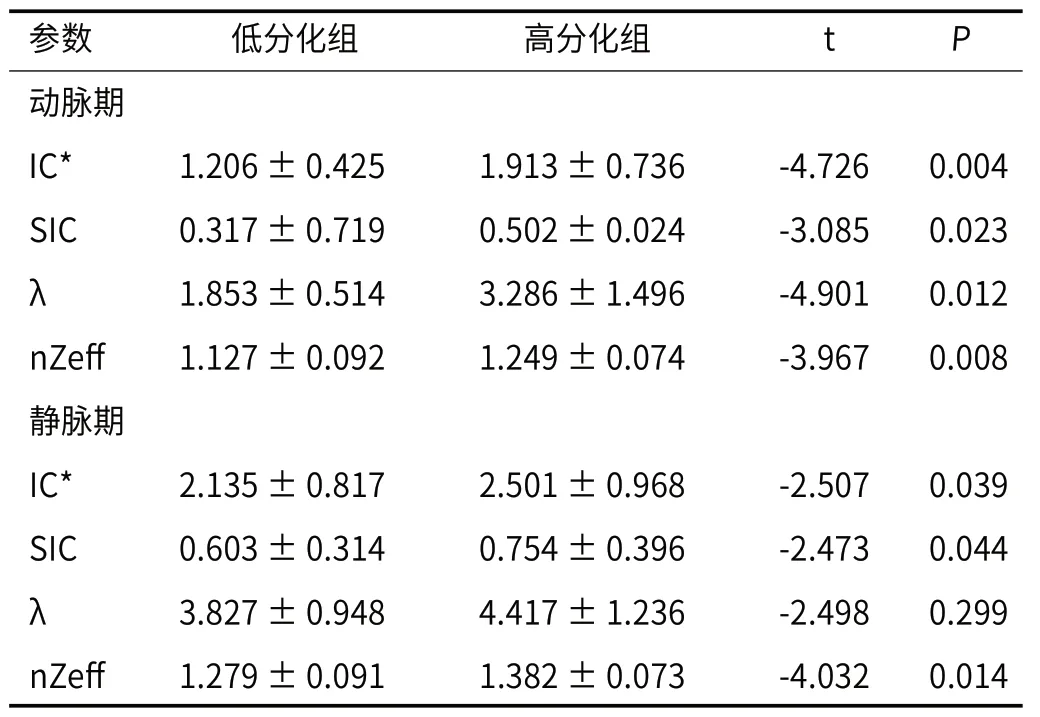
表2 不同分化程度 IDC双能量CT定量参数比较
2.3 定量参数与IDC病理分化程度相关性结果显示,动脉期中各定量参数与分化程度之间呈明显正相关性,而静脉期中除nZeff值外,其余各定量参数与分化程度之间无显著关联(P>0.05),见表3。

表3 IDC各定量参数与其分化程度之间的相关性(n)
2.4 定量参数对IDC不同分化程度及分子亚型鉴别诊断效能结果显示,各定量参数中,的ROC曲线下面积最大(0.954),其敏感度、特异度分别为83.25%、69.05%,见表4、图5。
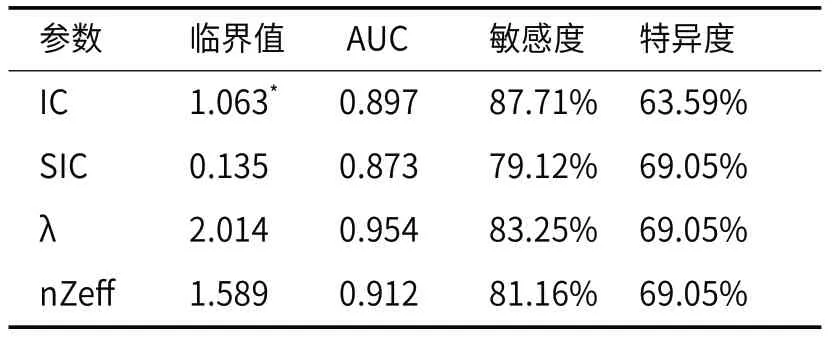
表4 动脉期定量参数对两种组织学分级的鉴别效能

图5 动脉期各定量参数的ROC曲线,其中以的ROC曲线下面积最大,为0.954。
3 讨 论
乳腺癌为临床女性常见恶性肿瘤之一,其发病年龄越来越小,对女性身心健康构成严重威胁[6-7]。双能量CT能够对肿瘤开展精准定性、定量分析,从而有助于对乳腺癌进行早期预测及诊疗[8]。利用双能量CT技术可以获取碘图,从而能够很好地反应出病变部位对碘的吸收能力等。碘图中所测得的IC值能够帮助我们更好地了解肿瘤血管的分布情况。对IC值进一步校正得到的SIC值,能够进一步降低不同患者的个体差异,从而更准确地体现出病灶内的血管分布情况[9]。能谱曲线是根据每个组织在不同keV值下对应的不同CT值而生成的,组织的物质组成存在差异,生成的能谱曲线也不尽相同,通过对其斜率进行比较,可以对不同组织的组成成分加以鉴别[10]。
本研究结果显示,36例浸润性乳腺导管癌患者中,Ⅰ级7例,Ⅱ级20例,Ⅲ级9例。Luminal A型9例(25.12%)、Luminal Β型17例(47.64%)、HER2-enriched型5例(14.28%)、basal-like型5例(12.96%)。前期研究发现,SIC能够对病变部位的碘含量进行比较精确的定量分析,因此能够更客观地对病变部位的供血情况进行体现[11]。本研究结果显示,除了静脉期值,与低分化组相比,高分化组的各定量参数均显著升高(P<0.05),分析其可能是由于恶性程度越高,其肿瘤微血管密度及新生血管越多,肿瘤血管对造影剂的通透性明显增强等原因所致。此外,本研究结果还显示,动脉期的定量参数与IDC分化程度之间具有明显的关联性。分析其可能原因为在动脉期,肿瘤快速吸收碘,分化程度不同的IDC,对于碘的吸收能力存在显著差别。能谱曲线方面存在的差别,主要是与病变部位不同物质对X线的吸收不同等存在一定关联[12]。而在静脉期,对于分化程度不同的肿瘤而言,其对碘的吸收均已达到相对饱和状态。然而,因为处于不同分化程度的肿瘤,自身摄取碘的能力存在较大差异,因此静脉期两组的nZeff值具有一定差别。 keV较低时,能够对不同组织间的微小差别进行明显放大[13]。本研究结果显示,与低分化组相比,高分化组的动脉期能谱曲线值显著升高,且随着肿瘤恶性病变程度增加,值会变得更高。这是由于恶性程度较高的肿瘤,其血液供应比较丰富,因此在注射造影剂后对碘的摄取能力增强。
综上,双能量CT定量参数对乳腺浸润性导管癌病理分级及乳腺癌分子亚型具有一定的临床预测价值,值得在临床上大力推广。
