维持性血液透析患者血清全段甲状旁腺素水平与微炎症的关系研究①
2024-03-22刘慧敏李长红颜嘉仪刘欣媛
刘慧敏,李长红,颜嘉仪,刘欣媛
(佳木斯大学附属第一医院肾内科,黑龙江 佳木斯 154003)
继发性甲状旁腺功能亢进(secondary hyperparathyroidism,SHPT)是进入维持性血液透析(maintain hemodialysis,MHD)患者的常见并发症之一。这种并发症以甲状旁腺素过量分泌所致钙磷代谢紊乱、纤维性骨炎、血管及软组织钙化等肾性骨病、异位钙化、周围神经改变为主要临床表现。不仅给MHD患者增加了病痛,亦增加了死亡风险。然而SHPT的病因及发病机制尚不完全清楚,防治手段也十分有限。因此,寻找SHPT患者潜在的发病机制对该疾病具有重大意义。
大量研究[1,2]表明微炎症状态与MHD患者所患多种并发症(尿毒症瘙痒、肾性贫血)都有密切联系。目前国内外对于长期MHD患者SHPT与炎症因子的相关性研究较少。本次研究旨在探究维持性血液透析患者血清iPTH与hs-CRP、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α) 三种微炎症指标的相关性,探讨其在临床中的应用价值及意义,能为透析患者减少并发症、延长生命、提高生活质量寻找可能的有效方法和途径。
1 资料与方法
1.1 研究对象
选取2021年5月至2022年11月于佳木斯大学附属第一医院肾内科接受MHD的肾衰竭患者100例。(1)纳入标准:①已确诊慢性肾衰竭尿毒症期;②患者已进行维持性血液透析治疗并每周规律透析2~3次;③患者透析龄>6个月;④规律使用自体动静脉内瘘≥3个月;⑤年龄18~80岁;⑥患者及其家属对本次研究知情且同意并签署知情同意书。(2)排除标准:①2个月内出现过发热、肝炎、新冠病毒感染,或存在冠心病、脑梗死、慢性阻塞性肺疾病等可能致炎症因子水平升高疾病的患者;②合并其他精神疾病、神经系统疾病和免疫代谢性疾病的患者;③存在严重多器官功能衰竭的患者;④预期寿命≤6个月的患者;⑤存在大量心包积液、胸腔积液等循环液体量严重未纠正的患者。根据2017版《KDIGO慢性肾脏疾病矿物质和骨骼疾病(CKD-MBD)诊断、评估、预防和治疗临床实践指南》[3]将MHD患者组按照iPTH检测结果分为A组(iPTH<300 pg/mL)和B组(iPTH≥300 pg/mL),另外同期选取40例本院健康体检中心年龄、性别匹配,体质量相仿,具有可比性的健康体检人员作为对照组。本研究已经佳木斯大学伦理委员会批准,所有受试者均被告知参与研究,并签署知情同意书。
1.2 研究方法
1.2.1 一般资料的收集:记录研究对象的一般资料:性别、年龄、身高、体质量等。
1.2.2 实验资料的收集:健康对照组成员清晨抽取外周静脉血进行实验室检查及留取血清,MHD患者在透析最大间隔日(最长为2日)清晨抽取外周静脉血,所有研究对象在采血前8 h禁食水。血清离子采用佳木斯大学附属第一医院全自动生化分析仪(日本,Olymopusav-1000)检测。全段甲状旁腺素采用化学发光免疫测定法,微炎症因子hs-CRP、IL-6、TNF-α的检测采用双抗体夹心酶联免疫吸附实验(ELISA)方法,并严格按照试剂盒说明书操作。
1.3 统计学方法
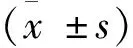
2 结果
2.1 3组一般资料比较
3组研究对象的一般资料:年龄、性别、身高、体质量等基线数据相比较,差异无统计学意义(P>0.05),见表1。

表1 3组一般资料比较
2.2 3组实验室检测指标比较
与对照组相比, A组和B组P、Hs-CRP、IL-6、TNF-α水平的升高,差异有统计学意义(P<0.05),血Ca水平差异无统计学意义(P>0.05), B组与A组相比,血清hs-CRP、IL-6、TNF-α水平的升高,差异有统计学意义(P<0.05),见表2。
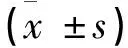
表2 3组生化指标比较
2.3 iPTH与各指标的相关性
由于各组iPTH及部分数据为非正态分布,采用Spearman相关分析。分析结果显示MHD患者组中iPTH与Hs-CRP(r=0.406,P<0.001),见图1,IL-6(r=0.254,P=0.002),见图2,TNF-α(r=0.343,P<0.001)水平呈正相关,见图3。

图1 iPTH与hs-CRP相关性分析

图2 iPTH与IL-6相关性分析
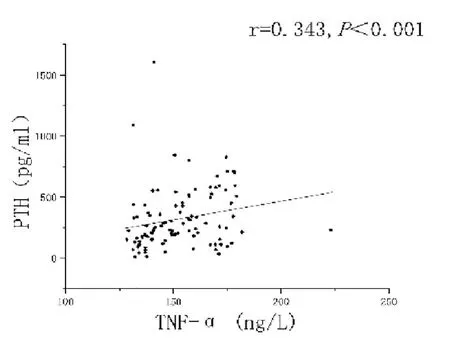
图3 iPTH与TNF-α相关性分析
对各组内部指标进行分组检验,A组中血清iPTH分别与Hs-CRP(r=0.332,P<0.05)和TNF-α(r=0.249,P=0.048)均呈正相关,与IL-6相关性不显著(r=0.021,P=0.551),见表3。

表3 A组iPTH与微炎症指标相关分析
B组血清iPTH与Hs-CRP(r=0.292,P=0.011)和TNF-α(r=0.307,P=0.041)均呈正相关,与IL-6(r=0.218,P=0.172)无显著相关性,见表4。

表4 B组iPTH与微炎症指标相关分析
2.4 微炎症指标间的相关性分析
总体患者中hs-CRP与IL-6(r=0.447,P<0.001),见图4,与TNF-α(r=0.561,P<0.001)呈正相关,见图5,TNF-α与IL-6(r=0.368,P<0.001)呈正相关关系,见图6。

图4 Hs-CRP与IL-6的相关性分析
2.5 以iPTH为因变量进行多元回归分析
以MHD患者组iPTH为因变量,纳入hs-CRP、IL-6、TNF-α构建多因素线性回归方程。结果发现只有hs-CRP对iPTH的影响具有统计学差异(b=19.173,t=2.621,P=0.011),说明hs-CRP是血清iPTH水平的独立影响因素,见表5。

表5 多元回归分析
3 讨论
微炎症状态(micro-inflammatory state)是Schomig 等[1]在2000年提出的新概念,该学者认为肾衰竭患者排除全身或局部急性感染的情况下,反应炎症状态的血标志物水平仍高于健康人群,我们把这种存在于血管内的炎症状态称为微炎症状态。这种炎症具有持续和相对隐匿的特点。目前对于微炎症状态的界定,医学界未形成统一的标准,一般认为患者血清中超敏C反应蛋白含量介于3~15mg/L且该患者未存在其他显性炎症或未患有慢性炎症性疾病时,可认定患者处于微炎症状态。
本研究结果显示,MHD患者中存在微炎症状态的患者共59例,占MHD患者总体的59%,MHD患者炎症因子水平明显高于对照组,该结论与既往研究一致[4]。MHD患者中,绝大部分患者甲状旁腺素升高占93%,甲状旁腺素水平明显高于对照组,MHD患者大多同时伴有iPTH异常升高及微炎症状态。由于对照组、A组、B组iPTH水平依次升高,3组微炎症人数在该组占比分别为23%、47%、76%,且3组间CRP、IL-6、TNF-α水平差异有统计学意义。由此不难得出,随着iPTH水平的升高,各组存在微炎症状态逐渐加重。这表明SHPT严重的血液透析患者更易处于微炎症状态中。既往研究提示,高磷血症、钙磷乘积升高、低白蛋白血症是慢性肾脏病患者并发 SHPT 的相关危险因素[5]。经过该研究进一步分析发现,iPTH与hs-CRP、TNF-α呈正相关,SHPT与微炎症状态之间可能相互影响相互促进。
超敏C反应蛋白是常规C反应蛋白的不同测量方式,二者本质上为同一种物质,CRP在早期可显著升高炎症水平,也是低水平炎症的特异性标志物,其动态变化可实时反映患者当前的微炎症状态。有关 CRP 的研究,既往被认为是一种非特异的炎症标志物,随着近年来的深入研究,揭示了其直接参与了炎症与动脉粥样硬化等心血管疾病的发生。CRP的合成器官主要是肝脏,而肾脏也被证实是CRP的分泌器官之一。肾脏病的患者血液循环中 CRP 浓度上升,使肾小管上皮细胞(CD320) 受体表达进行上调,活化的CD320 细胞可触发中性粒细胞、单核细胞、血管内皮细胞的促炎症反应。由此可见,CRP水平的升高,意味着体内细胞因子的激活,同时其作为一种促炎因子主动参与炎症反应。有研究发现hs-CRP水平在血液透析患者中升高,并且hs-CRP水平与MHD患者心血管事件发生率和死亡率显著相关[6]。CRP一直是MHD患者常规检查指标,常规CRP与hs-CRP作为同一种物质的不同检验方法[7,8],常用于探测患者体内炎症状态以及检测透析患者心血管并发症,二者无本质区别,只是hs-CRP检测手段更加灵敏。既往文献[9]显示CRP是机体发生炎症反应的敏感指标,属于机体出现炎症反应时的急性时相蛋白,受一些因子调控,如IL-6、TNF-α等。CRP可以及时的反映机体炎症状态,并且不受透析膜的影响。Hs-CRP是反应微炎症状态的客观敏感标志物,同时也是机体内存在细胞激活因子的重要标志物。高CRP的表达水平,诱导单核细胞合成细胞因子,使体内白蛋白水平降低,会加重机体营养不良状态,致使并发症及死亡风险加重。本研究经过进一步分析发现,iPTH与hs-CRP呈正相关,表明hs-CRP可能参与了MHD患者SHPT进的发生发展过程。
IL-6在许多炎症反应中起关键作用,是肝脏急性期反应最强的诱导剂,与尿毒症患者心血管并发症的发生率及死亡率呈正相关。IL-6在人体内的变化水平比CRP水平的变化要小,因此在采集单个样本时,可以更准确地对有风险的患者进行分类。Tripepi和Akchurin等[10,11]人的研究表明IL-6是心血管死亡的最佳预测因子,甚至优于CRP和其他细胞因子如TNF-α、IL-1和IL-18。本次的研究结果显示,MHD人群IL-6水平较对照明组显升高,B组患者IL-6水平较A组患者IL-6水平升高,差异有统计学意义。秩相关检验结果显示SHPT与IL-6相关性不显著。在MHD总体相关性检验中,iPTH与IL-6呈正相关,但在分段检验及回归分析中,iPTH与IL-6的相关性丢失,这表明二者相关性可能并不稳健。多种原因将导致本结果,包括样本量不大造成的随机误差,各种血液透析方式对各种蛋白物质的清除率不同导致。
肿瘤坏死因子α(Tumor necrosis factor, TNF-α)是一种三聚体蛋白,由巨噬细胞/单核细胞在急性炎症期间产生的,它是一种多效细胞因子,可介导炎症反应。TNF-α不仅可以通过促进免疫细胞的激活和募集来调节免疫功能,还能够引发细胞增殖、分化、凋亡和坏死。此外,TNF-α还能通过与55 kDa的细胞膜受体1(TNFR-1)或75 kDa的细胞膜受体TNFR-2结合,在抵抗感染和癌症时发挥重要作用[12]。Halwachs G等人的研究指出,终末期肾脏病患者出现肾间质纤维化、肾小球滤过率下降,血清肌酐上升,TNFR1含量随之上调,TNFR1与Scr呈现强关联性[13],国外对TNF-α与慢性肾脏病严重程度相关的报道并不少见[14,15]。终末期肾脏病患者处于炎症状态时,TNF-α亦升高,与TNFR1结合,通过激活JNK或NF-κB通路[15]引发促炎反应,进一步导致肾脏不可逆性损伤。在一些使用抗TNF-α治疗的慢性肾脏病研究中[16],TNF-α抑制剂如阿达木单抗等药品对肾功能恶化的抵抗作用得到了证实。TNF-α及TNF受体在肾小球肾炎和肾纤维化以及其他多种肾脏损伤中起到重要作用。以往的研究[17]建议将TNF-α与白介素、降钙素原等联合应用,用于监测MHD患者的透析后炎症转归情况。本研究中,Spearman相关检验显示iPTH与TNF-α呈正相关,考虑其原因与炎症总体水平升高有关,通过多元回归结果推测TNF-α可能与其他因子相互影响,这与过去的研究一致。目前有关iPTH与TNF-α的研究较少,TNF受体在SHPT中的作用尚不明确,期待未来出现更多该方面的研究。
本研究也证实CRP、IL-6与TNF-α之间存在相关性(P<0.05)。在某些炎症或感染的过程中,IL-6首先被诱导产生,随后作用于肝脏细胞CRP转录的基因,诱导CRP产生。有报道[18]也证实了TNF-α对IL-6有相似的促进作用。炎症因子之间关系较为紧密,并且相互促进,这与我们的研究相符。
本实验也存在不足之处,如缺乏多中心、长时间及更大样本的临床观察过程。且据统计,微炎症状态的主要标志物有十余种,受到时间及成本限制,本研究只选取了3种最具代表性的炎症因子,一些暂时未受到医学界重视的炎症指标有待新的研究进行完善。
综上所述,hs-CRP、TNF-α是影响MHD患者iPTH水平的重要因素,它们可能参与了SHPT的发生及发展,其中hs-CRP是iPTH的独立影响因素,且微炎症因子之间存在相互影响。深入研究MHD微炎症状态对SHPT的影响将来可能为治疗该病提供新的诊疗思路。
