HPV感染病例与P16INK4a 表达的关联研究①
2024-03-22牛爱琴杨苗苗王艳春竞柏松
牛爱琴,杨苗苗,朱 冰,王艳春,竞柏松
(商丘市第一人民医院妇科,河南 商丘 476100)
宫颈癌是世界范围内最常见的妇科恶性肿瘤,其诊断、分期、治疗、病理、预防等一直为近20多年来的研究热点与难点[1]。人类乳头瘤病毒(human papilloma virus,HPV)持续感染是宫颈癌的主要危险因素,90%以上的宫颈癌伴有HPV感染[2]。尽管组织学被认为是宫颈病变诊断金标准,但如宫颈涂片之类的常规筛查容易受到病理医师的主观影响,因此需要更敏感、特异性更高并且可重复的生物标志物来检测宫颈前体和肿瘤病变。
P16INK4a是一种细胞周期素依赖性激酶(cyclin-dependentkinases,CDK)抑制物,而CDK是与细胞周期进程相对应的一套Ser/Thr激酶系统,各种CDK沿细胞周期时相交替活化,磷酸化相应底物,使细胞周期事件有条不紊地进行下去。有研究指出[3-6],P16INK4a表达失调可能与阴道癌、前列腺癌等生殖细胞癌症相关。在细胞周期中[7-9],磷酸化的pRb可与转录因子E2F结合,促使细胞保持G0期或G1早期。而当HPV病毒的E7蛋白和pRb结合后,蛋白活性降低,促使转录因子E2F大量释放,细胞异常殖活跃。在宫颈细胞中,感染HPV病毒后,P16INK4a其作为细胞周期素激酶抑制物,其调控CDK其表达失调,逐步影响下游的生物学行为,可能最终导致P16INK4a丧失对细胞周期的调控功能,从而导致了宫颈细胞的异常增生等生物学行为,与宫颈癌的发生进展相关。
因此,本实验通过大样本病例分析及实验研究P16INK4a与宫颈病变类型,以及P16INK4a与HPV感染的关联性,探讨P16INK4a在宫颈癌发生发展中的作用,为宫颈癌的早期诊断提供新的方法,为宫颈癌早期干预提供循证医学支持,同时对于今后利用基因治疗及研发新的药物预防宫颈疾病的发生可能有重要意义。
1 材料与方法
1.1 病人标本及分组
经医院伦理委员会批准,选取商丘市第一人民医院2020年4月至2023年4月年龄在21~70岁之间的HPV阳性患者404例(包括高危型及低危型),根据每一位患者的病理活检结果分为:鳞状细胞癌(SCC)组(98例),高级别宫颈上皮内瘤变组(HSIL)组104例,低级别宫颈上皮内瘤变(LSIL)组100例,宫颈炎组102例。患者身体状况、肿瘤分期、治疗方式及随访等数据均来自临床病例(实施过程中要排除失访或其他情况的病例)。所有研究对象均通过研究知情同意,均无其他内科合并症,手术前月经周期规律28~35d,无其他妇科疾病及内分泌疾病、无生殖道炎症且半年内均未行激素治疗。
1.2 HPV分型检测
应用QIAGENDNeasy血清组织试剂盒,然后用福尔马林和石蜡进行组织包埋固定,下一步进行实时PCR扩增基因,设定PCR扩增后带约150个碱基对的样品对应于阳性对照扩增子的长度为阳性。应用多重HPV基因分型试剂盒GenotypingKit检测HPV亚型6,11,16,18,26,31,33,35,39,V42,43,44,45,51,52,HPV53,56,V58,59,66,68,70,73和82。设定这些结果的荧光强度中值为10或更高为阳性。
1.3 P16INK4a免疫组化
使用CINtecP16INK4a免疫组化试剂盒依据说明书进行实验。P16INK4a抗体检测使用小鼠单抗人P16INK4a抗体。组织切片以P16INK4a染色,P16INK4a阳性信号定位于细胞核和/或细胞浆。P16INK4a阴性(-)是指宫颈鳞状上皮中P16INK4a局灶着色或无着色。局灶着色指单个细胞、或小团细胞的着色,即不是连续的着色,尤其是基底细胞和副基底细胞之外的不连续着色。P16INK4a阳性是指宫颈鳞状上皮自基底层、到副基底层的细胞呈弥漫、连续着色,而中间层或中间层至表层的细胞着色可有可无。P16INK4a的免疫染色根据分级(阳性细胞百分比)、分布、定位模式和染色强度来评估。采用四级分级法描述阳性染色细胞的比例:<5%细胞为0分(阴性)(图1a);5%-25%细胞为1分;26%-50%细胞为2分,>50%细胞为3分。P16INK4a染色强度分为:弱(1分)、中等(2分)和强(3分)。通过乘以P16INK4a阳性细胞的百分比×染色强度来计算P16INK4aIHC评分。得分范围为0~9分,分为0~3分(+)(图1b)、4~6分(++)(图1c)、7~9分(+++)(图1d)。

图1 P16INK4a免疫组化在宫颈病变中的示意图(sp×100)
1.4 统计学方法
采用GraphPadPrism5.0(GraphPad软件)进行分析。计数资料采用χ2检验(如不符合χ2检验条件,则采用Fisher精确概率法),采用秩和检验比较两组间的P16INK4a免疫组化结果,采用斯皮尔曼(Spearman)秩相关检验对等级资料进行统计学相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较
在本研究中,404例患者中,鳞状细胞癌(SCC)98例,HSIL104例,LSIL100例,宫颈炎102例。单个病例的尖锐湿疣被认为是LSIL类别。年龄21~70岁,年龄中位数49.0岁。71.2%的HSIL病例和79.6%的SCC病例属于>50岁年龄组。孕次与产次在各组中无统计学差异(P>0.05),见表1。

表1 404例患者的临床资料比较
2.2 P16INK4a在不同宫颈病变组织中的表达
免疫组化结果显示:在慢性宫颈炎症组102例中,P16INK4a阳性表达14例,阳性率为13.7%,其中+为14例(13.7%,14/102),无++与+++;在LSIL组中,P16INK4a阳性表达46例,阳性率为46%,其中+为32例(32%,32/100),++12例(12%,12/100),+++2例(2%,2/100);在HSIL组中,P16INK4a阳性表达90例,阳性率为86.5%,其中+为18例(17.3%,18/104),++24例(23.1%,24/104),+++48例(46.2%,48/104);而在宫颈癌组中,P16INK4a阳性表达98例,阳性率为100%,其中+为4例(4.1%,4/98),++24例(24.5%,24/98),+++70例(71.4%,70/98)。趋势χ2检验显示:4种病变中的阳性率的差异有统计学意义(χ2=197.84)。Spearman相关分析表明,P16INK4a阳性表达的γ=0.802(P<0.01),这些数据表明:P16INK4a的阳性率与表达强度随宫颈病变程度的加深而增加,见表2。
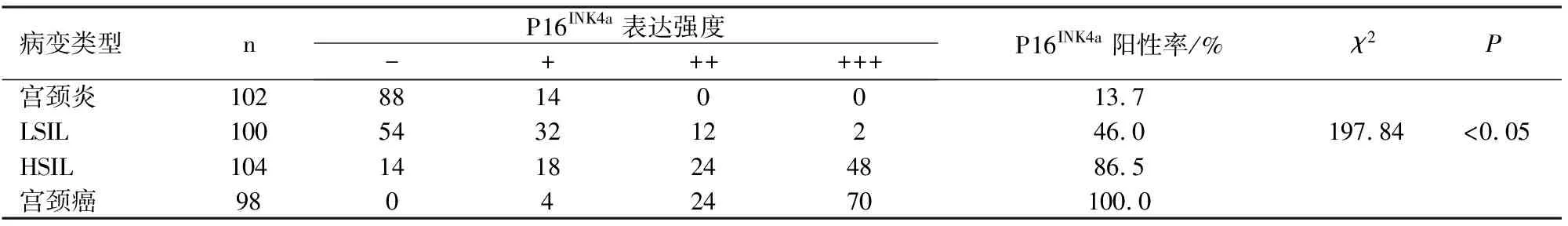
表2 P16INK4a的阳性率与表达强度与宫颈病变的关系
2.3 P16INK4a表达与HPV分型的关系
通过Spearman相关分析法比较,宫颈组织中P16INK4a的表达在低危型与高危型HPV间有显著差异,P16INK4a的表达强度与高危型HPV有相关性(γ=0.745,P<0.001),见表3。

表3 P16INK4a的表达强度与HPV分型的关系
3 讨论
P16INK4a蛋白是一种调节细胞生长和增殖的肿瘤抑制因子,它通常在宫颈癌及其前体中过度表达。P16INK4a在宫颈组织病变中的地位可以提供重要的诊断和预后信息,特别是在人乳头瘤病毒(HPV)感染的背景下[5,6]。在宫颈组织中,P16INK4a的表达通常局限于上皮上层的细胞核。在正常宫颈组织中,只有少数细胞会表达P16INK4a,而在宫颈上皮内瘤变(CIN)和宫颈癌中,P16INK4a通常呈弥漫性强染色。这是因为HPV感染是CIN及宫颈癌的主要原因,导致P16INK4a的表达增加。因此,P16INK4a染色常被用作CIN及宫颈癌诊断的标志物,其强烈的弥漫性染色表明CIN的可能性很高[10]。P16INK4a状态对宫颈病变组织学特征的影响是显著的。在低级别CIN(CIN1)中,P16INK4a的表达通常局限于上皮的下1/3,可能是局灶性或斑片状的。相比之下,高级别CIN(CIN2/3)通常在整个上皮中表现为弥漫性和强P16INK4a染色。宫颈鳞状细胞癌(SCC)也表现出典型的强且弥漫性P16INK4a染色。然而,子宫颈腺癌可能有不同的P16INK4a表达模式,可能不显示弥漫性染色。相比之下,P16INK4a在良性宫颈病变(如宫颈息肉)中的表达通常较低或不表达[11]。然而,也有一些例外,因为P16INK4a在某些良性疾病中也可以表达,例如反应性鳞状皮化生[12]。本研究中P16INK4a蛋白在慢性宫颈炎组织中绝大多数呈阴性表达,而在CIN、宫颈鳞癌组织中主要呈阳性或强阳性表达,随着宫颈病变程度的增加,P16INK4a蛋白的表达强度及染色范围也逐渐升高,与文献的报道一致。经过Spearman相关分析,得出γ=0.784,双侧检验(P<0.05),显示P16INK4a蛋白的表达强度和染色范围表达与宫颈病变的发生发展的机制存在密切关系。
P16INK4a阳性与人乳头瘤病毒(HPV)感染在宫颈组织病变中密切相关,不同宫颈组织病变中P16INK4a阳性与HPV分型的关系是宫颈癌诊断和治疗中尤为重要[13]。HPV分型涉及确定宫颈组织中存在的特定HPV基因型。不同的HPV基因型具有不同的致癌潜力,高危型如HPV-16和HPV-18与宫颈癌的发展密切相关。研究表明,P16INK4a阳性与宫颈组织病变中存在高危型HPV有很强的相关性[14]。具体来说,在正常宫颈组织和其他不太严重的宫颈组织异常可能与低风险HPV类型有关,也可能根本与HPV无关。在这些病例中,P16INK4a的表达水平可能较低或不存在。然而,在宫颈上皮内瘤变(CIN)病变中,高危型HPV感染和P16INK4a过表达是常见的。随着CIN病变中异性增生程度的增加,P16INK4a阳性细胞的发生率也随之增加[15]。事实上,P16INK4a现在被广泛用作CIN病变的诊断标志物,并经常被包括在病理报告中。在浸润性宫颈癌中,HPV感染也与P16INK4a过表达密切相关,P16INK4a在宫颈癌中的过度表达是对高危型HPV存在的反应,特别是HPV16和HPV18,这是与宫颈癌发展相关的最常见类型。当高危HPV感染宫颈细胞时,会产生两种癌蛋白E6和E7,干扰细胞周期的正常调节,促进细胞增殖。E7癌蛋白特异性靶向并降解视网膜母细胞瘤蛋白(pRb),而pRb通常抑制转录因子E2F1的活性。这导致E2F1活性增加,从而促进参与细胞周期进程的基因的转录,包括P16INK4a[16]。在本研究中,宫颈组织中P16INK4a的表达在低危型与高危型HPV间具有显著差异,P16INK4a的表达强度与高危型HPV有相关性,证实P16INK4a阳性和HPV分型的联合评估为宫颈病变的诊断、风险分层和治疗提供了有价值的信息。P16INK4a的高表达与高危HPV基因型的检测同时发生表明宫颈非典型增生或宫颈癌的可能性更高。
综上所述,P16INK4a状态是鉴别高级别CIN和宫颈癌,以及区分这些病变与低级别CIN和正常宫颈组织的有效生物标志物,特别是在HPV感染的背景下。虽然P16INK4a过表达通常与癌前病变和癌性病变相关,但也有一些例外,它与其他诊断工具(如细胞学检测和人乳头瘤病毒检测)结合使用,有助于提高宫颈癌筛查和诊断的准确性。值得注意的是,P16INK4a状态不应单独用于制定治疗决策或预测生存结果。在做出治疗决定和预测预后时,还应考虑其他因素,如病变的分期和分级、其他危险因素的存在以及患者的年龄、病史和其他分子标记物。
