超声辅助低共熔溶剂提取莱菔子中萝卜硫素的工艺优化及其铜绿假单胞菌生物膜抑制活性研究
2024-03-22梁佩云黄钰景陈浩铭曹昊恒吴银冰陈婷婷陈楚汕范红霞郑俊霞
梁佩云,黄钰景,陈浩铭,曹昊恒,吴银冰,陈婷婷,陈楚汕,范红霞,郑俊霞
广东工业大学生物医药学院,广东 广州 510006
莱菔子,别名“萝卜子”“菜子头”,为十字花科莱菔属植物萝卜RaphanussativusL.的干燥成熟种子,归肺、脾、胃经,具有消食除胀、降气化痰等众多功效,其主要活性成分为异硫氰酸酯及硫代葡萄糖苷等,其中萝卜硫素是莱菔子中含量较大的异硫氰酸酯类化合物,因此,从莱菔子中提取萝卜硫素应用于药品和食品领域具有重大意义[1-4]。目前,萝卜硫素的提取主要以溶剂萃取法、酶解法和现代提取技术为主。
溶剂萃取法常用的提取溶剂为二氯甲烷[5-9]、醋酸乙酯[10-15]、丙酮[16]、热乙醇溶液[17]等,然而,有机溶剂易挥发、有毒,对环境有害,此外,废液处理成本高。酶解法是目前人们从植物中获得天然萝卜硫素的主要方法[18],但酶的活性极易受到环境影响和酶的成本较高,且硫苷酶解后存在大量副产物,后续的纯化工作复杂。
现代提取技术主要包括超临界流体萃取[19]、超声波辅助提取[9]和微波辅助提取[20]等仪器分析技术的应用,有效的缩短了萝卜硫素提取时间,提高了提取效率,但对仪器分析的准确度要求高,难以实现大范围推广。因此,寻找绿色溶剂用于莱菔子中萝卜硫素的提取倍受重视。
绿色溶剂的开发促进了现代绿色化学的发展,与传统有机试剂相比,低共熔溶剂(deep eutectic solvents,DESs)具有熔点低、绿色、无毒以及可提高中药化合物提取率等突出优点,是提取中药活性成分的理想试剂,具有广阔的开发前景和商业应用前景[21-23]。低共熔溶剂是指由一定化学计量学比的氢键受体(hydrogen bond acceptor,HBA)和氢键供体(hydrogen bond donors,HBD)组合而成的低共熔混合物,其凝固点显著低于各个组分纯物质的熔点[24-29]。针对DESs 诸多优点,研究人员已将其运用于食品、药品等领域,作为一种绿色提取介质,用于酚酸类[30]、生物碱类[31]、多糖类[32]等活性成分的提取,但DESs 提取莱菔子中活性成分研究仍然有限,且国内报道不多。
因此,本实验采用超声辅助低共熔溶剂提取技术[18,33],研究不同低共熔溶剂对莱菔子中的萝卜硫素提取率的影响,并利用响应面对工艺进行优化;同时采用大孔吸附树脂法回收莱菔子中的萝卜硫素和DESs 溶剂,评价该方法的可持续利用度,以期为DESs 提取该成分提供可靠的理论基础,具体流程如图1 所示。

图1 DESs 提取莱菔子中萝卜硫素的流程Fig.1 DESs extraction process of sulforaphane from Raphani Semen
1 仪器与材料
1.1 仪器
Forma 3111 型超纯水系统,深圳洪森环保科技有限公司;1260 Infinity II 型高效液相色谱仪,支元仪器有限公司;SW-CJ-2FD 型超净工作台,苏州安泰公司;YXQ-LS-70A 型高压灭菌锅、THZ-300 型恒温培养摇床,上海一恒医疗器械有限公司;DWHL100 型−80 ℃超低温冰箱,美国Thermo Fisher Scientific 公司。
1.2 材料
莱菔子药材购于广州市场,经暨南大学生物医药研究院王一飞教授鉴定,为十字花科莱菔属植物萝卜RaphanussativusL.的干燥成熟种子。D-101 大孔树脂、AB-8 大孔树脂、氯化胆碱、乙酸、乙二醇、丙三醇、乳酸、柠檬酸、尿素、乙酰胺等均购于广州化学试剂厂;萝卜硫素对照品,批号CKA454,质量分数99.0%,购于德国Sigma 公司;水解酪蛋白胨(MH)肉汤和MH 琼脂购于青岛海博生物技术有限公司;结晶紫、酸水解酪蛋白、二甲基亚砜(DMSO)等均购于广州市光华科技股份有限公司。
2 方法与结果
2.1 试剂、缓冲液和培养基的配制
2.1.1 A10 溶液、BT 溶液的配制
(1)A10 溶液:由4.785 g Na2HPO4·12 H2O、2.994 g KH2PO4、2.992 g NaCl、1.995 g (NH4)2SO4用超纯水溶解并定容至100 mL,即得。
(2)BT 溶液:由5.549 0 g CaCl2·2H2O(C)、4.760 5 g MgCl2·6H2O(M)、0.135 1 g FeCl3·6H2O(F)先分别加入蒸馏水定容至50 mL,再按500 μL M、50 μL C、500 μL F、450 mL 蒸馏水混合,即得。
2.1.2 PBS缓冲溶液 准确称取磷酸氢二钠1.44 g,磷酸二氢钾0.2 g,氯化钾0.2 g,氯化钠8.0 g 后加入去离子水溶解,调节pH 值至7.4,用超纯水定容至1 L,高温高压灭菌后,冷却,备用。
2.1.3 最简(ABTGC)培养基(含有葡萄糖和酸水解酪蛋白)配制 ABTGC 培养基由A10 溶液、BT溶液、20%葡萄糖溶液及20%酸水解酪蛋白溶液混合配制而成。A10 和BT 溶液分别用高压蒸汽灭菌,冷却至室温后,准确取450 mL BT 溶液,加入50 mL A10 溶液,并加入5 mL 20%葡萄糖及5 mL 20%酸水解酪蛋白(20%葡萄糖及20%酸水解酪蛋白用滤过除菌),混合均匀后置于−4 ℃冰箱,备用。
2.2 前处理
莱菔子样品用去离子水洗净,并在40 ℃干燥后,用中药粉碎机粉碎并过筛(60 目),备用。根据文献报道,用加热搅拌法制备DESs,HBD 和HBA按一定物质的量比在80 ℃左右下加热搅拌,直至形成均一、透明的液体。HBD 和HBA 组合形成不同种类的DESs,如表1 所示。常见的DESs 是由不同配体与氯化胆碱按照一定物质的量比形成的,主要由于氯化胆碱价格便宜、来源广泛、无毒且可生物降解。参考文献报道的方法处理新购买的大孔吸附树脂[30],将其装入洁净的树脂柱内,以95%乙醇洗至流出液加3 倍量水后无白色混浊现象,改用蒸馏水冲洗至无醇味,备用[34]。

表1 不同种类的DESsTable 1 Different kinds of DESs
2.3 对照品溶液的制备及线性关系考察
精密称取萝卜硫素对照品5.0 mg,置于5 mL量瓶中,加入色谱级甲醇稀释至刻度,配制成1.0 mg/mL 的萝卜硫素对照品溶液,然后用1.0 mg/mL对照品溶液分别配制成0.1、0.2、0.3、0.4、0.5、0.6 mg/mL 的系列对照品溶液,进行HPLC 分析。
色谱条件[18,23]:色谱柱为Cosmosil Cholester 柱(250 mm×4.6 mm,5 μm);流动相为水-乙腈;体积流量0.8 mL/min;柱温30 ℃;检测波长201 nm;进样量10 μL;洗脱梯度设置为0~10 min,10%~80%乙腈;10~15 min,80%~100%乙腈。色谱图见图2。

图2 不同质量浓度的萝卜硫素对照品溶液在201 nm 下的HPLC 图Fig.2 HPLC diagram of sulforaphane standard solution with different concentrations at 201 nm
各质量浓度的标准溶液经色谱分析后,以标准溶液的质量浓度为横坐标(X),对照品溶液的峰面积为纵坐标(Y),绘制标准曲线,得到线性回归方程Y=1×107X+5×106,r2=0.999 5,结果表明萝卜硫素在0.1~0.6 mg/mL 呈现良好的线性关系。
2.4 莱菔子中萝卜硫素提取率的计算
精密移取莱菔子提取液0.5 mL,加入色谱级的甲醇溶液0.5 mL,摇匀,在201 nm 下测定溶液中的萝卜硫素的峰面积。将峰面积代入标准曲线求得相应的萝卜硫素质量浓度,再利用如下公式计算莱菔子中萝卜硫素的提取率。
提取率=CVD/M
C为据标准曲线计算求得的萝卜硫素质量浓度,V为上清液的体积,D为稀释倍数,M为样品质量
2.5 莱菔子中萝卜硫素的提取
精密称量莱菔子粉末5.00 g 置于锥形瓶中,按照液料比10∶1 加入DESs 50.0 mL(含水量为30%),混合均匀,静置2 h 后,放入超声仪中,在35 ℃、350 W 下超声提取30 min,冷却至室温,溶液转移至离心管内,8 000 r/min 离心15 min(离心半径10 cm),弃沉淀,量取并记录上清液的体积。同时,选取文献报道[2-3]的莱菔子常用的提取方法(95%乙醇超声提取法),在同等条件下,与本研究的低共熔溶剂提取法进行比较。
2.6 DESs 种类的选择
称取5.0 g 莱菔子粉末8 份于提取器中,分别按照液料比10∶1 加入95%乙醇和物质的量比2∶1 的DESs(DESs-1、DESs-2、DESs-3、DESs-4、DESs-5、DESs-6、DESs-7),其含水量均为30%(含水量指水与溶剂的体积比),超声温度30 ℃、超声时间30 min、超声功率350 W 进行DESs 的选择,实验重复3 次。结果见图3 和表2,各种低共熔溶剂的提取率均高于有机试剂95%乙醇对莱菔子中萝卜硫素的提取率,且7 种低共熔溶剂中DESs-3(乳酸-氯化胆碱)的提取率较其他低共熔溶剂高,故本实验选取DESs-3(乳酸-氯化胆碱)作为提取溶剂。
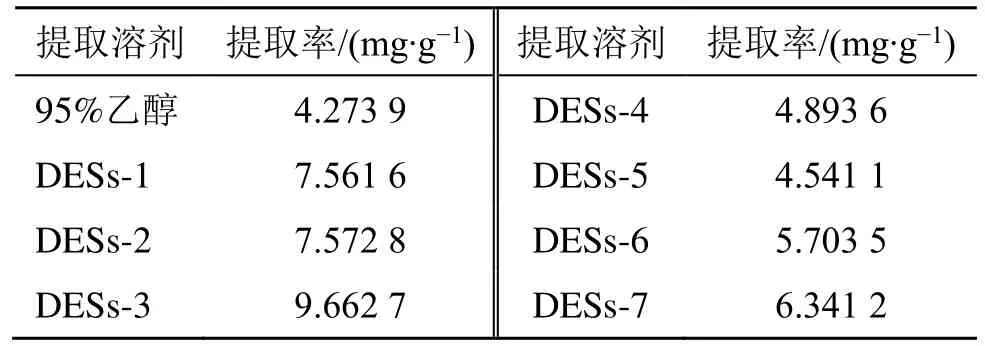
表2 提取溶剂对萝卜硫素提取率的影响Table 2 Effects of extractants on the extraction rate of sulforaphane
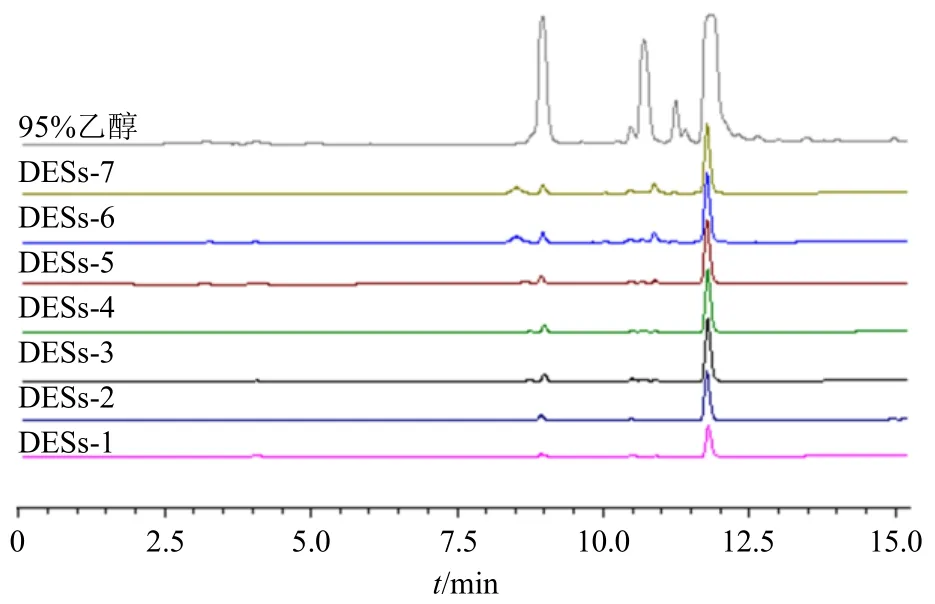
图3 95%乙醇提取液和DESs 提取液在201 nm 下的HPLC 图Fig.3 HPLC images of 95% ethanol extracting solution and DESs extracting solution at 201 nm
2.7 单因素试验考察各影响因素对萝卜硫素提取率的影响
在确定最佳DESs 的种类的基础上,按照“2.5”项下提取方法,精密称量莱菔子粉末5.00 g 置于锥形瓶中,按照液料比10∶1 加入DESs(乳酸与氯化胆碱物质的量比2∶1)50.0 mL(含水量为30%),混合均匀,静置2 h 后,放入超声仪中,在35 ℃、350 W 下超声提取30 min,冷却至室温,溶液转移至离心管内,8 000 r/min 离心15 min(离心半径10 cm),弃沉淀,量取并记录上清液的体积。依次考察乳酸与氯化胆碱物质的量比、含水量、液料比、超声时间、超声温度、超声功率对萝卜硫素提取率的影响。分析上述6 个单因素对莱菔子中萝卜硫素提取的影响程度,并选择其中对莱菔子中萝卜硫素提取率影响程度最大的4 个因素的各自最佳水平进行后续Box-Behnken 设计(Box-Behnken design,BBD)实验。
2.7.1 乳酸与氯化胆碱物质的量比对萝卜硫素提取率的影响 不同乳酸与氯化胆碱物质的量比1∶1、2∶1、3∶1、4∶1、5∶1、6∶1 时,莱菔子中萝卜硫素的提取率分别为7.273 3、9.863 2、15.504 9、15.068 9、8.411 4、4.103 7 mg/g。随着乳酸比例的增加,提取液中萝卜硫素含量快速上升,当乳酸与氯化胆碱的比例为3∶1 时,提取率达到最大值,继续增加乳酸量,萝卜硫素提取率又下降。其原因可能是,在常温下DESs 的黏度很大,增加乳酸的量可降低DESs 的黏度和表面张力,从而增加目标组分的扩散和质量转移能力,使得萝卜硫素的提取率升高;但随着乳酸含量的增多,氯化胆碱含量逐渐降低,又会导致目标组分与DESs 的相互作用减弱,从而使得提取率下降。因此,选择乳酸与氯化胆碱的物质的量比为3∶1,作为物质的量比因素的最佳水平。
2.7.2 含水量对萝卜硫素提取率的影响 不同含水量10%、20%、30%、35%、40%、45%、50%、60%时,莱菔子中萝卜硫素的提取率分别为2.272 8、3.685 0、10.016 0、11.117 5、15.209 1、14.409 2、12.460 4、6.433 2 mg/g。当含水量为40%时,萝卜硫素提取率最大。含水量是影响DESs 提取效率的重要参数,具有调节DESs 的黏度和极性作用。增大含水量会降低DESs 的黏度,同时也会影响DESs的极性,黏度的降低可增加溶剂与莱菔子的接触,进而增加莱菔子中萝卜硫素的提取率;然而含水量过高会使DESs 中的氢键被破坏,削弱了DESs 与莱菔子间的相互作用。故选择40%为含水量因素的最佳水平。
2.7.3 液料比对萝卜硫素提取率的影响 不同液料比为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1 时,莱菔子中萝卜硫素的提取率分别为9.140 1、16.459 1、17.165 0、13.475 6、5.258 4、4.253 3、2.236 3 mg/g。随着液料比的降低,萝卜硫素提取率呈现先增加后降低的趋势,其可能是因为DESs 的体积决定了莱菔子粉末是否能充分浸润、目标化合物能否有效溶出。随着液料比的降低,莱菔子粉末充分浸润,萝卜硫素提取率不断增加,当液料比达到20∶1 时,萝卜硫素提取率达到最大值;此时再降低液料比,增加溶液量,会使得超声破坏莱菔子细胞壁的效果变差,导致部分萝卜硫素无法溶解到溶液中,从而使得其提取率下降。因此,选择20∶1 作为液料比因素的最佳水平。
2.7.4 超声时间对萝卜硫素提取率的影响 不同超声时间10、20、30、35、40、45、50、60 min 时,莱菔子中萝卜硫素的提取率分别为5.154 3、9.068 1、13.026 4、16.382 6、17.709 4、16.802 2、13.795 3、9.028 2 mg/g。在10~40 min 时间段内提取率随着超声时间的增加而上升,原因是超声时间越长,超声对于莱菔子细胞壁的破坏程度越大,萝卜硫素溶解增多,提取率上升;在40~60 min 的时间段内提取率下降,可能是因为随着超声时间的增加,萝卜硫素的溶解率逐渐接近饱和,而其他化合物溶出增多;也可能是超声时间过长对萝卜硫素的稳定性有一定影响,故提取率下降。因此,选择40 min 作为超声时间因素的最佳水平。
2.7.5 超声温度对萝卜硫素提取率的影响 不同超声温度25、30、35、40、45、50、60 ℃时,莱菔子中萝卜硫素的提取率分别为2.575 0、3.013 1、8.647 2、13.785 3、14.539 1、13.407 7、11.936 8 mg/g。随着超声温度的升高,萝卜硫素的提取率先升后降,这是因为随着超声温度的升高,会进一步增加莱菔子细胞壁的破坏程度,加大溶剂与莱菔子中萝卜硫素的传质能力;但随着超声温度再升高,反而会使化合物降解,故提取率下降。因此,选择40 ℃作为超声温度因素的最佳水平。
2.7.6 超声功率对萝卜硫素提取率的影响 不同超声功率200、250、300、350、400、450、500 W 时,莱菔子中萝卜硫素的提取率分别为3.962 8、5.056 2、5.209 5、6.182 4、10.356 4、9.753 1、7.624 3 mg/g。随着超声功率的升高,莱菔子中萝卜硫素的提取率呈现先上升后下降的趋势。原因可能是随着超声功率的升高,高密度涡流和大气泡的产生增加,介质的物理和化学作用增强,提取率提高;但当功率超过一定值时,提取率开始降低,这是因为当功率过高时,产生的高密度涡流和大气泡将使得目标组分的结构发生变化,从而导致提取率下降。因此,选择400 W 作为超声功率因素的最佳水平。
结合单因素实验的结果,以莱菔子中萝卜硫素提取率为响应值比较可知,各因素对莱菔子中萝卜硫素提取的影响程度:超声时间>液料比>物质的量比>含水量>超声温度>超声功率。
2.8 BBD 实验优化提取工艺
2.8.1 BBD 实验设计 采取3 水平4 因素BBD 实验优化莱菔子中萝卜硫素的提取条件。在单因素实验的基础上,以萝卜硫素提取率为响应值,选取乳酸(HBD)与氯化胆碱(HBA)物质的量比(X1)、含水量(X2)、液料比(X3)和超声时间(X4)因素中影响最大的3 水平,分别以−1、0、+1 编码,因素与水平设计见表3,且超声温度和超声功率分别为40 ℃和400 W。利用Design-Expert 软件对各种因素进行回归拟合,优化莱菔子中的萝卜硫素的提取条件。
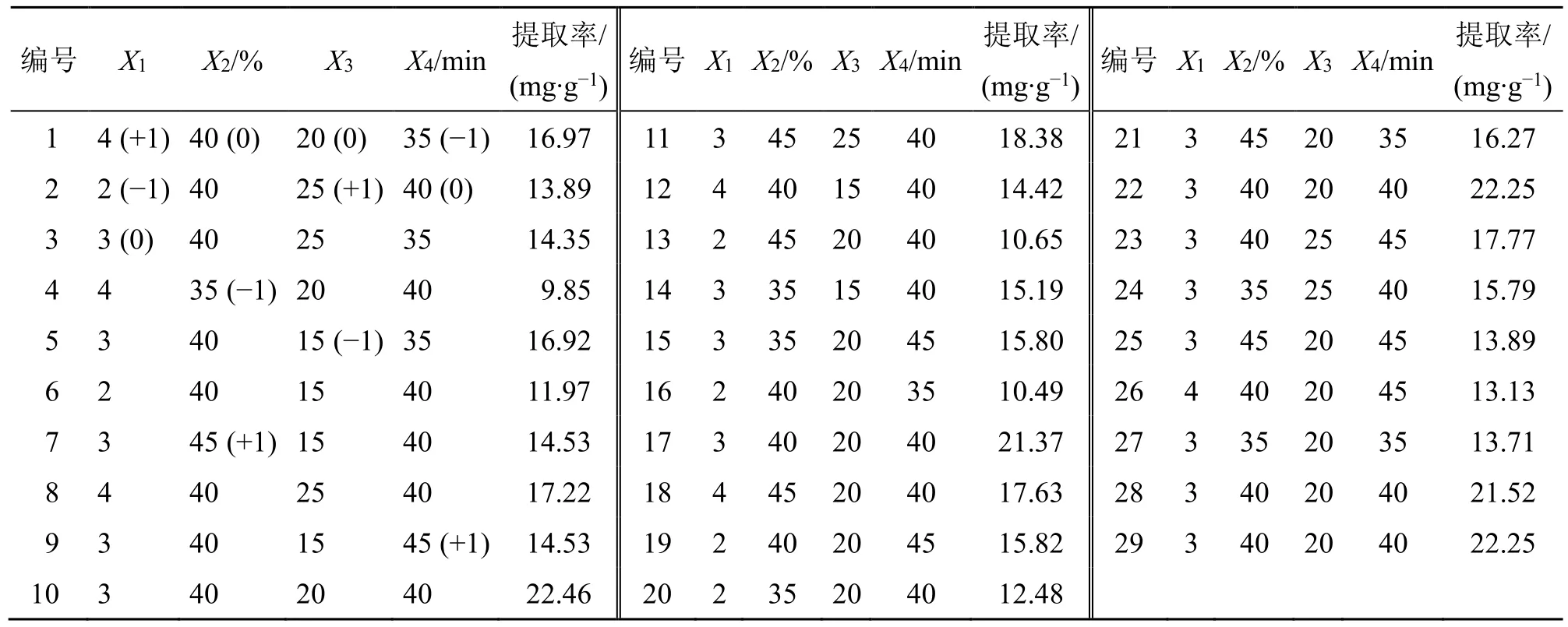
表3 BBD 实验设计与结果Table 3 Experiment design and results of BBD
2.8.2 响应面(RSM)优化提取条件结果分析 采用BBD 实验涉及到3 个水平、4 个因素,具有5 个重复数据用于评价模型变异性和稳定性。BBD 实验表格设计及其实验数据如表3 所示,实验结果如表4 和图4 所示,在数据分析软件中,根据实验数据,采用多元回归拟合分析,以提取率Y为响应值。就能够获得如下的2 次多项回归方程Y=21.97+1.16X1+0.71X2+0.82X3+0.19X4+2.40X1X2+0.22X1X3-2.29X1X4+0.81X2X3-1.12X2X4+1.45X3X4-5.07X12-3.87X22-2.52X32-3.18X42。根据提取率方程的方差分析的结果(表4)可以看出,该回归模型显著(P<0.000 1),失拟项不显著(P>0.05),表明模型拟合程度好,模型回归系数R2=0.969 8,调整后R2=0.939 5,表明该模型与实际提取过程的拟合度良好,方程的可靠性较高。通过对方差数据进行分析,可以得出,在物质的量比(X1)、含水量(X2)、液料比(X3)以及提取时间(X4)4 个1 次项中,物质的量比和液料比对提取率具有极显著影响(P<0.01),含水量对提取率具有显著影响(P<0.05),分析各个因素的主效应关系为X1>X3>X2>X4。2 次项交互作用X1X2、X1X4对提取率具有极显著的影响(P<0.01),X3X4、X2X4对提取率具有显著影响(P<0.05),X1X3、X2X3对提取率的影响不显著(P>0.05)。各个交互因素对提取率影响的显著性顺序排列为X1X2>X1X4>X3X4>X2X4>X2X3>X1X3。根据回归模型的方程,得到的最优提取工艺条件为乳酸与氯化胆碱物质的量比为3.16∶1、含水量为40.82%、液料比为20.96∶1、超声时间为39.94 min、超声温度40 ℃、超声功率400 W;最佳提取率为22.20 mg/g。

表4 响应面回归模型方差分析Table 4 Variance analysis for response surface regression mode

图4 X1、X2、X3、X4 交互作用对莱菔子中萝卜硫素提取率影响的响应面Fig.4 Response surfaces (3D) of effects of interaction of X1, X2, X3 and X4 on extraction rate of sulforaphane from Raphani Semen
2.9 最优提取条件的验证及DESs 重复利用实验
2.9.1 最优提取条件的验证 在DESs 最佳提取条件下提取5.00 g 莱菔子,然后测定莱菔子中萝卜硫素的提取率,并与预测值相比较,从而评价该模型模拟的准确度。在最佳提取条件下进行多次实验可得莱菔子中萝卜硫素的提取率为22.01 mg/g,实验值与预测值(22.20 mg/g)接近,说明该模型模拟结果准确可靠,为莱菔子中萝卜硫素的进一步开发利用提供了一定的理论依据。
响应面分析以及最佳工艺的测定是该研究中决定性的步骤,也是对整个研究的总结,其准确度直接影响了研究的结果。在该步骤中,通过对软件的熟练应用,对响应面实验结果进行了处理,得到了2 次多项回归方程、直观的响应面图、并且完成了本研究的最终目的得到提取莱菔子中萝卜硫素的最佳工艺条件。为超声辅助低共熔溶剂提取莱菔子中的萝卜硫素求出了一种绿色、环保、高效的萝卜硫素提取工艺。
2.9.2 DESs 重复利用实验 取已处理好的3 种不同型号的大孔树脂(D-101、AB-8、HPD600)进行莱菔子中萝卜硫素回收实验。在DESs 最佳提取条件下,精密移取DESs 提取液10 mL,分别加入不同型号的大孔树脂3.0 g 和6.0 g,混合均匀后,在室温下于摇床振摇12 h(150 r/min),至大孔树脂充分吸附溶液后,取上清液用于测定莱菔子中萝卜硫素的吸附率;对吸附饱和的大孔树脂进行滤过,大孔树脂中加入与DESs 提取液等量95%乙醇,振摇6 h(150 r/min),滤过大孔树脂,得95%乙醇解吸附溶液;DESs 溶剂回收利用,用于下一次莱菔子中萝卜硫素的提取,测定其重复利用的萝卜硫素提取率。
绿色化学的发展在很大程度上得利于溶剂的回收。DESs 作为合成溶剂,其蒸气压较低,常规减压浓缩不适合回收溶剂。因此,寻找合适的回收方法对DESs 的进一步发展至关重要。目前报道的文献中,DESs 可用超临界CO2、固相萃取等方法进行回收,但其存在价格昂贵或操作复杂的劣势[35-36]。相比于前者,大孔树脂吸附法具有操作简单、成本低廉等优势,已被用于回收DESs[37]。
本研究考察3 种不同型号的大孔树脂(AB-8、D-101、HPD600)对莱菔子中萝卜硫素吸附率的影响,结果表明(表5),3 种树脂具有一定的吸附率,随着树脂的增加,吸附率明显增加且效果较好,其中,AB-8 吸附率最高达97.49%。当树脂用量均为3.0 g 时,检验结果表明AB-8 吸附效果显著优于D-101 和AB-8。同时,采用95%乙醇对吸附饱和后的AB-8 解吸附,解吸附率达82.63%。因此,采用大孔树脂回收NADESs 简单、有效。萝卜硫素经大孔树脂吸附后,DESs 溶液可被回收利用,用于下一循环继续提取。扣除残留于DESs中的萝卜硫素影响,本实验回收后的DESs 第2 次用于提取莱菔子中的萝卜硫素,其提取率达20.92 mg/g(n=3),回收利用率为95.05%。由此说明,DESs 经大孔树脂吸附后,溶剂完整性较好,可再次回收利用。

表5 不同大孔树脂对莱菔子中萝卜硫素吸附率比较 (n = 3)Table 5 Comparison of adsorption rates of sulforaphane in Raphani Semen by different macroporous resins (n = 3)
2.10 铜绿假单胞菌生物膜抑制实验
2.10.1 铜绿假单胞菌最低抑制浓度(minimum inhibitory concentration,MIC)实验 称取适量样品,用分子生物学级DMSO 溶解,配制256 mg/mL 的母液(萝卜硫素质量分数为22.01 mg/g),并用MH肉汤培养基稀释至一定质量浓度备用(最终培养基中DMSO 不超过0.2%);将过夜培养的菌液,用MH肉汤培养基稀释至在600nm 波长处的吸光度(A600)值为0.01,备用。
细菌MIC 的测定:复苏PA 菌株,统一采用CLSI 推荐的微量肉汤稀释法检测DESs 提取物和抗菌药物(阿奇霉素)的MIC,质控菌株为铜绿假单胞菌[38]。准确移取100 μL 含样品的培养基加入到96 孔板中,并二倍稀释至一系列质量浓度,接种100 μL 稀释后的菌液,同时设置空白组(只加培养基)、对照组(含0.02% DMSO 菌液)、阳性对照组(阿奇霉素),置于37 ℃恒温培养箱中培养24 h 后,观察各质量浓度对应孔的浑浊程度,出现澄清现象时即为细菌的MIC。
检测提取物与阳性对照(阿奇霉素)的MIC,探究提取物对细菌的正常生长是否存在影响,是为了确保其对铜绿假单胞菌生物膜的抑制作用不是通过抑制细菌生长活性实现的,而是基于其他机制的调控达到抑制效果。实验结果表明,与阳性对照组(阿奇霉素)相比,莱菔子的提取物对铜绿假单胞菌具有抑制活性,其MIC 值为256 μg/mL。在远大于MIC 的浓度下研究对细菌的调控,很大程度上避免了对细菌耐药性产生的诱导,可作为群体感应活性抑制剂的初步筛选。
2.10.2 铜绿假单胞菌生物膜抑制实验 采用结晶紫法测定莱菔子提取物对铜绿假单胞菌生物膜的抑制活性[38-39]。将含莱菔子提取物的母液用ABTGC培养基稀释至一定质量浓度,备用(最终培养基中DMSO 含量不超过0.2%);将过夜培养的菌液用ABTGC 培养基稀释至A600=0.01,备用。
准确移取100 μL 含药培养基于96 孔板中,并接种100 μL 稀释后的菌液,同时设置空白组(只加培养基)、对照组(含0.02% DMSO 菌液),阳性对照组(阿奇霉素),96 孔板外周用200 μL 空白培养基封边,每组数据设置6 个复孔;用封口膜包裹96孔板周边,防止培养基挥发,并置于37 ℃恒温培养箱中培养24 h;24 h 后,弃去孔板中菌液,并用PBS 溶液洗净多余浮菌后晾干;向96 孔板中加入120 μL 甲醇,室温固定20 min;弃去甲醇,晾干后加入120 μL 0.1%结晶紫染料,染色15 min;弃去结晶紫染料,并用PBS 溶液洗涤至无多余紫色染料溶出;烘干后,向孔板中加入120 μL 33%冰醋酸溶液,置于摇床上振荡摇匀后,测定A570,计算生物膜的抑制率。
生物膜的抑制率=(A对照-A药敏)/(A对照-A空白)
采用结晶紫染色法,检测莱菔子DESs 提取物对铜绿假单胞菌生物膜的抑制活性,实验结果如表6 所示,4~256 μg/mL 质量浓度下提取物均能抑制铜绿假单胞菌生物膜的形成,且呈良好的量效关系,在最高质量浓度256 μg/mL 下,莱菔子提取物的生物膜抑制率达到53.84%,表明其具有开发为新型群体感应抑制剂的潜力。

表6 莱菔子提取物对铜绿假单胞菌生物膜的抑制率Table 6 Biofilm inhibition rate of extracts from Raphani Semen against P.aeruginosa
3 讨论
本实验考察了超声辅助绿色提取溶剂DESs 用于莱菔子中的萝卜硫素的提取,发现由氯化胆碱和乳酸合成的溶剂为最佳溶剂。经单因素实验和响应面法优化得到超声辅助提取莱菔子中萝卜硫素的最佳条件:物质的量比为3.16∶1、含水量为40.818%、液料比为20.962∶1、超声时间为39.937 min、超声温度40 ℃、超声功率400 W;且最佳提取率为22.199 mg/g。同时,在最佳实验条件下验证,莱菔子中的萝卜硫素的提取率达22.013 mg/g,与预测值(22.199 mg/g)接近,说明该模型模拟结果准确可靠。此外,DESs 经大孔树脂吸附后,溶剂完整性较好,可再次回收利用,说明DESs 提取法具有重复使用、高效、绿色环保等优点。
本研究对DESs 提取液采用群体感应抑制活性实验表明,莱菔子提取液对铜绿假单胞菌生物膜具有一定的抑制活性。生物膜的形成已成为铜绿假单胞菌耐药性增加的主要原因之一,避开传统抗生素的作用靶点,研究特异性针对生物膜的新型抗菌药物已成为研究热点。群体感应系统是细菌间进行交流的“语言系统”,调控生物膜的形成和分散过程。当细菌相互聚集且数量达到一定阈值时,可分泌大量的高丝氨酸内酯类自诱导信号分子,这些信号分子可与菌体相应的双组分调控受体相结合,并通过信号传导调控生物膜的形成[40-41]。因群体感应系统在生物膜形成中起决定性作用,群体感应抑制剂的研发已成为研究的热点,而本实验结果表明,莱菔子DESs 提取物能抑制铜绿假单胞菌生物膜的形成,是一种潜在的群体感应抑制剂。
利益冲突所有作者均声明不存在利益冲突
