Sitravatinib联合Niraparib对黏膜黑色素瘤细胞系增殖、凋亡和自噬的影响及其机制
2024-03-22胡子衿吴晓雯
胡子衿,孔 燕,吴晓雯,郭 倩,郭 军
北京大学肿瘤医院暨北京市肿瘤防治研究所 黑色素瘤与肉瘤内科恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
黑色素瘤(melanoma)起源于黑色素细胞,是一种恶性程度极高的肿瘤,黏膜黑色素瘤(mucosal melanoma,MM)是其中一种起源于黏膜上皮的亚型,在亚洲人群中占比高达39.6%,具有独特的遗传学特性,对免疫治疗应答率低,预后差[1],寻找新的治疗手段成为提高患者生存质量和延长生存时间的关键。
Sitravatinib是一种新型小分子抗血管生成药物,在多种实体瘤中显示出了良好的疗效[2]。Niraparib是一种多聚(腺苷二磷酸[ADP]-核糖)聚合酶抑制剂[poly(adenosine diphosphate[ADP]-ribose) polyme-rase inhibitor,PARPi],主要通过抑制PARP的催化活性,导致同源重组修复(homology-dependent recombination repair,HRR)缺陷的肿瘤无法修复DNA双链损伤,达到合成致死作用,临床上广泛用于治疗BRCA1/2突变的肿瘤亚型[3]。
临床前研究证实,抗血管生成药物主要通过诱导肿瘤微环境低氧和抑制血管内皮生长因子受体3(vascular endothelial growth factor receptor 3, VEGFR3)两种方式来下调HRR水平[4-5],为其与PARP抑制剂联合使用提供了理论支持。在卵巢癌中,已经证实了抗血管生成药物联合PARP抑制剂相较于单药可以提高无BRCA1/2突变患者的生存率[6]。而在黑色素瘤中两者联合使用的研究鲜有报道,本研究拟探讨Sitravatinib联合Niraparib在黏膜黑色素瘤细胞系中的药效及其可能的作用机制。
1 材料与方法
1.1 细胞与试剂
人阴道黏膜来源黑色素瘤细胞系(human vaginal maligant melanoma cell line)HMVⅡ、二甲亚砜(Sigma-Aldrich公司);人外阴黏膜黑色素瘤腹股沟淋巴结转移病灶来源细胞系GAK(JCRB公司);F10、F12培养基、胎牛血清、双抗、胰蛋白酶(Gibco公司);PBS(北京索莱宝科技有限公司);Sitravatinib、Niraparib(Selleck公司);RNA提取试剂盒(艾瑞科生物公司);反转录试剂盒、Western blot loading buffer(TaKaRa公司);RT-qPCR试剂(Toyobo公司);Annexin V-FITC/PI 凋亡检测试剂盒、CCK-8细胞增殖与毒性检测试剂盒(Dojindo公司);引物由北京天一辉远生物科技有限公司设计合成;兔抗cleaved caspase-3多克隆抗体、兔抗cleaved PARP多克隆抗体、兔抗LC3A/B单克隆抗体、兔抗Beclin-1单克隆抗体(CST公司);兔抗辐射敏感蛋白51(radiation sensitive protein 51, RAD51)单克隆抗体和兔抗γ-H2AX单克隆抗体(Abcam公司);PVDF膜与化学发光试剂(Millipore公司)。
1.2 方法
1.2.1 细胞培养与CCK8法测定细胞活力:将HMVⅡ和GAK从液氮中复苏,培养于F10、F12培养基中(含10%胎牛血清和1%双抗),置于37 ℃、5% CO2孵箱中培养至增殖期,待细胞贴壁至汇合度70%~80%,使用胰蛋白酶消化后常规传代。将HMVⅡ和GAK接种于96孔板内(6×103~8×103个/孔),设置一定的Sitravatinib与Niraparib药物浓度梯度,24 h后更换相应药物浓度的新鲜培养基,培养48 h后测定各孔在450 nm波长处的吸光度值(A),以A值代表细胞活力,绘制曲线计算半数抑制浓度(half maximal inhibitory concentration, IC50)。根据IC50设计两种药物不同的浓度组合,在96孔板中培养48 h后测定A值,使用Compu Syn模型评价Sitravatinib和Niraparib对两种细胞系的联合指数(conbination index,CI),CI<1时两药有协同效应,CI=1时两药有加性效应,CI>1时两药有拮抗效应[7]。
1.2.2 实验的分组处理:将对数期的HMVⅡ和GAK接种于6孔板(3×105个/孔),培养24 h后将细胞随机分为4组:control组,Sitravatinib组(2 μmol/L),Niraparib组(20 μmol/L)和联合用药组(Sitravatinib和Niraparib浓度分别为2 μmol/L和20 μmol/L),培养48 h。
1.2.3 细胞集落形成实验检测黑色素瘤细胞的增殖能力:药物处理后收集各组细胞,充分混悬细胞,使用台盼蓝染色法计数细胞。将细胞接种于12孔内(1~2×103个/孔),置于37 ℃、5% CO2孵箱中培养。当培养皿中出现肉眼可见的集落形成时,终止培养。弃去上清液,PBS清洗3次,加入1~2 mL 4%多聚甲醛4 ℃固定细胞15 min。弃去固定液,PBS清洗3次,每孔加入1 mL结晶紫水溶液20 min,弃去染液,PBS清洗数次。晾干后将培养皿倒置拍照。
1.2.4 流式细胞测量术检测药物对黑色素瘤细胞凋亡水平的影响:药物处理48 h后,收集各组细胞,使用台盼蓝染色法计数细胞。加入500 μL PBS轻轻吹打混匀细胞,4 ℃ 1 000 r/min离心3 min,去除上清液,每组加入1×anniexin V binding buffer,制成1×106/mL的细胞悬液(不少于500 μL),取100 μL加入1.5 mL 离心管中,加入5 μL anniexin V-FITC和5 μL PI solution,室温避光孵育15 min,加入400 μL 1×anniexin V binding buffer,在1 h内检测细胞凋亡水平。
1.2.5 Western blot检测目的基因的蛋白质表达水平:药物处理48 h后提取各组总蛋白质,使用BCA法测定各组蛋白质浓度,Western blot具体方法详见文献[8]。使用ImageJ软件分析蛋白质条带吸光度值,蛋白质的相对表达水平用目的蛋白质和内参蛋白GAPDH条带的吸光度值比值表示,使用Graphpad Prism9软件进行可视化。
1.2.6 RT-qPCR检测目的基因的mRNA表达水平:药物处理48 h后提取细胞内RNA,按照反转录试剂盒内说明书完成反转录实验后进行RT-qPCR实验。RT-qPCR步骤请见文献[8] 。以GAPDH为内参基因,目的基因的mRNA的相对表达量根据Ct值计算2-ΔΔCt,使用Graphpad Prism9软件进行数据可视化。

表1 RT-qPCR引物序列Table 1 Primer sequences used for RT-qPCR
1.3 统计学分析

2 结果
2.1 Sitravatinib与Niraparib具有协同抑制作用
两种药物在HMVⅡ、GAK中单药IC50值(图1A)。依据单药IC50设计两药联合浓度梯度,根据A值计算CI值(图1B),两种药物在特定浓度下可对细胞增殖发挥协同抑制作用。进一步,选择Sitravatinib(2 μmol/L)和Niraparib(20 μmol/L)进行后续实验。

A.IC50 of Sitravatinib and Niraparib in mucosal melanoma cell lines; B.combination index (CI) in HMVII and GAK cells at different drug concentrations (μmol/L).
2.2 Sitravatinib与Niraparib联合治疗抑制黏膜黑色素瘤细胞增殖
药物处理48 h后,联合组较单药组显著抑制HMVⅡ和GAK细胞集落形成(P<0.05或P<0.01或P<0.001)(图2A, B)。
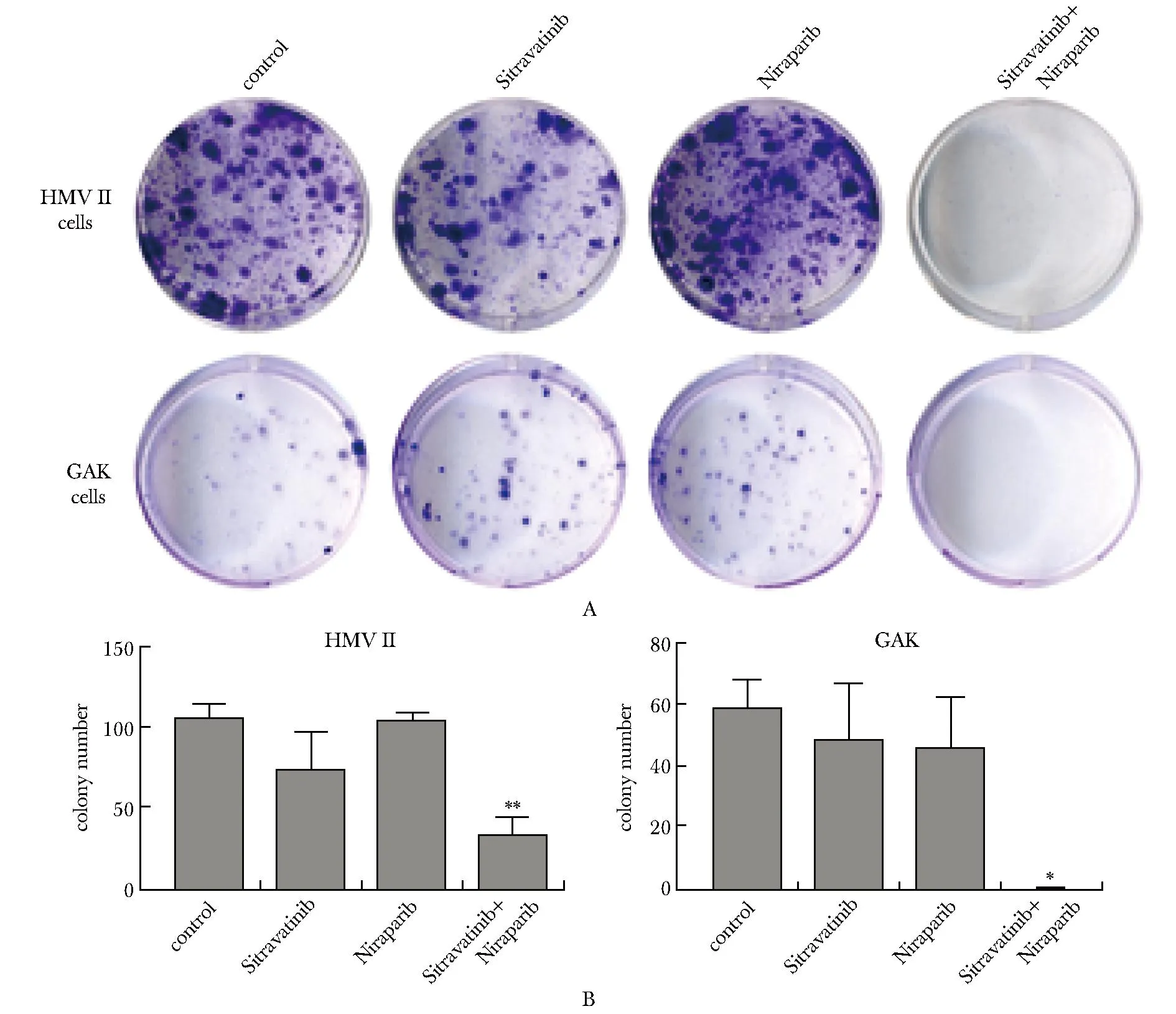
Sitravatinib.2 μmol/L; Niraparib.20 μmol/L;A.combination therapy inhibited colony formation ability in cells; B.data analysis of colony formation assay in cells; *P<0.05,**P<0.01 compared with control.
2.3 Sitravatinib与Niraparib联合治疗促进黏膜黑色素瘤细胞凋亡
与单药组相比, 联合组处理48 h后显著提高了细胞凋亡比例(P<0.01或P<0.001)(图3A);联合组细胞凋亡标志物cleaved caspase-3与cleaved PARP的蛋白表达水平显著升高(图3B),caspase-3 mRNA表达水平明显升高(图3C)(P<0.001)。

Sitravatinib.2 μmol/L; Niraparib.20 μmol/L; A.effect of combination therapy on apoptosis of HMVⅡ and GAK cells was detected by flow cytometry; B, C.expression of apoptosis-related biomarkers were detected by Western blot and RT-qPCR; *P<0.05 compared with control.
2.4 Sitravatinib与Niraparib联合治疗促进黏膜黑色素瘤细胞自噬
联合组自噬标志物LC3II/LC3I比值、Beclin-1蛋白表达量显著升高。LC3、Beclin-1 mRNA表达量显著升高(P<0.01,P<0.001)(图4B)。
2.5 Sitravatinib与Niraparib联合治疗可诱导HRR缺陷
与对照组和Niraparib单药组相比,Sitravatinib单药组或联合组中,RAD51的蛋白表达量均明显降低。联合组的γ-H2AX蛋白表达量较单药组与对照组明显上升(图5A)。
随着Sitravatinib的剂量升高至2 μmol/L,RAD51的蛋白和mRNA表达量明显下降(P<0.05或P<0.01), BRCA1和BRCA2 mRNA表达明显下降(P<0.05或P<0.01或P<0.001)(图5B, C), NHEJ1、XRCC5 mRNA表达差异无统计学意义 (图5D)。
3 讨论
黏膜黑色素瘤好发于亚裔人群,肿瘤突变负荷低, 可选择的靶向药物少, 对免疫治疗反应差, 患者生存期短,预后不良[9]。最近有研究证实基于抗血管药物的治疗方案对黏膜黑色素瘤有效[10]。
既往研究证实,在卵巢癌中,抗血管抑制剂与PARP抑制剂联合使用可促进细胞凋亡[11]。本研究发现,在选定的联合浓度下, HMVⅡ和GAK细胞中联合组细胞凋亡水平显著增高。自噬与细胞凋亡存在复杂的相互作用,如BCL-2可抑制Beclin-1依赖的细胞自噬[12]。自噬发生时,LC3Ⅰ被类泛素化修饰后与磷脂酰乙醇胺耦联形成LC3Ⅱ,LC3Ⅱ在自噬体形成过程中起重要作用,随后自噬体与溶酶体融合,被吞噬的分子或细胞组分被蛋白酶水解[13]。本研究发现,联合治疗可显著增强HMVⅡ与GAK的细胞自噬程度。
“合成致死”是一种靶向治疗的新方向,即两种基因干扰的组合可以导致肿瘤细胞死亡。在一些基因突变率较低的肿瘤,使用药物诱导“合成致死”效应成为当前研究的热点[3]。许多研究证实了抗血管生成药物通过各种机制影响肿瘤细胞的HRR,其中比较明确的是通过抑制血管生成诱导肿瘤微环境低氧,从而导致RAD51、BRCA1/2等HRR因子的下调[4]。在最近的卵巢癌研究中,证实了抗血管生成药物可不依赖诱导低氧直接削弱HRR水平,并在这一基础上联合PARP抑制剂显著抑制了肿瘤的生长[11]。本研究证实,抗血管生成剂Sitravatinib在浓度为2 μmol/L时可降低HMVⅡ和GAK细胞的HRR因子表达水平,与此同时,并不抑制非同源末端连接(non-homologous end-joining, NHEJ)因子表达水平,提示 Sitravatinib可能通过诱导HRR下降,联合Niraparib导致“合成致死”效应,损伤DNA修复能力,进而抑制细胞增殖能力并促进细胞凋亡和细胞自噬。
综上所述,Sitravatinib联合Niraparib可显著抑制黏膜黑色素瘤细胞系HMVⅡ和GAK的细胞增殖,促进细胞凋亡和细胞自噬,且可能与Sitravatinib损伤HRR有关,为两者联合应用于黑色素瘤的治疗提供了参考依据。
