C12ORF66对MYCN扩增的高危神经母细胞瘤细胞的活性调控
2024-03-22贾安娜战世佳郭金鑫于永波郭永丽
贾安娜,战世佳,张 璇,郭金鑫,于永波,郭永丽,常 艳
国家儿童医学中心 首都医科大学附属北京儿童医院 儿科重大疾病研究教育部重点实验室 北京市儿科研究所儿童耳鼻咽喉头颈外科疾病北京市重点实验室,北京 100045
神经母细胞瘤(neuroblastoma,NB)是一种最常见的儿童颅外恶性实体瘤,诊断年龄多在5岁前,确诊平均年龄约2岁[1]。NB约占儿童恶性肿瘤的7% ~ 8%,病死率占所有儿童肿瘤的15%左右[2]。MYCN扩增NB是一种高度侵袭性NB亚型,在NB的发病机制中,MYCN扩增产生的N-Myc蛋白发挥关键作用[3]。然而,由于N-Myc蛋白结构中无药物“结合口袋”,被认为是无药可靶向的蛋白质。因此,解析MYCN扩增高危NB中其他高表达基因,探究间接靶向MYCN的新策略具有重要的临床意义。
12号染色体开放阅读框66(chromosome 12 open reading frame 66,C12ORF66)作为KICSTOR四元蛋白复合体的一部分,在TORC1信号通路的氨基酸敏感分支中发挥作用[4]。KICSTOR(a four-numbered protein complex composed of the KPTN, IIFG2 C12ORF66,SZT2)是一种溶酶体相关因子,在氨基酸缺乏情况下,对细胞增殖和代谢的中央调节因子雷帕霉素复合物1激酶(rapamycin complex 1 kinase,mTORC1)进行负调控[5-6]。有研究表明,微阵列数据鉴定显示C12ORF66能够显著预测结直肠癌患者的生存[7],揭示C12ORF66在肿瘤进展中可能发挥重要作用,然而C12ORF66对神经母细胞瘤的作用和调控机制还未见报道,亟待进一步的实验探究。
本研究拟分析MYCN扩增和非扩增NB临床样本和细胞系中C12ORF66的表达水平,以及C12ORF66的表达量与患儿预后的相关性。进一步构建C12ORF66敲低MYCN扩增NB细胞株,通过集落形成、Ki67免疫荧光染色、实时无标记细胞分析系统(real time xCELLigence analysis system,RTCA)比较对照组和敲低组细胞活性变化,为MYCN扩增NB的靶向治疗提供实验室依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:人胚肺成纤维细胞系IMR-90、人永生化视网膜上皮细胞系hTERT RPE-1、MYCN非扩增神经母细胞瘤细胞系CHLA-255 和SH-SY5Y、MYCN扩增神经母细胞瘤细胞系BE(2)-C和SK-N-BE(2)[美国细胞培养物收藏中心(American Type Culture Collection,ATCC)或国家实验细胞资源共享服务平台(National Infrastructure of Cell-line Resource,NICR)]。
1.1.2 试剂(盒):DMEM,MEM,MEM/F-12,Iscove′s DMEM,DMEM/F-12培养基及胎牛血清(Corning公司);青链霉素双抗(北京中科迈晨科技有限公司);胰蛋白酶(江苏凯基生物技术股份有限公司);实时荧光定量PCR引物(北京六合华大基因科技有限公司);Lipofectamine RNAi MAX 转染试剂(Invitrogen公司);结晶紫溶液(上海碧云天生物技术有限公司);反转录试剂盒(TaKaRa公司);小鼠抗人Ki-67单克隆抗体(Cell Signaling Technology公司)。
1.2 方法
1.2.1 细胞培养:IMR-90细胞置于MEM培养基,hTERT RPE-1细胞置于DMEM/F-12培养基,BE(2)-C细胞置于MEM/F-12培养基,CHLA-255细胞置于Iscove′s DMEM培养基,SK-N-BE(2),SH-SY5Y置于DMEM培养基中培养。培养基中含有10% FBS和1%青链霉素双抗。细胞接种于培养皿中,置于5% CO2,37 ℃培养箱中持续培养,细胞汇合度至80%以上将细胞传代,0.25%胰蛋白酶消化细胞,800 r/min离心3 min收集细胞,将细胞传代至新的培养皿中。
1.2.2 R2数据库分析C12ORF66在NB中的表达:利用R2数据库(http://r2.amc.nl)GSE16476和GSE49710数据集分析MYCN扩增和非扩增NB患儿中C12ORF66的表达情况,以及C12ORF66的表达与患儿预后生存状态的关系。
1.2.3 构建瞬时敲低C12ORF66SK-N-BE(2)细胞:将 SK-N-BE(2)细胞接种于含有培养基的6孔板中,细胞汇合度达到30%时,使用Lipofectamine RNAi MAX试剂盒进行siRNA转染。设置siCtrl对照组和siC12ORF66-1#和siC12ORF66-2#实验组,siRNA转染终浓度为60 nmol/L,转染时间为72 h。靶向序列为GGACCAGTATCCAGCTGTA和GGCC CAATGTCATCATGAT。
1.2.4 构建稳定敲低C12ORF66SK-N-BE(2)细胞株:选择与siRNA相同的靶序列,构建靶向敲低C12ORF66的慢病毒短发夹RNA(shRNA),shC12ORF66-1#和shC12ORF66-2#。构建C12ORF66敲低质粒,对质粒进行提取纯化。培养细胞,当细胞汇合度达到30%时将病毒液和新鲜细胞培养基混匀,加入到目的细胞中。感染24 h后更换新鲜培养基,感染72 h后对感染效果和敲低效果进行测定。
1.2.5 RT-qPCR检测C12ORF66mRNA表达:采用Frizol法细胞中加入Trizol,再依次加入三氯甲烷、异丙醇、乙醇提取RNA。Nano drop 2000测定RNA浓度和纯度。使用反转录试剂盒将RNA反转录为cDNA。反转录体系为1 μg RNA,5×reverse transcription PCR Mix 2 μL,无RNA酶H2O补足10 μL。以GAPDH为内参,2-ΔΔCt法计算基因在mRNA水平的表达情况。
1.2.6 平板集落形成实验检测细胞增殖:将慢病毒感染的细胞以600个/孔(6孔板)的密度接种,5% CO2,37 ℃细胞培养箱中培养,观察细胞增殖状态并每隔3 d更换1次培养基。14 d后,显微镜观察细胞团直径大于1 mm时终止培养。4%多聚甲醛固定细胞并对细胞进行结晶紫染色,显微镜下拍照并利用AlphaView SA软件对细胞集落进行计数。
1.2.7 实时无标记动态细胞分析监测细胞增殖:将5×103细胞接种到E-plate 16孔板中,5% CO2,37 ℃细胞培养箱中培养,通过RTCA细胞功能分析仪对细胞进行实时检测,100 h后,对结果进行分析并绘制细胞增殖曲线。
1.2.8 免疫荧光检测细胞Ki67阳性率:将siCtrl对照组和siC12ORF66-1#,siC12ORF66-2#实验组细胞以3×104接种在预先铺好玻片的24孔板中,培养48 h后,4%多聚甲醛固定细胞10 min,用PBS冲洗干净,0.3% Triton X-100冰上打孔,3% BSA室温封闭1 h。Ki67一抗4 ℃孵育过夜后,加入带有荧光的二抗孵育1 h。加入Hoechst 33342对细胞核进行染色,染色完成后封片,并置于扫描共聚焦显微镜下观察和图像采集。
1.3 统计学分析

2 结果
2.1 C12ORF66在MYCN扩增NB样本中高表达,且与患儿总生存率负相关
与MYCN非扩增的NB样本相比,C12ORF66在MYCN扩增NB样本中表达量显著较高(图1A, C)。C12ORF66高表达患者的生存率显著低于C12ORF66低表达患者(图1B, E)。此外,GSE49710数据集显示C12ORF66在高危NB中的表达显著高于非高危NB(图1D)。
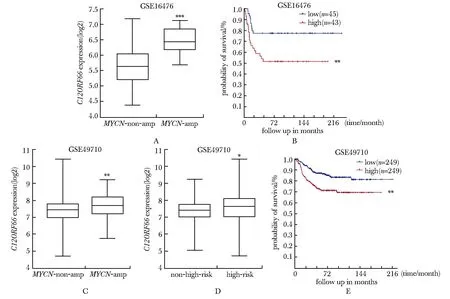
A, C.expression level of C12ORF66 in MYCN amplified(MYCN-amp) or MYCN-non-amp clinical patient samples; B, E.overall survival rate; D.C12ORF66 expression in high-risk and non-high-risk clinical samples; *P<0.05, **P<0.01, ***P<0.001 compared with the indicated group.
2.2 C12ORF66在MYCN扩增NB细胞中表达量高于MYCN非扩增细胞和正常组织永生化细胞
C12ORF66在MYCN扩增细胞BE(2)-C、SK-N-BE(2)中的表达量显著高于MYCN非扩增NB 细胞CHLA-255、SH-SY5Y和正常组织永生化细胞IMR-90、hTERT RPE-1(图2)。
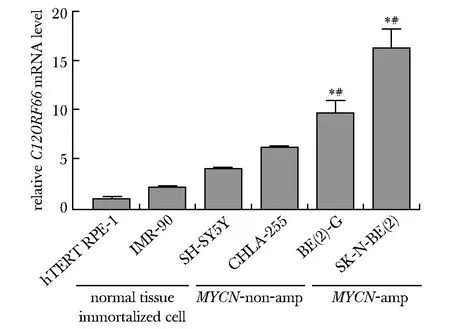
amp.amplified; C12ORF66 mRNA levels in different NB cell lines; *P<0.001 compared with hTERT RPE-1 or IMR-90 group;#P<0.001 compared with CHLA-25 or SH-SY5Y group.
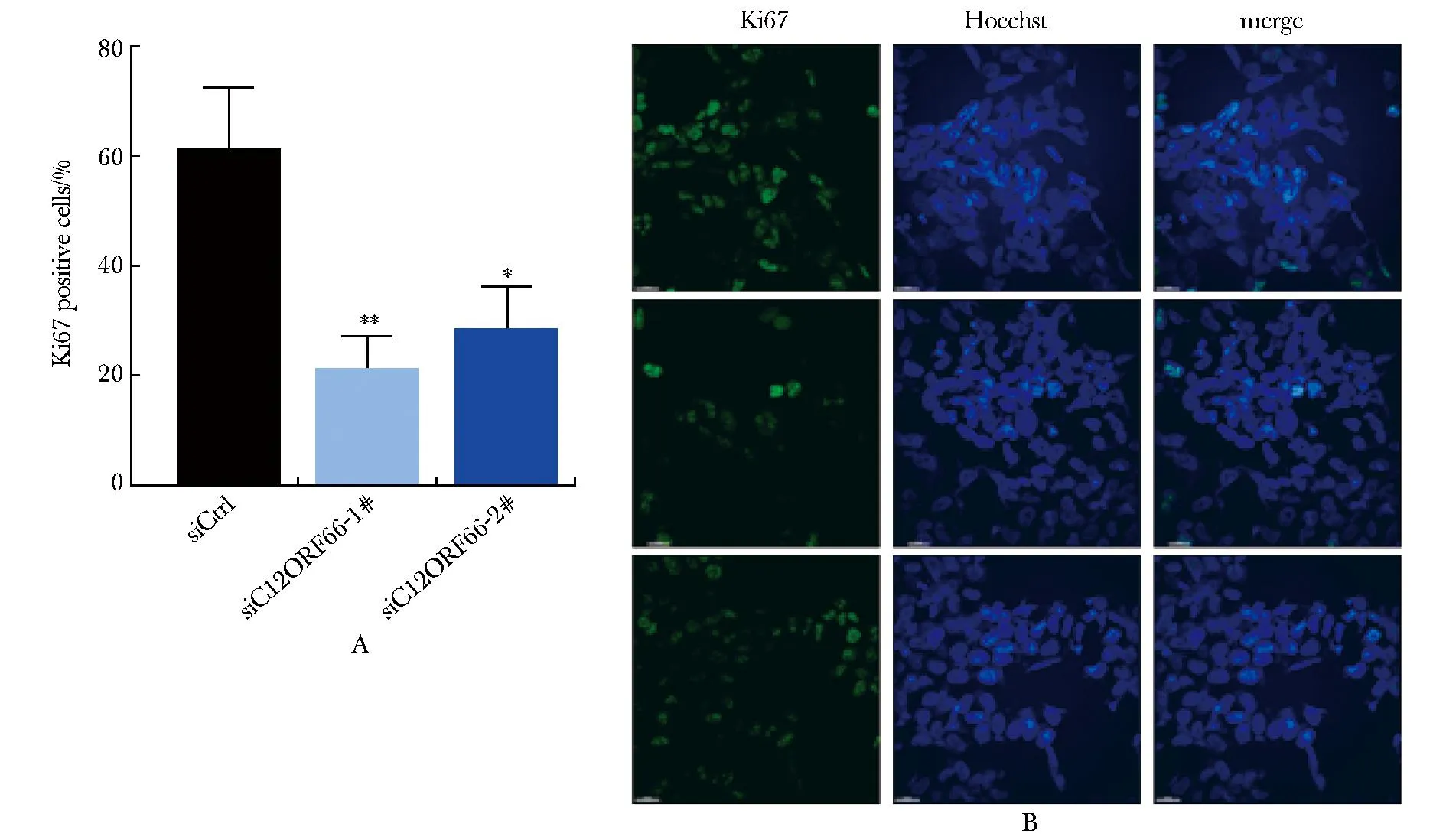
A, B.representative images and statistical plots of Ki67 immunofluorescence staining; *P<0.05, **P<0.001 compared with the siCtrl group (scale bar=20 μm).
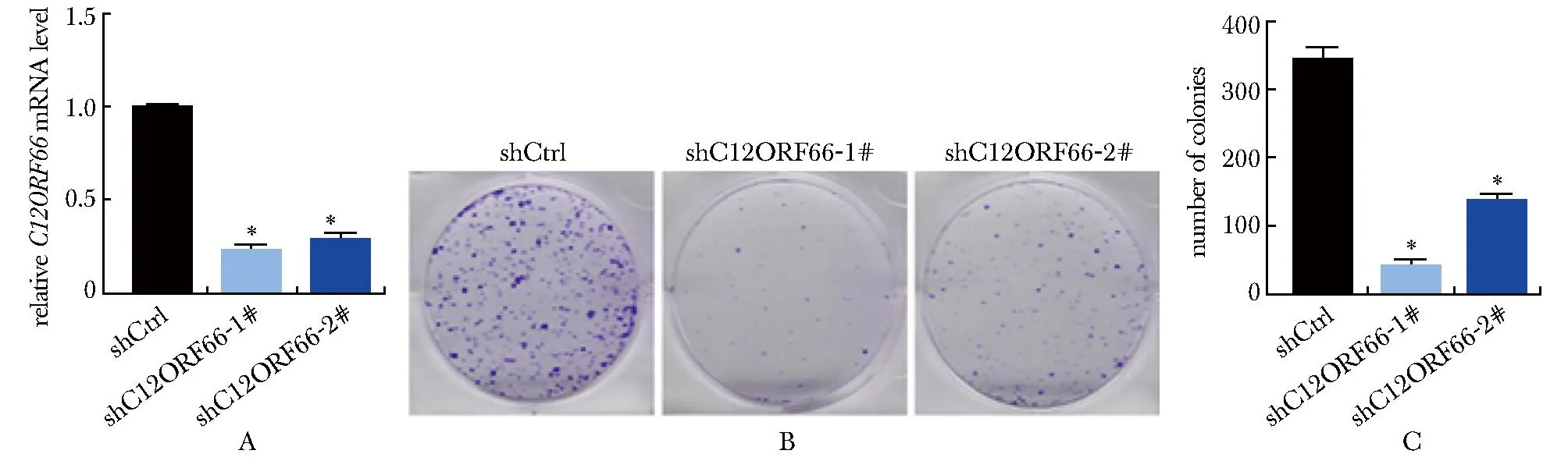
A.mRNA expression level of C12ORF66 in SK-N-BE(2) cells was detected by RT-qRCR; B, C.representative photos and statistical plots of SK-N-BE(2) cells colony formation; *P<0.000 1 compared with the shCtrl group.
2.3 瞬时敲低C12ORF66抑制MYCN扩增NB细胞增殖
敲低C12ORF66后,C12ORF66的mRNA表达量显著降低(图3A)。与siCtrl组相比, siC12ORF66-1#组和siC12ORF66-2#组结晶紫染色相对面积减小(图3B, C),伴随时间进展,C12ORF66敲低组细胞指数显著降低,细胞增殖能力下降(图3D)。
2.4 瞬时敲低C12ORF66降低MYCN扩增NB细胞Ki67阳性率
对SK-N-BE(2)细胞进行Ki67免疫荧光染色,与siCtrl组相比,siC12ORF66-1#组和siC12ORF66-2#组Ki67阳性细胞比例均显著降低(图 4A, B)。
2.5 稳定敲低C12ORF66抑制MYCN扩增细胞增殖
与shCtrl对照组相比,稳定敲低shC12ORF66-1#组和shC12ORF66-2#组SK-N-BE(2)细胞C12ORF66mRNA表达水平降低(图5A),集落形成能力降低(图5B, C)。
3 讨论
NB起源于交感神经系统细胞,尤其是肾上腺祖细胞分化的肾上腺嗜铬细胞和交感神经节细胞[8]。NB患儿的临床表现、诊疗、预后等都存在巨大差异,NB可能出现自发消退或者广泛肿瘤转移。根据患儿的死亡风险,可以将患儿分为极低危,低危,中危和高危。中低危患儿经过手术切除、化学治疗(化疗)甚至自发肿瘤消退,生存率超过90%。然而,高危患儿在经过诱导化疗、大剂量化疗联合自体干细胞移植和放疗,以及抗双唾液酸神经节苷脂(disialoganglioside,GD2)和细胞因子的维持治疗后,5年生存率仍低于50%[9]。MYCN扩增是神经母细胞瘤不良预后的强指标。在发育分化过程中,MYCN的短暂低表达可以促进神经嵴细胞迁移和神经元命运决定。然而,MYCN在交感肾上腺谱系中持续高表达会导致交感母细胞增生甚至神经母细胞瘤形成。神经母细胞瘤风险组分期系统(International Neuroblastoma Risk Group Staging System,INRGSS)显示,NB细胞中一旦检测到MYCN扩增,就会被划分为高危[10-11]。本研究旨在分析MYCN扩增高危NB与非扩增NB的差异表达基因,并通过细胞水平功能实验探究,为MYCN扩增NB的治疗提供实验依据。
本研究通过对临床数据库分析,发现C12ORF66在MYCN扩增高危NB中高表达,并且MYCN扩增与患者的不良预后相关。NB细胞结果显示,C12ORF66在MYCN扩增NB细胞中的表达显著高于MYCN非扩增NB细胞和正常组织永生化人源细胞。MYCN扩增NB细胞SK-N-BE(2)的集落形成、RTCA、Ki67免疫荧光染色结果表明,敲低C12ORF66显著抑制MYCN扩增NB细胞活性,提示C12ORF66在MYCN扩增NB发生发展中发挥重要作用,C12ORF66与MYCN扩增NB肿瘤进程负向相关。C12ORF66作为KICSTOR的成分,定位于溶酶体,与mTORC1负向调控子GATOR1(GTPase activating protein for RasA)复合体结合并将其招募到溶酶体膜表面,影响细胞的增殖、自噬。研究表明,KICSTOR复合体的另一成分SZT2(seizure threshold 2)缺乏,会影响包括脑部神经在内几个组织中mTOR信号的激活[12]。KICSTOR复合体及其成分C12ORF66在肿瘤发生发展中的作用均鲜有报道,本研究重点关注C12ORF66调控NB细胞活性的研究,为靶向C12ORF66的肿瘤治疗提供了理论基础。
综上,本研究结合临床数据库和功能实验,发现C12ORF66在MYCN扩增NB中高表达,且与患儿的较差生存率密切相关;细胞水平的功能实验表明,敲低C12ORF66抑制MYCN扩增NB细胞活性,C12ORF66有望成为NB进展的标志分子和潜在治疗靶点。
