复合型治沙措施对土壤细菌群落结构及功能的影响
2024-03-22王安林马瑞马彦军刘腾田永胜董正虎柴巧弟
王安林,马瑞,马彦军,刘腾,田永胜,董正虎,柴巧弟
(甘肃农业大学林学院,甘肃 兰州 730070)
全球气候变暖和人类不合理的活动加剧了土地荒漠化进程[1-3],致使荒漠化防治成为近半个世纪以来亟待解决的重要生态环境问题[4]。作为荒漠化主要形式之一的沙漠化更是显著影响我国西北干旱半干旱地区经济社会可持续健康稳定发展的关键因素[5-7]。得益于几十年来专家学者对沙漠化防治技术的研究积累,“机械沙障+人工植被固沙”等治沙措施遵循改变近地层气流结构,减弱风蚀,稳固植物群落,提高土壤养分等基本一致的生态学原理[8-10],在西北沙漠化土地修复方面效果显著[11]。水、土、气、生和沙5个荒漠生态系统主要组成要素的恢复过程是沙漠化防治的关键所在,至今为止专家学者对此进行了充分研究。马瑞等[12]、Liu 等[13]和Alamusa 等[14]研究发现,固沙措施不仅增加了植被覆盖和地上生物量,而且显著提高了表层土壤含水量,同时减少了土壤水分的深层渗透和侧向迁移。亦有研究发现机械沙障及人工植被固沙等措施可显著改良土壤理化性质等生境质量,具体表现为土壤质量指数提高、土壤有机碳储量、氮和磷等养分含量显著增加[15-17]。此外郭秋菊等[18]、Chang 等[19]和Sun 等[20]研究发现复合型固沙模式对风速、气温和空气相对湿度等气候因子也产生了积极效应。
土壤不仅是结构复杂的非均质生态系统,而且还是维系陆地生态系统功能和服务的重要载体[21]。土壤微生物更是在主导生物地球化学循环,土壤生态系统结构和功能稳定方面扮演重要角色[22-23]。一方面表现为土壤微生物活动加速凋落物和腐殖质分解[24],调控土壤肥力转化利用和植物养分吸收[25],促进植物—微生物体系共生固氮等[26];另一方面土壤微生物群落结构及功能对环境因子改变的响应极为敏感,包含丰富的区域土壤环境变化信息[27]。尤其以细菌为主的土壤微生物群落更是数量大、种类多、结构复杂、适应极端生境能力强,已被广泛作为评价土壤生态系统生境质量的重要指示物种[28-29]。随着16S rRNA 高通量测序和PICRUSt2 宏基因组功能预测技术的兴起,为解释土壤微生物群落结构服务不同生态系统功能稳定提供了新途径[30]。土壤微生物生态系统结构和功能及生态脆弱性对不同立地条件生境变化的响应已是国内外学者探究土壤微环境生态承载力的热点研究问题。丁钰珮等[30]和Cao 等[31]研究发现固沙植被樟子松(Pinus sylvestris)栽植不仅显著改善了土壤细菌群落结构,而且使土壤细菌代谢功能更加活跃。An 等[32]通过研究荒漠绿洲过渡带梭梭(Haloxylon ammodendron)46 年的生长过程,发现植被恢复后土壤细菌群落多样性和丰富度显著增加。Yu 等[33]研究发现科尔沁沙地小叶锦鸡儿属(Caragana)固沙植被恢复过程中土壤微生物和非生物生态之间存在显著正向互馈作用。
荒漠生态系统土壤养分匮乏,生态环境脆弱,人工固沙植被的栽植与恢复过程导致土壤理化性质发生显著变化,从而可能影响到土壤细菌群落分布特征,而这些土壤细菌群落结构的演替变化又将影响土壤细菌代谢活动和土壤养分转化利用,最终导致地上植被和生物量的改变[24,34]。然而,以往的研究大多集中于单一固沙措施(植被固沙)对土壤细菌群落特征的影响,对于机械沙障+固沙植被复合型治沙措施对土壤细菌群落结构和代谢功能的影响研究甚少。鉴于此,本研究以民勤荒漠绿洲过渡带流动沙丘梭梭林地土壤为对照,以尼龙网格沙障区梭梭林土壤和黏土沙障区梭梭林土壤为研究对象,探究复合型治沙措施区土壤细菌群落结构和功能及影响机制,对于深入理解复合型治沙措施的实施对荒漠土壤微环境稳态的改善以及丰富沙化土地生态功能修复提供理论参考。
1 材料与方法
1.1 研究区概况
研究区地处巴丹吉林沙漠东南缘和腾格里沙漠夹缝的民勤荒漠绿洲过渡地带(38°45'01''-39°26'45'' N,103°16'10''-103°18'24'' E),海拔1298.13~1342.73 m。该地区光热资源丰富,降水分布不均,年均降水量113.9 mm,蒸发量2613.5 mm,属于典型的干旱荒漠气候。年平均风速3.1 m·s-1,且主要以风沙土为主。现有植被类型包括梭梭、沙拐枣(Calligonum mongolicum)、白刺(Nitraria tangutorum)和红砂(Reaumuria soongarica)等[11]。
1.2 土壤采集与理化分析
于2022 年植被生长旺季(7 月12 日),在民勤西沙窝老虎口防沙治沙区进行野外调查和土样采集,该区域治沙措施均大面积布设于2008 年。本研究以尼龙网格沙障区人工梭梭林(nylon net sand barrier+Haloxylon ammodendron, Nn)和黏土沙障区人工梭梭林表层土壤(clay sand barrier+Haloxylon ammodendron, Cy)为试验组,以流动沙丘+人工梭梭林地表层土壤(active sand dune, Asd)为对照组(表1)。土壤样品采集:在Nn、Cy 和Asd 这3个区域内分别随机布设6个标准样方(20 m×20 m),样方间距均大于50 m,共计18个标准样方,调查样方内优势种梭梭的数量特征,每个标准样方内按照五点法均匀设置5个小样方(1 m×1 m),并用无菌铲分别采集5个小样方0~20 cm 土样混合均匀为一个土样,共采集18 份土样,每份土样又分为2 份,一份装入10 mL 无菌离心管于液氮中保存,用于土壤细菌测定,另一份风干过2 mm 筛用于土壤理化性质测定。土壤理化性质测定:采用电位法(水土比2.5∶1)测定土壤pH 值;采用重铬酸钾硫酸容量法测定土壤有机质(soil organic matter,SOM)[35];采用凯氏定氮法测定土壤全氮(total nitrogen, TN);采用酸消解-钼锑抗比色法测定土壤全磷(total phosphorus, TP);采用盐酸氢钠浸提-钼锑抗比色法测定土壤速效磷(available phosphorus, AP);采用乙酸铵浸提-火焰分光光度法测定土壤速效钾(available potassium, AK),各指标测定方法详见文献[36]。

表1 采样地基本信息Table 1 Basic information on sampling sites
1.3 16S rDNA 提取与测序
本研究采用Magabi 土壤基因组50 ng DNA 纯化试剂盒(MagaBio Soil GenomicDNA Purification Kit)提取土壤样品细菌总DNA,并利用Thermo NanoDrop One 检测DNA 的纯度和浓度[27]。PCR 扩增样品细菌16S rRNA基因的V3~V4 可变区,通用引物为338F“5'-ACTCCTACGGGAGGCAGCA-3'”和806R“5′-GGACTACHVGG GTWTCTAAT-3′”。PCR 扩增反应体系见表2。
PCR 反应条件为:94 ℃预变性5 min,随后94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,循环30 次,最后72 ℃延伸10 min,并用1%琼脂糖凝胶电泳检测每个样本3 次重复混合后的PCR 产物的片段长度和浓度并保存[24]。使用Illumina Nova 6000 平台标准流程进行建库操作,并对构建的扩增子文库进行PE250 高通量测序[27]。
1.4 数据处理与分析
利用Fastp 软件分别对原始双端的RawReads 数据进行滑窗质量剪裁,同时利用Cutadapt 软件去除首尾两端的引物,得到质控后的优质序列。在≥97%的相似水平下,用Usearch 软件Uparse 算法对样品优质序列进行操作分类单元(operational taxonomic units, OTU)聚类,并选取OTUs 中出现频率最高的代表性序列集合用Green Genes 和RDP 16S rDNA 物种注释数据库注释分析物种。基于质控后的测序数据用R(V 4.2.1)软件进行生物信息统计分析。采用QIIME(V 2020.11.0)软件计算细菌Alpha 多样性指数:Chao1 指数(土壤微生物群落丰富度)、Shannon 指数和Simpson 指数(土壤微生物群落多样性)。采用主坐标分析(principal coordinate analysis,PCoA)和置换多元方差分析(adonis)法测定土壤细菌的Beta 多样性,探究土壤细菌群落在自然尺度下的分布格局差异性。采用PICRUSt2 功能预测软件(2.3.0-b)对比KEGG 数据库信息获得各个样品的KEGG Orthology 相对丰度并进行功能预测。使用Canoco 5 软件进行冗余分析(redundancy analysis, RDA)来探究影响土壤细菌群落结构及功能的关键理化驱动因素,并进行蒙特卡洛置换检验,检验重复数为499。运用R 语言“vegan”包Mantel检验分析土壤细菌群落结构差异与土壤代谢功能基因差异间的相关关系。采用SPSS 26.0 软件对标准化后的土壤微生物数据与理化数据进行单因素方差分析(ANOVA),并用多重比较法(Duncan)检验显著性差异,作图均使用R 语言4.2.1“vegan”包和Origin 2022 Pro 绘制。
2 结果与分析
2.1 复合型治沙措施区梭梭林形态和土壤理化性质特征
虽然荒漠土壤养分含量较匮乏,但治沙措施的实施对土壤养分含量的增加整体具有显著影响(P<0.05,表3)。与Asd 相比,Nn 和Cy 治沙措施下土壤SOM、TN、AK 都呈显著增加的趋势(P<0.05),土壤AP 含量虽增加但无显著差异。研究区土壤呈碱性,pH 均大于8.22。植被调查发现,2 种措施下梭梭林高度(height, H)和盖度(vegetation coverage, VG)也显著高于Asd 组(P<0.05),其中Nn 和Cy 措施区域梭梭林高度分别增加了23.68%和49.72%,盖度分别提高了19.80%和30.82%。

表3 土壤因子和梭梭形态特征变化Table 3 Changes of soil factors and morphological characteristics of H. ammodendron
2.2 土壤细菌多样性分析
经质控抽平后所有样品聚类共获得56473个OTU(图1)。各样品文库测序覆盖率均达99.02%以上,且通过对有效序列数和其代表的OTU 数进行随机抽样构建细菌稀释曲线图发现,18个样品OTU 数随着序列数比例的增加而趋于平缓,近乎平行于横坐标轴,表明样品OTU 覆盖度接近饱和,测序结果基本覆盖样本所有微生物学信息,能代表研究区土壤细菌群落真实概况。Nn(3199)和Cy(3325)土壤平均OTU 数,较Asd(2872)分别增加了11.39%和15.77%。另外Nn 土壤丰富度指数(Chao1 指数)为3384.18,较Asd(3055.82)增加了10.75%(P<0.05),土壤多样性指数(Shannon 指数和Simpson 指数)分别为8.39 和0.02,均高于Asd,但无显著差异。Cy 土壤Chao1 指数为3500.30,较Asd(3055.82)增加了14.55%(P<0.05),且Shannon 指数和Simpson 指数分别8.76 和0.03,也均高于Asd。但Nn 和Cy 土壤Chao1 指数、Shannon 指数和Simpson 指数之间未表现出显著差异。

图1 土壤细菌Alpha 多样性分析Fig.1 Analysis of Alpha diversity of soil bacterial
基于主坐标分析(PCoA)的土壤细菌Beta 多样性显示(图2),PCoA1 和PCoA2 轴分别解释了28.98%和16.77%的细菌群落结构组成特征,不同空间距离分布的3 组试验区土壤细菌群落重合度较高,Adonis 检验表明细菌群落结构无显著差异(R2=0.133,P=0.276),说明3 组试验区土壤细菌群落组成结构大致相似。
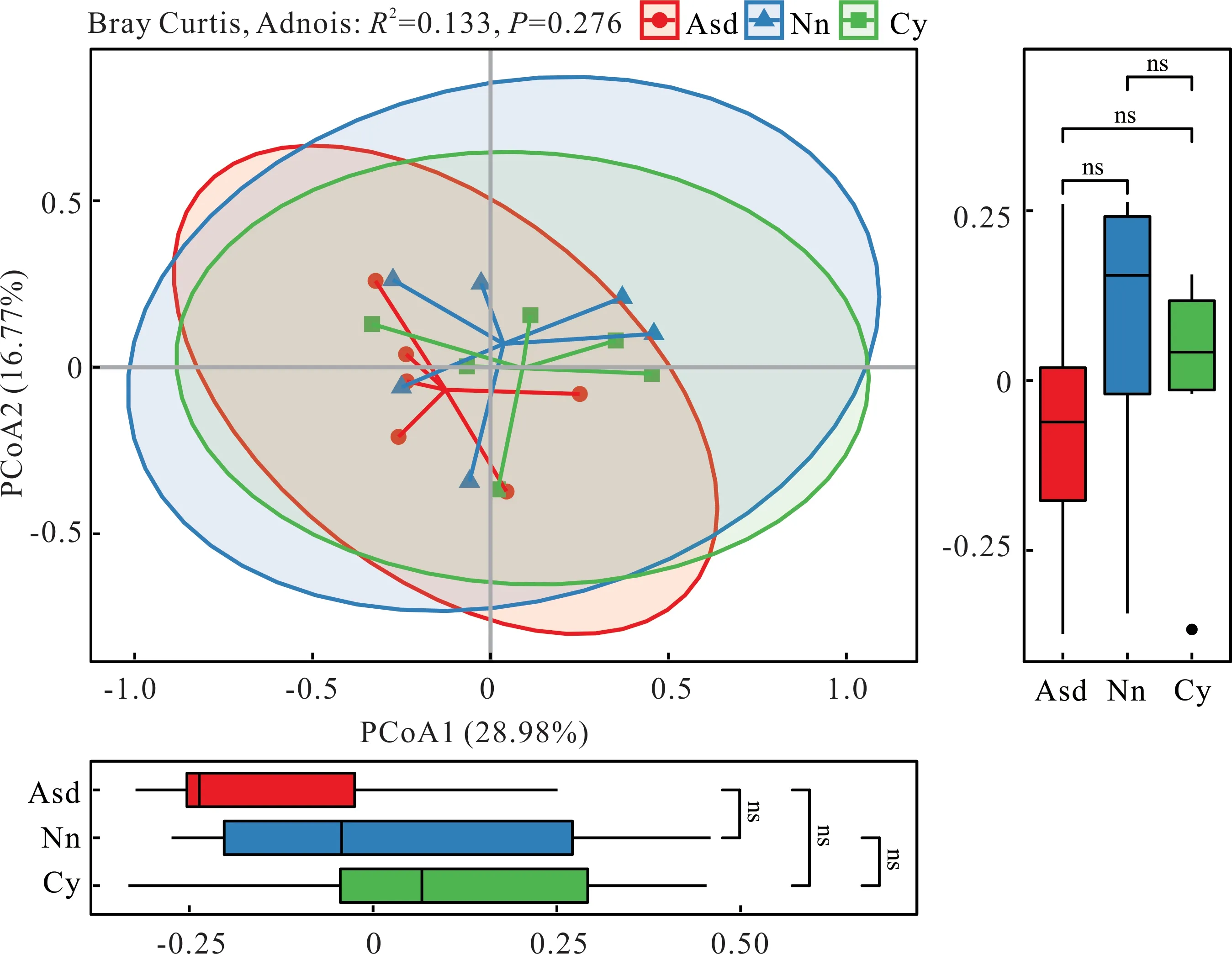
图2 土壤细菌Beta 多样性分析Fig.2 Beta diversity analysis of soil bacteria
2.3 基于分类水平的土壤细菌群落结构分析
2.3.1 土壤细菌门水平群落结构 试验区所有土样16S rRNA 聚 类 注 释 得 到 细 菌35 门、90 纲、172 目、259 科和436 属。相对丰度大于1%的细菌门共有8个(图3)。其中,放线菌门[(35.42±13.34)%]、变形菌门[(26.33±6.77)%]和绿弯菌门[(10.09±4.73)%]平均相对丰度累计达到71.84%,属于研究区土壤优势菌群,放线菌门相对丰度最高,占总相对丰度的32.16%~37.09%,但不同治沙措施下3 类优势细菌门相对丰度并未表现出显著差异。拟杆菌门、酸杆菌门、芽单胞菌门、蓝藻菌门和厚壁菌门在任意3 组土样中平均相对丰度占23.41%,是研究区土壤主要细菌门类。与Asd 相比,Nn 土壤变形菌门和绿弯菌门相对丰度分别增加了10.11%和45.69%,拟杆菌门和酸杆菌门相对丰度分别降低了29.17%和49.11%;Cy土壤放线菌门和绿弯菌门相对丰度分别降低了13.29%和17.15%。但Cy 土壤拟杆菌门和蓝藻菌门相对丰度却显著高于Asd 和Nn(P<0.05),其余细菌门相对丰度在3 组样地之间表现出相似的特征。

图3 土壤细菌门水平群落结构Fig.3 Soil bacterial phylum level community structure
2.3.2 土壤细菌属水平群落结构 属水平注释中,除去unassigned[未定菌属,(46.61±4.65)%]、uncultured[未培养菌属,(9.08±0.46)%]和相对丰度小于1%的部分菌属[(27.14±0.58)%],共获得7 类相对丰度大于1%的菌属(图4)。这些菌属在Asd、Nn 和Cy 中分别占15.25%、13.30%和22.97%,表明Cy 治沙措施下,土壤中这7 类菌属整体相对丰度显著提高。另外Nn 和Cy 中,假单胞菌属、红杆菌属和假节杆菌属相对丰度显著降低(P<0.05)。常丝藻菌属在Cy 样地的相对丰度显著高于其他2 组样地,而糖霉菌属则在Nn 中表现出较高的相对丰度(P<0.05)。

图4 土壤细菌属水平群落结构Fig.4 Soil bacterial community structure at genus level
2.4 土壤细菌群落功能预测
在KEGG Orthology 数据库中,将各样品16S rRNA 标记基因特征序列利用PICRUSt2 进行功能基因预测和注释。在一级功能预测水平共有4 种相对丰度>1%的主要功能(表4),各功能相对丰度最高的为新陈代谢功能(81.83%),其次依次为遗传信息处理(11.76%)、细胞过程(3.85%)和环境信息处理(2.02%)。除新陈代谢功能外,Nn 和Cy 其余3 种主要土壤细菌一级功能相对丰度略微高于Asd,但差异不显著。

表4 土壤细菌群落一级功能通路的相对丰度Table 4 Relative abundance of primary functional pathways of soil bacterial community (%)
在分布于4个代谢途径的细菌群落中,相对丰度大于1%的二级代谢功能包含17个(图5)。其中碳水化合物代谢(13.46%~13.66%)、氨基酸代谢(13.22%~13.43%)、辅助因子和维生素的代谢(11.79%~12.28%)、萜类和聚酮类化合物的代谢(9.23%~9.58%)为土壤细菌主要二级代谢功能。Cy 中辅助因子和维生素的代谢(12.28%)及能量代谢(5.58%)相对丰度显著高于Nn 和Asd(P<0.05)。细胞运动性功能在Nn 中的相对丰度显著高于Cy 和Asd(P<0.05)。此外,其他类代谢功能相对丰度在3 组样地土壤中特征相似。
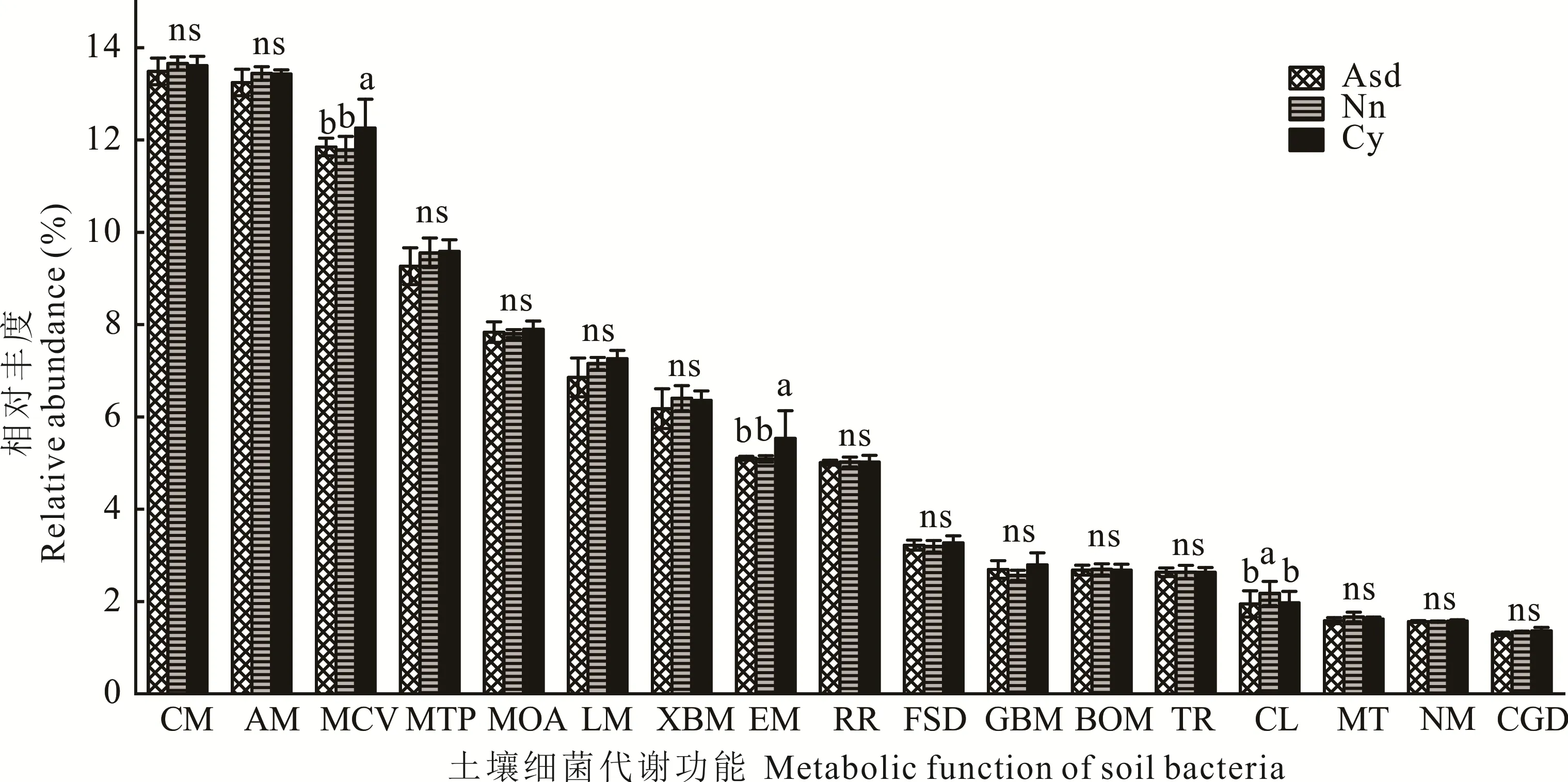
图5 土壤细菌二级功能相对丰度及差异Fig.5 Relative abundance and difference of secondary function of soil bacteria
2.5 土壤细菌群落结构及功能与环境因子的RDA 分析
RDA 分析是基于对应分析与多元回归分析结合的一种线性排序模型,能直观地反映影响样品细菌群落结构和组成的重要环境驱动因素。以土壤细菌群落结构和代谢功能相对丰度为响应变量,标准化后的土壤理化因子数据为解释变量,以期揭示本研究中土壤理化因子对土壤细菌群落结构和代谢功能相对丰度的影响。如表5 所示,土壤理化因子对细菌群落结构的解释率分别为轴1(68.24%)和轴2(0.08%);对土壤代谢功能的解释率分别为轴1(37.87%)和轴2(3.90%),且第1 轴起决定性作用;第1 轴与理化因子的相关系数分别为0.8278 和0.7772,累积解释量分别达到99.80%和80.78%。
RDA 排序模型图中,物种和环境因子箭头之间夹角越小,余弦值越大,相关性越大。Chao1 指数、Shannon 指数和Simpson 指数箭头方向几乎均与环境因子箭头相同且呈锐角,说明土壤细菌多样性与环境因子之间存在正相关关系(图6)。变形菌门与SOM、TN 和AK 呈正相关;绿弯菌门与AK、TN 和SOM 等养分含量呈正相关;蓝藻菌门与AP、TP、pH 和SOM 等养分含量呈正相关;其余5 类菌门与环境因子呈负相关关系。蒙特卡洛置换检验发现,不同治沙措施下影响土壤细菌群落结构的主要环境驱动因素为土壤SOM(P=0.006)。

图6 土壤细菌群落与理化因子RDA 分析Fig. 6 RDA analysis of soil bacterial community and physicochemical factors
在土壤细菌主要功能基因与环境因子关系方面,碳水化合物代谢、氨基酸代谢、萜类和聚酮类化合物的代谢相对丰度与所有环境因子之间呈负相关(图7);辅助因子和维生素的代谢与AK、VG、TN、H、TP 和SOM 等因子之间呈正相关;其余代谢功能与环境因子的相关性也各有不同。其中影响土壤细菌代谢功能基因相对丰度较显著的环境因子为:AK(P=0.042)和H(P=0.028)。

图7 土壤细菌功能基因与理化因子RDA 分析Fig. 7 RDA analysis of functional genes and physicochemical factors of soil bacteria
2.6 土壤细菌群落结构与功能之间的相关关系
不同治沙措施下土壤细菌群落结构与功能Pearson 相关性分析发现(图8),放线菌门、变形菌门、拟杆菌门、芽单胞菌门和蓝藻菌门与绝大多数细菌功能呈显著相关关系,说明这5 类菌群与土壤细菌代谢功能之间存在潜在的耦合关系。

图8 土壤细菌群落结构与功能相关性热图Fig.8 Heat map of structural and functional correlations of soil bacterial communities
Mantel 检验表明,不同治沙措施下土壤细菌二级代谢功能基因相对丰度差异性与群落结构组成相对丰度差异性呈显著正相关(P<0.05,图9)。
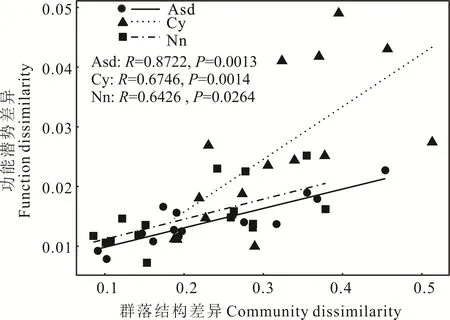
图9 不同治沙措施下土壤细菌群落结构差异与功能基因丰度差异关系Fig. 9 Relationship between differences in soil bacterial community structure and differences in functional gene abundance under different sand control measures
3 讨论
土壤细菌参与土壤中物质循环和能量流动及重要代谢活动,对维持土壤肥力,保持土壤健康和土地可持续生产力具有重要的作用[37]。基于16S rRNA 测序的分子生物学技术具有全面、准确和高通量的特点,能更好地反映土壤细菌群落结构和物种多样性[38]。PICRUSt2 作为一种基于系统发育与功能联系假设的微生物功能预测方法,为解释和预测土壤微生物16S rRNA 标记基因代谢功能提供了新途径[30,39]。
3.1 复合型治沙措施下梭梭形态特征及土壤因子变化
植被-土壤系统通过二者互馈作用承载生态系统物质循环和能量流动[11,40]。植被高度、盖度等因子变化不但能从侧面反映植被生产力和生态持续恢复水平,而且是区域植被生态功能稳定和生态承载力的重要体现[41]。本研究中复合型治沙措施区梭梭林高度和盖度均呈显著增加的共性趋势,表明治沙措施为梭梭生长发育提供了稳定的环境,有助于梭梭生产力的持续恢复。此外,Cy 措施下梭梭林高度显著高于Nn 和Asd,说明不同治沙措施对植被生长发育会产生不同的影响。以上结果在研究沙障布设、梭梭定植等治沙措施与植被群落间关系的试验中屡见不鲜[42]。生境异质性对植被定植、生长产生重要的影响,植被又通过根系分泌物、枯枝落叶分解、沃岛效应等生态机制驱动土壤因子变化[43-44]。本研究在原始生境流动沙丘基本一致的条件下,复合型治沙措施成为环境过滤机制的主要策略。我国西北多个典型固沙区域研究的普遍认识是:沙障布设+营造固沙植被的复合型治沙措施在改善土壤性状、增加土壤养分含量等方面具有显著作用[9-11,45-46]。本研究中,虽然荒漠土壤养分含量相对匮乏,但土壤有机质、全氮、全磷和速效钾等养分含量在Nn 和Cy 措施区均有所提高。其原因可能是治沙措施区内梭梭林高度和盖度的增加,截获和聚集了风沙流中尘埃颗粒物及凋落物,对地表土壤肥力具有富集作用[10,46]。以往的研究也表明,植被新陈代谢和凋落物分解过程在荒漠土壤中具有显著的碳、氮源汇集效果[47]。因此,复合型治沙措施的实施使生境质量改善,土壤养分含量不断提高,土壤性状产生良好的生态惠益。
3.2 复合型治沙措施对土壤细菌群落结构及多样性的影响
土壤生境的细微变化都会直接或间接对土壤细菌群落结构和多样性产生显著影响[27,48],越来越多的研究表明干旱乃至荒漠区域土壤细菌群落组成基本一致,主要为放线菌门、变形菌门、绿弯菌门、拟杆菌门和蓝藻菌门等近8个类群[24,27-32]。虽然不同立地条件下土壤细菌相对丰度有所差异,但本研究中3 组样地细菌群落结构总体特征是一致的。放线菌门、变形菌门和绿弯菌门为本研究区土壤优势细菌群,这与Sun 等[49]和王子寅等[50]对荒漠土壤细菌类群的研究结果相近。李善家等[51]通过研究河西走廊荒漠盐碱土壤发现,放线菌门属于革兰氏阳性细菌,因其孢子生殖、耐热抗旱等丰富的生理特征,使其成为盐碱干旱恶劣环境中有力的竞争者。干旱和高辐射等恶劣气候因素加剧了荒漠绿洲过渡带土壤盐碱化程度,减弱了荒漠土壤生态系统碳、氮等元素循环进程[51-52],而放线菌门和变形菌门等通过参与异化硝酸盐还原、硝化和反硝化作用驱动土壤氮循环[53],同时绿弯菌门属于光能营养型微生物,通过还原性三羧酸循环和C4-双羧酸循环等主导CO2固定和微生物光合作用。这3 类细菌较高的相对丰度有利于提高荒漠绿洲过渡带固沙区域土壤碳、氮循环,加快土壤物质转化和能量流动,提高土壤生态承载力[54]。此外,本研究中Cy 样地拟杆菌门和蓝藻菌门具有更高水平的相对丰度,研究表明这2 门细菌属于富营养型菌门,能高效利用土壤有机质[24],Cy 样地较高的土壤有机质含量为拟杆菌门和蓝藻菌门的生长繁殖提供了充足的物质基础(表3)。细菌属水平中,对分析细菌生态功能具有阻碍的菌属占82.82%,说明研究区土壤细菌属水平的微生物学信息还有很大的挖掘潜力,仅占17.18%的部分已知菌属结构可能因其不同立地条件和根系分泌物等作用在3 组样地也产生趋异化特征[27]。
3.3 复合型治沙措施区土壤细菌功能预测
PICRUSt2 功能预测可为研究荒漠土壤细菌生态功能潜势提供有力支持[55]。本研究中3 组样地土壤细菌功能注释结果均表明代谢功能为土壤细菌主要功能。而代谢功能中起主要作用的碳水化合物代谢、氨基酸代谢、辅助因子和维生素的代谢等在3 组样地土壤中体现出功能高度冗余的特点,说明荒漠土壤微生物代谢功能可能相对保守,对立地条件的改变响应不强烈。丁钰珮等[30]和杜宇佳等[56]对呼伦贝尔沙区土壤细菌功能预测的研究中发现,土壤细菌的核心功能特性中代谢功能较为活跃。同样地,本研究结果与利用PICRUSt 技术对不同海拔鬼箭锦鸡儿(Caragana jubata)土壤细菌功能的预测结果高度吻合[27]。甚至在对与荒漠土壤理化性质相差很大的黄河下游谷子(Setaria italica)、花生(Arachis hypogaea)间作农田土壤细菌的功能预测中,代谢功能相对丰度超过79.3%[57]。因此本研究中3 组样地土壤细菌功能没有显著差异也不足为奇。近期研究发现,在整体代谢功能相似的微生物群体中,特定代谢功能途径的基因序列并不完全一致,可能是由于不同环境条件中,执行特定代谢功能的微生物种类不同,从而可以更好地调节和维持生态系统功能的稳定[21]。
3.4 复合型治沙措施区土壤细菌群落及功能与理化因子的关系
微生物群落结构特征对土壤环境因子的变化极为敏感,以往的研究表明,土壤细菌群落结构及多样性和理化因子之间关系紧密且相互影响[51-53,57-58]。在全球地理格局生态位分化的大部分研究中,土壤pH 因其直接影响细菌细胞膜通透性和稳定性,成为影响细菌群落特性的关键因子[59]。但近期魏鹏等[29]发现土壤有机碳是影响准噶尔盆地荒漠土壤细菌群落结构最主要的理化因子。同样地,Cao 等[31]对科尔沁沙地樟子松林土壤细菌群落特征和Yu 等[33]对半干旱荒漠区锦鸡儿属土壤细菌群落的研究中均表明与土壤有机质相关的细菌属相对丰度显著增加,且这些显著变化可能由其驱动。本研究RDA 结果也佐证了土壤有机质和速效钾等理化因子显著影响土壤细菌群落结构、多样性及代谢功能,而不是土壤pH。其原因可能是本研究区同以上研究均为荒漠盐碱土壤,盐碱程度的加剧模糊了土壤pH 对细菌群落的影响,同时,在植被稀疏和土壤养分匮乏的荒漠生态系统中,碳、氮等营养元素作为塑造土壤细菌群落结构最主要的能源物质,成为其关键的限制性环境因子[29-30]。变形菌门和放线菌门等因其异养生理机制,通过代谢活动参与有机质分解及土壤养分转化[27,60],本研究土壤细菌群落结构与功能热图中主要优势细菌门与绝大多数细菌功能呈显著相关(图8),此外,本研究区土壤细菌群落结构差异与细菌功能潜势差异呈显著正相关(图9),进一步佐证了这些类群可能在细菌通过代谢活动驱动生物地球化学循环的过程中扮演重要角色,以及土壤细菌群落结构、代谢功能及环境因子之间存在紧密的相互耦合关系[61-62]。目前,针对沙化土地修复区特定环境因子对土壤细菌群落结构及功能潜势的调控机理研究甚少,且研究结论也不尽相同,因此需结合宏基因组测序和氮、磷等元素功能基因芯片技术深入探究特定环境因子对土壤细菌群落结构及功能潜势的特定影响机制。
4 结论
1)复合型治沙措施区土壤细菌群落组成相似,优势菌群为放线菌门、变形菌门和绿弯菌门,土壤细菌多样性Chao1 指数显著高于流动沙丘土壤。
2)代谢功能为研究区土壤细菌主要的生态功能,其中碳水化合物代谢、氨基酸代谢及辅助因子和维生素的代谢在次级代谢功能中相对丰度较大,表现活跃。
3)治沙措施的实施显著增加了沙化土壤有机质、全氮、全磷、速效钾等养分含量,其中土壤有机质和速效钾等因子显著影响土壤细菌群落结构和代谢功能,且土壤细菌群落结构差异性与功能潜势差异性显著正相关。
