2 株青贮玉米根际固氮菌的筛选鉴定及促生作用研究
2024-03-22孟超楠赵玉洁陈佳欣张旖璐王彦佳冯丽荣孙玉刚郭长虹
孟超楠,赵玉洁,陈佳欣,张旖璐,王彦佳,冯丽荣,孙玉刚,郭长虹*
(1. 黑龙江省分子细胞遗传与遗传育种重点实验室,哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150000;2. 黑龙江国宏节能环保有限公司,黑龙江 哈尔滨 150028)
青贮玉米(Zea mays)是饲喂牛、羊等草食性家畜的优良饲草类作物[1],具有产量高,粗蛋白、淀粉含量丰富等优点,是世界上最重要的牧草之一[2]。近年来,随着畜牧业的发展,对青贮玉米的需求量在不断增加,青贮玉米的种植面积也在逐年扩大。在生产实践中,为了提高青贮玉米的产量而长期施加化肥,会导致土壤板结、土壤吸收水分和养分的能力下降,影响农作物的生长发育,甚至还会造成土地退化等不良后果[3]。植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)具有固氮、溶磷、合成吲哚-3-乙酸(indole-3-acetic acid, IAA)和产嗜铁素等多种促生特性,可促进植物的生长发育,提高作物的产量和品质[4]。此外,PGPR 还可以增强土壤肥力,减少化肥的使用,促进农业可持续发展。
氮是植物生长所需的营养元素,是核酸、氨基酸和蛋白质的主要成分[5],也是影响玉米产量和品质的重要养分之一[6]。固氮菌通过固氮作用为植物提供氮元素,促进植物生长。Castellano 等[7]从玉米根际分离出2 株促进植物生长的固氮菌,提高了植株的总氮量。Thanh 等[8]在玉米根际分离出2 株具有较强固氮能力的菌株,促进了植物根系生长。研究表明,不同植物对铵态氮和硝态氮的喜好不同[9]。玉米偏好吸收铵态氮,固氮菌分泌的铵态氮可为玉米的生长发育提供氮源[10]。目前已经有研究分离出一些具有泌铵能力的固氮菌,Adriana 等[11]从向日葵(Helianthus annuus)根际中分离出3 株具有泌铵能力的固氮菌,经鉴定是芽孢杆菌属(Bacillus)的一个新种,命名为向日葵类芽孢杆菌(Paenibacillushelianthi)。李琼洁等[12]从玉米根际土壤中分离到一株具有泌铵能力的固氮菌株Kosakonia radicincitans。但是,关于具有泌铵能力的固氮菌对青贮玉米促生作用的研究还鲜有报道。
本研究从青贮玉米根际土壤中分离筛选得到2 株固氮菌,通过细菌形态学、16S rDNA 序列分析及生理生化特征对其进行鉴定,并评价菌株的泌铵能力及促生特性。在盆栽条件下评价2 株固氮菌对青贮玉米的促生效果,同时对氮代谢和氨同化相关基因的表达进行分析,并在田间条件下评价接种固氮菌对青贮玉米产量和品质的影响,为开发可应用于青贮玉米的固氮微生物菌剂奠定基础。
1 材料与方法
1.1 样品采集
试验在2019-2020 年进行。供试土壤样品取自哈尔滨师范大学农园(45°51′ N,126°32′ E)生长的青贮玉米根际,土样采集后放置于无菌袋中,带回实验室4 ℃保存,用于固氮菌的分离与筛选。
1.2 试验所用培养基
LB(luria-bertani)培养基[13]、阿须贝氏(Ashby)培养基[14]、DF(dworkin and foster)培养基[15]、PVK(pikovskaya)培养基[16]、MKB(modified king’s B)培养基[17]、甲基红培养基、葡萄糖蛋白胨培养基、发酵半固体培养基、柠檬酸盐培养基、淀粉水解培养基、H2S 培养基、明胶液化培养基、脲酶培养基[18]。
1.3 固氮菌的分离与筛选
参照姜瑛等[14]的方法从青贮玉米根际土壤中分离固氮菌。取1 g 青贮玉米根际土,加入盛有玻璃珠和99 mL无菌水的锥形瓶中,摇床振荡30 min (28 ℃,180 r·min-1),静置30 min。采用稀释涂布平板法[19]分离细菌:取上清液稀释成10-2、10-3、10-4和10-5的浓度梯度,各取100 μL 稀释液涂布于Ashby 固体培养基上,倒置于28 ℃恒温培养箱培养。待长出较多单菌落时,挑取有透明水解圈、生长情况良好、形态不同的单菌落,进行平板划线纯化培养,直至获得纯菌种,挑取单菌落接种于LB 固体培养基,菌落长出后于4 ℃保存,并制备成甘油菌-80 ℃保存备用。
采用凯氏定氮法测定菌株的固氮能力[20]。将分离筛选得到的菌株菌悬液分别接种到Ashby 液体培养基中,摇床振荡培养(28 ℃,180 r·min-1,7 d),消化管中加入一定量样品和10 mL 浓H2SO4进行消煮(180 ℃,60 min;300 ℃,120 min)。消化管冷却后,加入2 mL H2O2继续消煮至样品澄清,使用定氮仪(KDN-103F,上海纤检仪器有限公司)进行测定,每个处理3 次重复。以等量灭活菌体和无菌水作为空白对照。
1.4 菌株鉴定
将分离菌株在LB 固体平板上纯化,观察菌落形状、颜色。参照《常见细菌系统鉴定手册》[18]和《伯杰细菌鉴定手册》[21],对筛选出的菌株在LB 固体培养基上划线培养,观察菌落形态特征,以及对菌株的甲基红、伏普、吲哚、葡萄糖、柠檬酸盐、接触酶、淀粉水解、硫化氢、明胶液化、脲酶及革兰氏染色等生理特征进行测定。
采用CTAB/NaCl 方法提取细菌DNA[22]。用原核生物16S rDNA 保守序列通用引物F8(5'-AGAGTT TGATCCTGGCTCAG-3')和R1541(5'-AAGGAGGTGATCCAGCCGCA-3')进行PCR 扩增,将所得PCR 产物送至上海生工生物工程股份有限公司进行DNA 测序。使用NCBI(http://www.ncbi.nlm.nih.gov/Blast.cgi)上的BLAST 软件将所得DNA 序列提交至GenBank 数据库,与数据库中的已知序列进行比对,选择出同源性较高的相似序列,运用软件MEGA 4.1 构建系统进化树,采用Neighbor Joining 法的Complete Deletion 模式建树。
1.5 菌株泌铵及促生能力测定
1.5.1 泌铵能力 采用靛酚蓝比色法测定菌株的泌铵能力[23]。于试管中依次加入铵态氮标准液0、10、20、30、40、50、60、70、80、90 和100 μL,用水将其总体积补充至100 μL,分别加入溶液A(称取1.0 g 苯酚,溶于80 mL蒸馏水,加入0.4 mL 的1.25%亚硝基铁氰化钠溶液,定容至100 mL)和溶液B(称取0.5 g 氢氧化钠、0.4 g 柠檬酸三钠和0.7 mL 次氯酸钠溶液溶于80 mL 蒸馏水中,定容至100 mL)各5 mL,充分混合后,放入37 ℃水浴显色20 min,取出后用水冷却至室温,在637 nm 下测定吸光值,制作标准曲线[24]。将菌株在LB 液体培养基中过夜培养(28 ℃,180 r·min-1),转接至Ashby 液体培养基中生长3 d,取100 μL,其他操作同标准曲线,每个处理3 次重复。
1.5.2 溶磷能力 采用钼锑抗显色法计算有效磷含量[25]。挑选菌株接种到LB 液体培养基,离心(10000 r·min-1,10 min)富集菌体,用无菌水制备成菌悬液,将菌悬液浓度调至1×108cfu·mL-1,将菌悬液按1%量接种在PVK 液体培养基中,以不接菌培养基为对照,每个处理3 次重复,摇床振荡培养(28 ℃,180 r·min-1,72 h),取发酵液离心(4 ℃,10000 r·min-1,10 min),取上清液,加5 mL 钼锑抗显色液定容至50 mL,暗反应30 min,600 nm 处测定吸光值,并计算有效磷含量,减去对照的值即为溶磷量。
1.5.3 合成IAA 能力 采用Salkowski 比色法测定菌株产IAA 能力[15]。供试菌株先在DF 培养基中培养(28 ℃,180 r·min-1,48 h),再取1 mL 转入添加不同浓度色氨酸(L-Trp)的DF 培养基(含0、100、200 和500 μg·mL-1L-Trp)中继续培养(28 ℃,180 r·min-1,48 h),取样测菌液在600 nm 处的吸光值,其余菌液室温下10000 r·min-1离心2 min,取500 μL 上清液,添加2 mL Salkowski 试剂,室温培养20 min 后,在535 nm 处测吸光值,根据标准曲线计算菌液中IAA 含量。每个处理3 次重复。
1.5.4 产嗜铁素能力 定量检测参照王平等[17]的方法。将菌株接种于MKB 培养基中,摇床振荡培养(28 ℃、180 r·min-1,48 h);菌液离心,取3 mL 上清液,并加入3 mL CAS(chrome azurol sulphonate)检测液,充分混匀,暗反应1 h,630 nm 处测吸光值(A),以去离子水与CAS 检测液等体积混合测得的Ar 为空白对照,每个处理3 次重复,样品中嗜铁素的相对含量为A/Ar,该比值与产嗜铁素能力成反比。
1.6 菌株对青贮玉米促生效果分析
1.6.1 盆栽接种试验 供试青贮玉米种子“阳光一号”,由黑龙江省农业科学院草业研究所提供。挑取大小相似、颗粒饱满的青贮玉米种子。75%的酒精表面消毒1 min,2%次氯酸钠溶液表面灭菌2 min,无菌水洗涤3~5次。试验设置:对照组:CK;处理组1:ZL-2;处理组2:ZL-13;菌悬液的制备:将活化后的菌株ZL-2 和ZL-13 分别接种于LB 液体培养基中培养(28 ℃、180 r·min-1,24 h),离心收集菌体,离心后重悬于无菌水中,利用血球计数板计数法[26]确定菌悬液浓度达到1×108cfu·mL-1,获得的即为单一菌株的菌悬液。将种子分别浸入无菌蒸馏水(CK)、ZL-2 菌悬液、ZL-13 菌悬液中6 h,空气干燥3 h。处理后的青贮玉米种子均匀播种于花盆中,每个花盆装2.5 kg 农田土,每盆6 粒种子,3个重复。室温培养,每天光照16 h,定期浇水。每隔7 d 用60 mL 菌悬液均匀浇灌于幼苗根部,对照组浇灌等量无菌水,共浇灌3 次。30 d 后测定青贮玉米的株高、根长、地上鲜重、地下鲜重、地上干重和地下干重等指标,并分别采用2,3,5-氯化三苯基四氮唑TTC 法[27]、考马斯亮蓝染色法[28]、蒽酮硫酸法[28]测定根系活力、可溶性蛋白含量、可溶性糖含量,参照《植物生物化学分析方法》[29]测定叶片铵态氮含量。
1.6.2 田间接种试验 田间试验于2020 年5 至10 月在哈尔滨师范大学农园进行。试验设置:对照组:CK;处理组1:ZL-2;处理组2:ZL-13;处理组3:ZL-2+ZL-13;菌悬液的制备:单一菌株的菌悬液同盆栽条件下菌悬液的制备,将得到的无拮抗反应的单一菌株的菌悬液1∶1 混合,即获得混合菌悬液。将种子分别浸入无菌蒸馏水(CK)、ZL-2 菌悬液、ZL-13 菌悬液及ZL-2+ZL-13 混合菌悬液中6 h,空气干燥3 h。每个小区试验地面积为33 m2,一垄为2.50 m×0.65 m,共20 垄,每垄种植10 株,四周设有保护行。在拔节期、大喇叭口期、抽雄期、吐丝期进行等量菌悬液灌根处理,110 d 收获。采用5 点取样法,测定青贮玉米株高、茎粗、鲜重和干重,并采用凯氏定氮法、钒钼黄比色法测定粗蛋白含量、植株全磷含量[30-31]。
1.7 基因表达分析
以盆栽条件下青贮玉米幼苗的根、茎、叶为试验材料。取青贮玉米的根、茎、叶,用自来水冲净根部表面泥土,蒸馏水冲洗后用滤纸擦干,每种组织各称取1.0 g,每个样品3个重复。用锡纸将样品包好,迅速放入液氮中速冻5 min,转移至-80 ℃保存。采用TIANGEN 公司RNAprep Pure Plant Kit(TIANGEN DP432)试剂盒提取RNA,以青贮玉米根、茎、叶总RNA 为模板,使用TOYOBO 公司ReverTra Ace®qPCR RT Kit 反转录试剂盒进行反转录 得 到cDNA 贮 存 于-80 ℃冰 箱 备 用。利 用Primer Premier 5 设 计ZmAMTB、ZmAMT-4[32]、ZmGS1-3、ZmGOGAT2[33]基因引物。内参基因为GADPH[32](表1)。采用Taq SYBR©Green qPCR 测试盒(来自TOYOBO公司)进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)。反应体系为: 10 μL 2×SYBR Premix ExTaqTM、0.8 μL 正向引物、0.8 μL 反向引物、0.4 μL 50×ROX Reference Dye、6 μL ddH2O,将反应体系混匀后加入2 μL 稀释10 倍的cDNA 模板。反应程序为94 ℃ 30 s; 94 ℃ 5 s, 54 ℃ 15 s, 72 ℃ 31 s,循环40 次。采用2-ΔΔct法计算目标基因相对表达量[34]。

表1 引物序列Table 1 Primer sequence
1.8 数据处理
使用SPSS 26.0 统计分析软件对试验数据进行统计学分析。采用t检验法和单因素方差分析(ANOVA)进行不同处理组数据的比较分析。
2 结果与分析
2.1 固氮菌的分离与筛选
从青贮玉米根际土壤初步分离筛选出10 株在Ashby 固体培养基产生透明圈的固氮菌,分别记为ZL-1、ZL-2、ZL-4、ZL-7、ZL-9、ZL-10、ZL-13、ZL-15、ZL-16 和ZL-18。进一步对10 株菌株的固氮能力进行测定。结果表明,菌株ZL-2 和ZL-13 的固氮能力较强,菌株ZL-2 的固氮量为1.07 μg·mL-1,ZL-13 的固氮量为0.95 μg·mL-1(图1)。
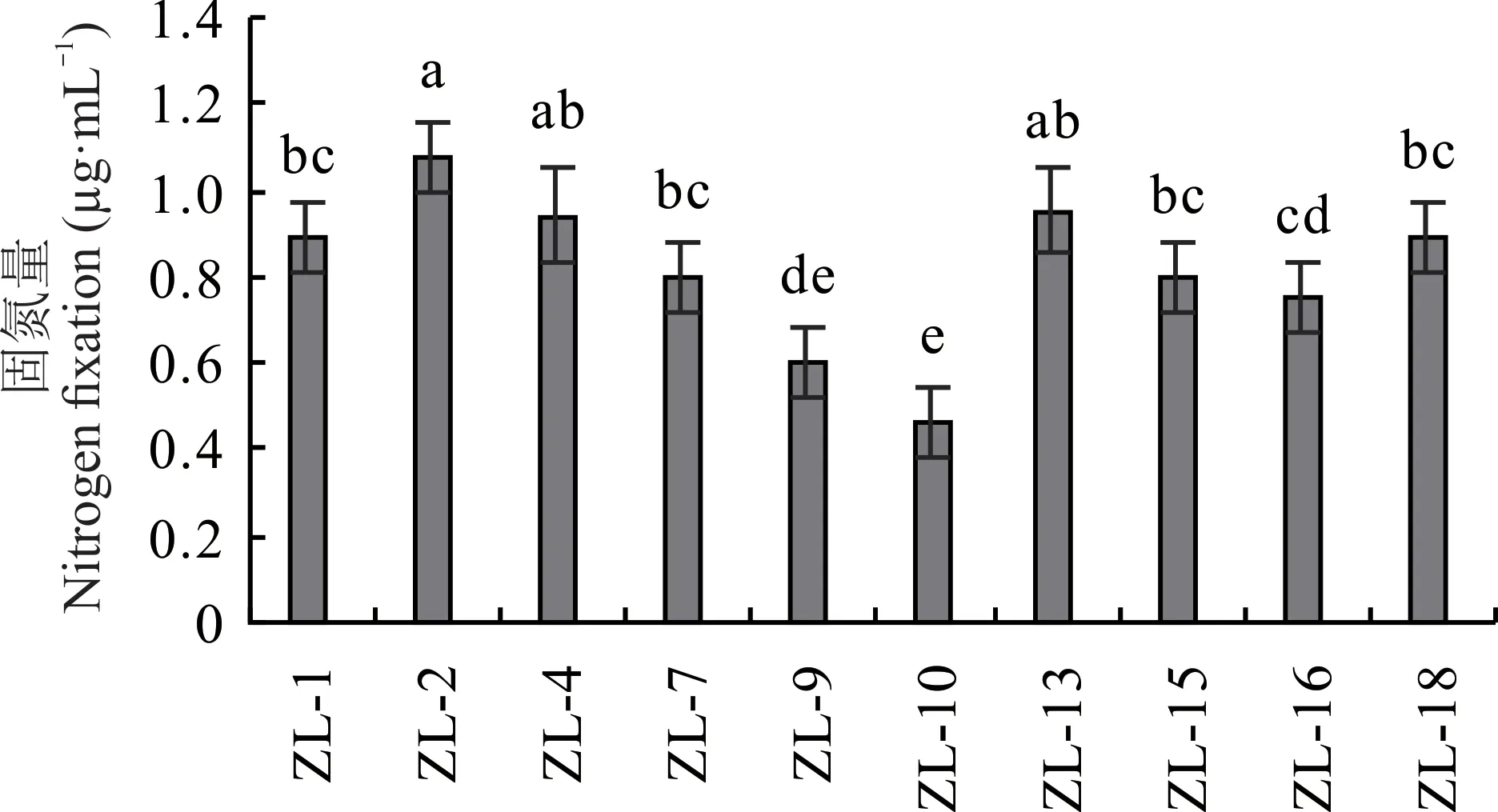
图1 菌株的固氮能力Fig.1 Nitrogen fixation capacity of strains
2.2 菌株ZL-2 和ZL-13 的鉴定
菌株ZL-2 菌落呈淡黄色,边缘整齐,不透明,革兰氏染色为阴性;菌株ZL-13 菌落呈黄色,圆形,边缘整齐,半透明,中心隆起,革兰氏染色为阴性。提取细菌ZL-2 和ZL-13 的DNA,进行16S rDNA 序列PCR 扩增,菌株ZL-2 和ZL-13 扩增产物长度分别为1474 和1469 bp,ZL-2 的GenBank 登录号为OQ852921,ZL-13 的GenBank 登录号为MW577625。通过BLAST 进行比对,菌株ZL-2 与生癌肠杆菌(Enterobacter cancerogenus)、阴沟肠杆菌(Enterobacter cloacae)、桑树肠杆菌(Enterobacter mori)、神户肠杆菌(Enterobacter kobei)和霍氏肠杆菌(Enterobacter hormaechei)的同源性分别达99.11%、98.23%、98.02%、97.65%、99.02%;菌株ZL-13 与成团泛菌(Pantoea agglomerans)、Pantoea deleyi、布氏泛菌(Pantoea brenneri)、Pantoea anthophila、杓兰泛菌(Pantoea cypripedii)和菠萝泛菌(Pantoea ananatis)的同源性分别为98.70%、98.02%、98.26%、98.09%、95.65%、98.21%(图2)。基于16S rDNA 和系统进化树分析结果表明,菌株ZL-2 属于肠杆菌属(Enterobacter),菌株ZL-13 属于泛生菌属(Pantoea)。进一步通过生理生化试验表明,菌株ZL-2 加入甲基红指示剂后表现为黄色,呈阴性,菌株ZL-13 加入甲基红指示剂后变为红色,呈阳性;2 株菌株的伏普试验现象均为红色,均呈阳性;2 株菌株加入吲哚试剂后产生红色,均呈阳性;菌株ZL-2 能利用葡萄糖,使指示剂变黄,为阳性,菌株ZL-13 不能利用葡萄糖,呈阴性;2 株菌株均可使柠檬酸盐培养基由绿色变为深蓝色,均能利用柠檬酸盐,均呈阳性;滴加适量3% H2O2溶液,在30 s 内2 株菌株均产生大量气泡,表明接触酶为阳性;2 株菌株可以在淀粉培养基周围出现无色透明环,均呈阳性;2 株菌株不能使H2S 培养基变黑,表明H2S 均呈阴性;2 株菌株均不能液化明胶;菌株ZL-2 可以使脲酶培养基变红,脲酶反应呈阳性,菌株ZL-13 呈阴性;在显微镜下观察2 株菌株的革兰氏染色现象均为红色,表明2 株菌株均为革兰氏阴性菌(表2)。综合细菌形态学、16S rDNA 序列分析和生理生化特征对筛选出的固氮细菌进行鉴定,确定菌株ZL-2 和ZL-13 分别为生癌肠杆菌和成团泛菌。
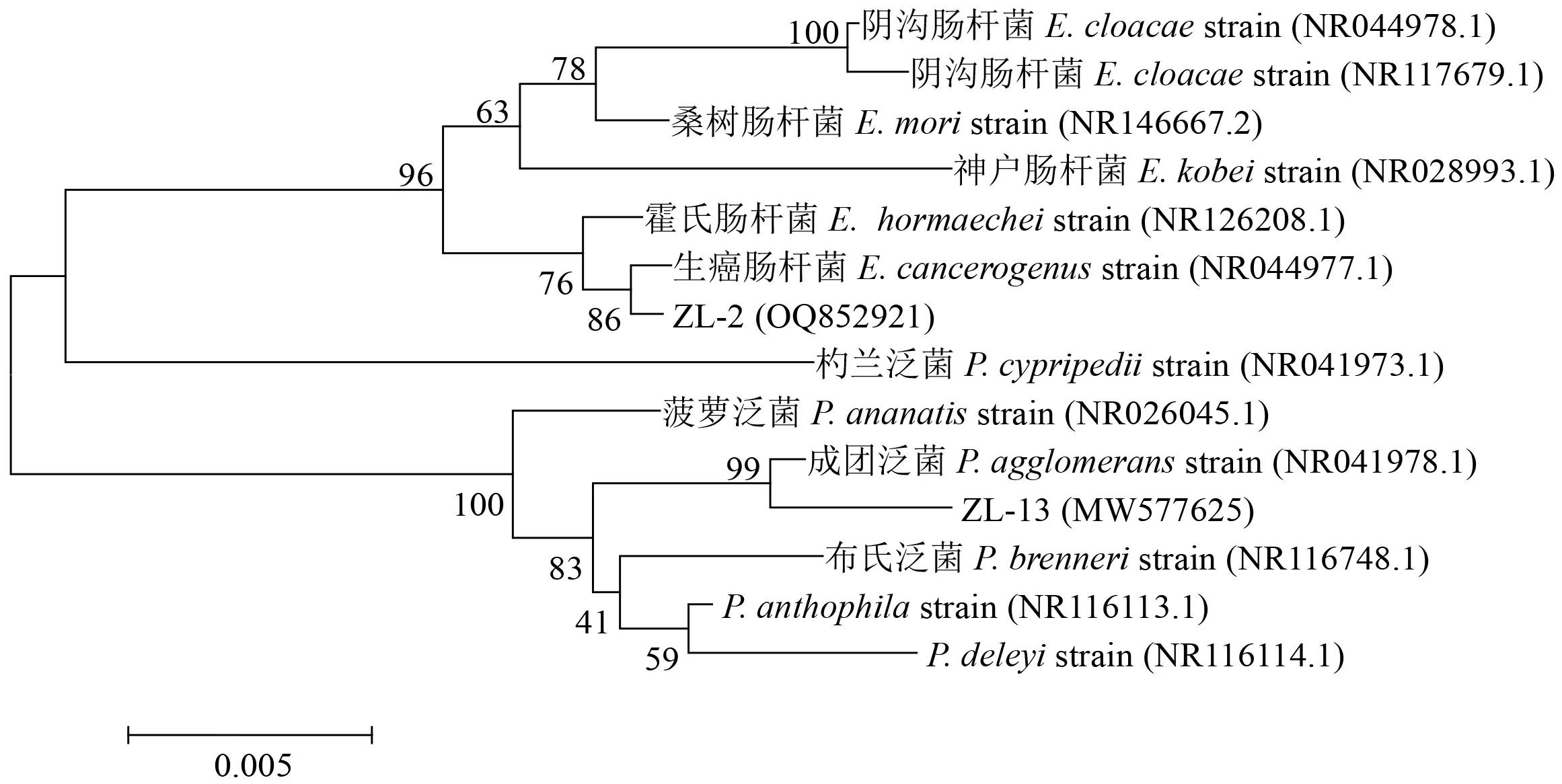
图2 菌株16S rDNA 序列的系统发育树Fig.2 Phylogenetic tree of strains 16S rDNA sequence

表2 菌株ZL-2 和ZL-13 生理生化特征Table 2 Physiological and biochemical characteristics of strains ZL-2 and ZL-13
2.3 菌株泌铵能力及促生特性分析
对2 株固氮菌的泌铵、溶磷、产嗜铁素和合成IAA的能力进行测定。结果表明,菌株ZL-2 和ZL-13 的泌铵能力分别为2.59 和2.11 μg·mL-1(图3A);有效磷含量分别为330.79 和368.91 μg·mL-1(图3B);嗜铁素合成量(A/Ar 值)分别为0.61 和0.78(图3C)。IAA 测定结果显示,菌株ZL-2 和ZL-13 均具有合成IAA 的能力,其IAA 合成量随L-Trp 浓度的增大而增加,当L-Trp 浓度为500 μg·mL-1时,IAA 合成量分别高达26.44 和23.50 μg·mL-1(图3D)。
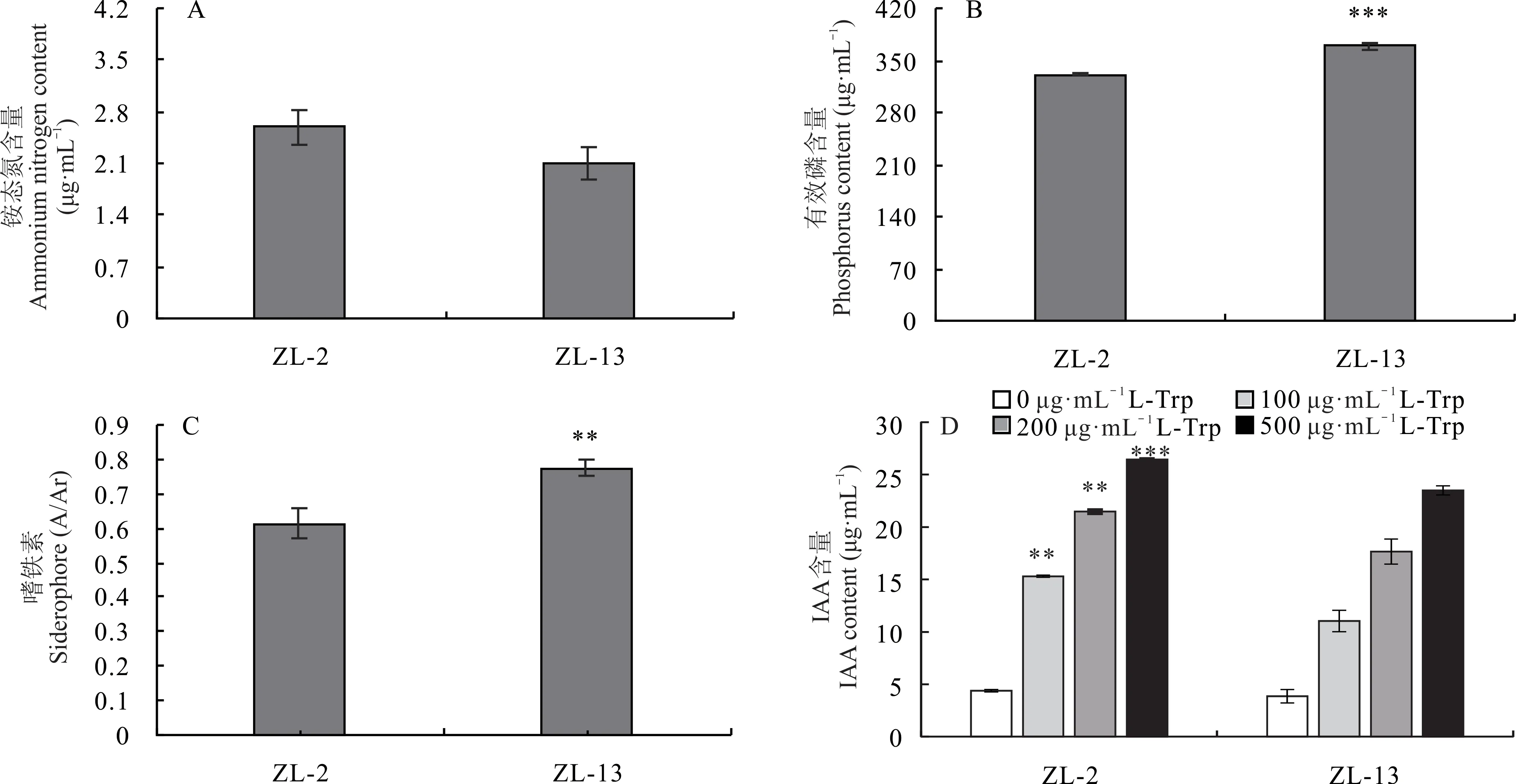
图3 菌株ZL-2 和ZL-13 泌铵、溶磷、产嗜铁素及合成IAA 能力Fig.3 Ammonium secretion, phosphorus solubilization, iron carrier and IAA production abilities of strains ZL-2 and ZL-13
2.4 固氮菌对盆栽青贮玉米促生能力的影响
接种菌株ZL-2 和ZL-13 的青贮玉米株高较对照分别增加了46.16%和37.14%(P<0.05),根长分别增加了40.26%和54.28%(P<0.05),地上鲜重、干重分别增加55.10%和50.73%、54.89%和47.74%(P<0.05),地下鲜重、干重分别增加51.03%和53.93%、46.63%和47.75%(P<0.05)(表3)。试验结果表明,在盆栽条件下,接种固氮菌显著促进了青贮玉米的生长(P<0.05)。

表3 接种菌株ZL-2 和ZL-13 对青贮玉米幼苗生物量的影响Table 3 Effect of strains ZL-2 and ZL-13 inoculated on the biomass of silage maize seedlings
与对照相比,接种固氮菌ZL-2 和ZL-13 根系活力分别提高了33.90%和37.97%(P<0.05)(图4A),可溶性糖含量分别提高了56.90%和44.66%(P<0.05)(图4B),叶片铵态氮含量分别提高了369.94%和260.12%(P<0.05)(图4C),可溶性蛋白含量分别提高了77.67%和76.59%(P<0.05)(图4D)。
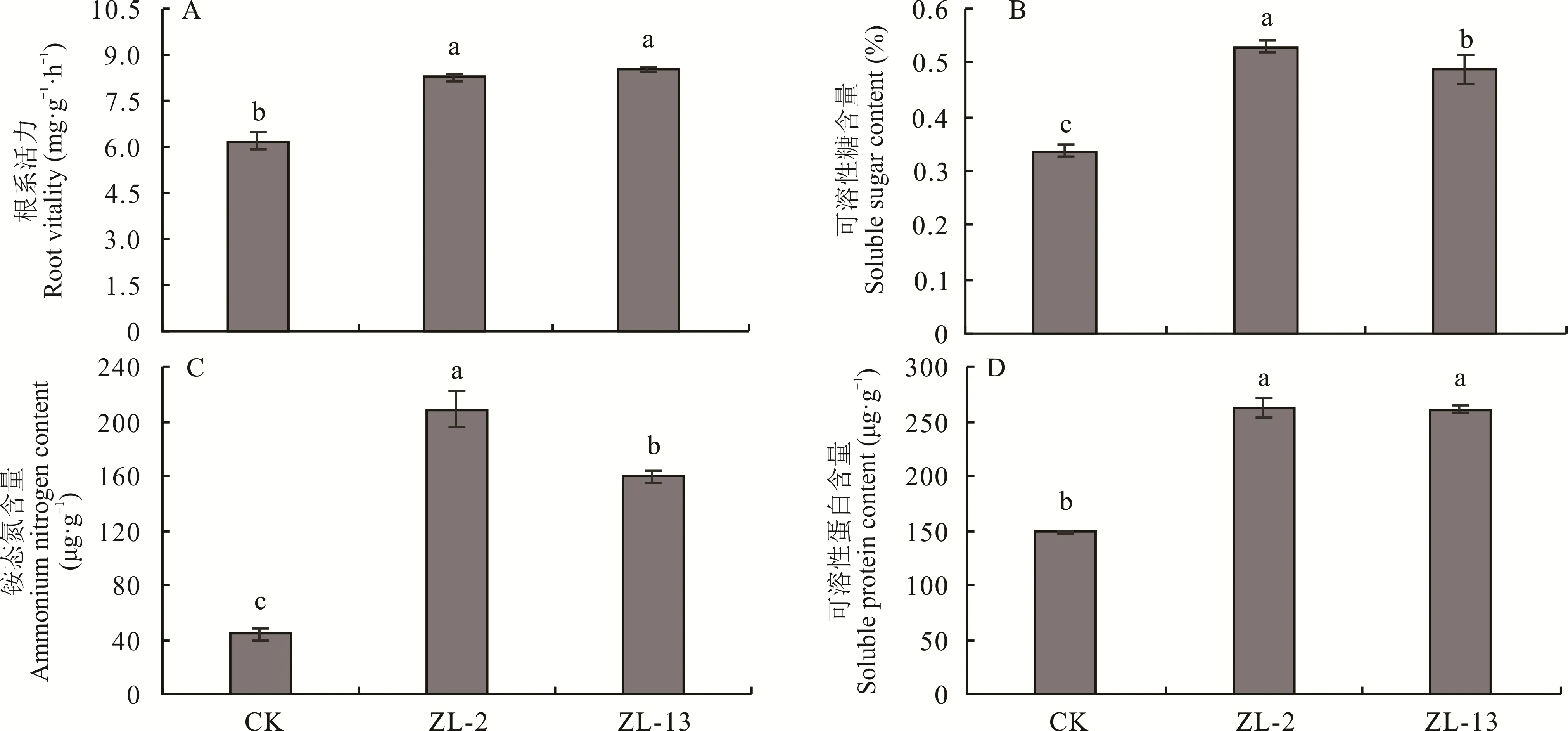
图4 接种菌株ZL-2 和ZL-13 对青贮玉米生理特性的影响Fig.4 Effect of strains ZL-2 and ZL-13 inoculated on the physiological characteristics of silage maize
2.5 固氮菌在田间条件下对青贮玉米产量和品质的影响分析
与对照相比,单接种固氮菌株ZL-2、ZL-13 及双接种ZL-2 和ZL-13 青贮玉米株高分别提高了11.91%、10.83% 和13.72%(P<0.05),茎粗分别增加了13.89%、13.43% 和15.86%(P<0.05),鲜重分别增加了20.34%、15.82%和23.73%(P<0.05),干重分别增加了22.41%、16.38%和29.31%(P<0.05)(表4)。表明,无论是单接种固氮菌ZL-2 或ZL-13,还是双接种ZL-2 和ZL-13 对青贮玉米植株均有明显促生作用,提高了青贮玉米的产量,双接种效果更显著。

表4 接种固氮菌对田间青贮玉米生物量的影响Table 4 Effect of nitrogen-fixing strains inoculated on the biomass of silage maize in the field
与对照相比,单接种菌株ZL-2、ZL-13 及双接种ZL-2 和ZL-13 粗蛋白含量分别提高了63.81%、80.31%和173.50%(P<0.05)(图5A),全磷含量分别提高了10.59%、14.69%和26.73%(P<0.05)(图5B)。由此可以看出,田间条件下单接种固氮菌ZL-2、ZL-13 及双接种ZL-2 和ZL-13 均提高了青贮玉米的品质,且双接种效果更好。
2.6 接种固氮菌对青贮玉米的氮代谢和氨同化相关基因表达的影响分析
由图6 可以看出,接种菌株ZL-2 和ZL-13 的青贮玉米,转铵基因ZmAMTB在根、茎、叶中相对表达量显著上调,且接种菌株ZL-2 的玉米ZmAMTB的相对表达量显著高于接种菌株ZL-13(P<0.05)(图6A)。接种固氮菌的青贮玉米,与铵吸收相关基因ZmAMT-4的相对表达量只在根系中显著上调(P<0.05)(图6B)。接种菌株的青贮玉米,氮代谢相关基因ZmGS1-3和ZmGOGAT2,只在叶中显著上调表达,接种ZL-2 和ZL-13 的叶中ZmGS1-3基因相对表达量达到了对照组的1.97 和1.57 倍(图6C),ZmGOGAT2基因相对表达量达到了对照组的1.95 和1.87 倍(P<0.05)(图6D)。
3 讨论
氮是植物生长发育过程中重要的营养元素[35]。固氮菌是一种可进行固氮作用的微生物,通过自身分泌的铵态氮为植株提供氮源,促进植物生长、提高作物产量、改善作物品质,并减少化肥的使用,有利于促进农业的可持续发展[36]。国内外已有研究报道,具有泌铵能力的固氮菌有斯氏假单胞菌(Pseudomonas stutzeri)、巴西固氮螺菌(Azospirillum brasilense)、棕色固氮菌(Azotobacter vinelandii)、枯草芽孢杆菌(Bacillus subtilis)等[37]。本研究从青贮玉米根际土壤中筛选出2 株具有较强泌铵能力的固氮菌株ZL-2 和ZL-13,根据菌落形态、16S rDNA 序列分析和生理生化特征确定菌株ZL-2 为生癌肠杆菌和ZL-13 为成团泛菌。菌株ZL-2 和ZL-13 对青贮玉米有较强的促生效果,具有研制青贮玉米微生物菌剂的潜力,同时也丰富了固氮菌种资源。
有研究表明,固氮菌通过多种促生机制来刺激植物生长,包括泌铵、溶磷、植物激素(IAA)和铁载体的产生[38]。固氮菌分泌的铵态氮和土壤中的铵态氮均可为植物提供充足的氮元素,NH4+参与植物体内的氮代谢以及氨同化,接种固氮菌后提高了玉米蛋白含量[10]。Islam 等[39]报道接种具有固氮能力的假单胞菌(Pseudomonas)对辣椒(Capsicum annuum)的株高和干重均有显著影响。黄书超等[40]研究发现,添加固氮菌可促进莴笋(Lactuca sativavar.asparagina)生长、提高可溶性蛋白和可溶性糖含量。本研究筛选出的2 株固氮菌株,在盆栽条件下均显著提高了青贮玉米的生物量、叶片可溶性糖和可溶性蛋白含量。在田间条件下,接种固氮菌株ZL-2、ZL-13 及双接种ZL-2 和ZL-13 均显著提高了青贮玉米的产量。以上结果表明,固氮菌可显著促进青贮玉米生长,提高玉米的生物量。
磷是植物生长发育所需的仅次于氮的第二大营养元素[41],磷在土壤中大多以难溶磷酸盐形式存在,植物无法直接利用,而具有溶磷能力的菌株可将难溶的磷酸盐转化为植物可以直接利用的形式。赵卫松等[42]从番茄(Solanum lycopersicum)的根围土壤中筛选具有溶磷特性的解淀粉芽孢杆菌(Bacillus amyloliquefaciens),接种该菌株显著增加了番茄生物量和植株有效磷含量。在缺铁营养液中添加难溶性铁及具有产嗜铁素能力的菌株发酵滤液,可显著增加黄瓜(Cucumis sativus)幼苗的株高、根长、叶长和鲜重[43]。研究表明,根际细菌产生IAA 与植物生长促进有关,特别是根系起始和伸长[44]。将分泌IAA 的Pseudarthrobactersp. 接种到水杨梅(Geum aleppicum)上可以刺激根系发育,促进水杨梅的地上和根的生长[45]。Zhang 等[46]从木薯(Manihot esculenta)中分离获得一株具有合成IAA 和溶磷能力的固氮菌,接种该菌株促进了木薯的生长,表明这不仅是菌株固氮作用的结果,而且与固氮菌合成IAA 和溶磷能力有关。在本研究中,盆栽青贮玉米接种ZL-2 和ZL-13 后,幼苗的地上干鲜重、地下干鲜重显著高于对照组(P<0.05)。同时,在大田条件下单接种菌株ZL-2、ZL-13 及双接种ZL-2 和ZL-13 均增加青贮玉米的全磷和粗蛋白含量。接种固氮菌显著提高青贮玉米的生物量和品质,这可能是由于该固氮菌株具有较强的泌铵、合成IAA、产嗜铁素和溶磷的能力。
氮在植物的生命过程中发挥着重要的作用,氮同化是植物利用氮素的一个中心环节,其中铵态氮同化是氮同化中最为关键的一步[47],铵处在整个氮同化代谢的重要位置[48]。李红梅等[33]对玉米转铵蛋白家族进行分析发现ZmAMT-4在玉米的根中表达,可能在根对铵根离子吸收中发挥重要的作用。徐晓鹏等[47]提出植物体内铵态氮同化机制都是通过谷氨酰胺合成酶/谷氨酸合成酶(glutamine synthetase/glutamate synthetase,GS/GOGAT)途径进行。玉米吸收NH4+进入植物体后,一部分NH4+直接参与氮同化代谢过程;另一部分NH4+与植物体内谷氨酸结合,在谷氨酰胺合成酶和谷氨酸合成酶的调控下参与氨同化过程,进而参与氮同化代谢过程[49-50]。本研究发现青贮玉米接种ZL-2 和ZL-13 后,ZmAMT-4基因在根部显著上调表达,ZmAMTB基因在根茎叶中均显著上调表达(P<0.05),说明ZmAMTB基因可能与铵根离子在各个组织中的分布有关。ZmGS1-3基因和ZmGOGAT2基因集中在叶显著上调表达(P<0.05),这可能是青贮玉米叶片铵态氮含量增加的原因。这从分子水平上进一步证明了,接种固氮菌提高了青贮玉米的氮代谢和氨同化能力,进而提高青贮玉米的品质。
4 结论
从青贮玉米根际土壤中筛选出2 株具有泌铵和多重PGPR 特性的固氮菌,分别为生癌肠杆菌和成团泛菌。盆栽试验结果表明,接种2 株固氮菌均可促进青贮玉米的生长。田间试验结果表明,单接种固氮菌ZL-2、ZL-13及双接种ZL-2 和ZL-13 均可促进青贮玉米的生长,提高青贮玉米的产量和品质。接种固氮菌ZL-2 和ZL-13 还可以促进青贮玉米的氮代谢和氨同化相关基因的表达。固氮菌ZL-2 和ZL-13 可作为开发微生物制剂的优质菌种资源。
