益气活血方通过Ghrelin 对机械通气肺损伤大鼠肺组织的保护机制研究*
2024-03-22宋文龙李瑾
宋文龙 李瑾
(浙江省建德市中西医结合医院 建德 311600)
机械通气是临床常用的一种治疗方法,而机械通气肺损伤(Ventilator-Induced Lung Injury,VILI)作为其最常见的并发症之一,受到临床越来越多的关注。VILI 多由通气时反生理正压通气引起,具体病因包括机械通气时机械外力对肺组织的直接损伤,以及肺部和循环系统中炎症通路的激活及炎性因子的释放对肺组织产生损伤等不良影响,临床上不能及时诊断与治疗VILI 往往会导致病情加重甚至死亡[1]。因此以研究VILI 发病机制为着眼点从而更有效减少VILI 的发生,具有重要的临床意义。Ghrelin 为生长激素促分泌素受体(GHSR)的内源性配体[2~4],是一种小分子活性肽,在人体各部位均有不同程度的表达,其中也包括肺部。目前发现Ghrelin 可以改善血管内皮功能,包括抑制肾素-血管紧张素(RAS)系统、促进血管新生及减轻炎症反应等,其在体内是否参与了VILI 的发病过程,目前还少见报道,本研究以SD 大鼠为研究对象,在机械通气后加用益气活血方灌胃,通过益气活血方进行干预,并观察SD大鼠肺组织变化及血清和肺泡灌洗液中Ghrelin、血管紧张素Ⅱ(AngⅡ)、肾素、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)表达的变化以评价益气活血方在VILI 中的作用。现报道如下:
1 材料
1.1 动物 实验动物共40 只,体质量330~360 g,年龄10 周龄SPF 雄性SD 大鼠,许可证号:SCXK(沪)2017-0012,合格证号:2017005012875。
1.2 药物及试剂
1.2.1 益气活血方 组成:黄芪30 g,党参15 g,炒白术15 g,茯苓15 g,当归10 g,丹参10 g,地龙6 g,川芎15 g,补骨脂10g,炙甘草10 g。饮片均由医院药剂科提供,《中药药理研究方法学》[5]计算出人鼠等效剂量为11.98 g/kg,并由煎药室制成100%煎剂[6],均加热至70℃的后旋转蒸发,将药剂浓缩成每毫升含生药量3.6 g。
1.2.2 试剂 (1)AngⅡ酶联免疫吸附法(ELISA)检测试剂盒:货号CEA005 Ra。(2)肾素ELISA 检测试剂盒:货号SEA889 Ra,均购自武汉优尔生;IL-6 ELISA 检测试剂盒:货号CEA991Ra。(3)Ghrelin ELISA 检测试剂盒:货号EK306/3。(4)TNF-α ELISA 检测试剂盒:货号EK382/3,均购自联科生物。(5) 高纯总RNA 快速提取试剂盒:货号GK3016,批次1703G01,购自Generay 公司。(6)逆转录试剂盒:货号R222-01,批次7E092G6,购自Vazyme 公司。(7)PrimeScriptTMRT reagent Kit:货号RR037A,批次AK5302-1,购自TaKaRa 公司。(8)qPCR 试剂:货号Q411-02,批次7E092H6,购自Vazyme 公司。实验用引物由上海桑尼生物科技有限公司提纯、合成,试剂由其他公司提纯。生理盐水:辰欣药业有限公司,批号1608230727。
1.3 仪器及软件 轮转式切片机:RM2235 型,LEICA,编号HB215;病理组织漂烘仪:TEC2500,常州郝思琳仪器设备,编号HB121;显微镜:BX43 型,OLYMPUS 公司,编号HB133;恒温培养箱:PYX-DHS500BS-Ⅱ型,上海跃进医疗器械,编号HB123;海尔BCD-216 冰箱;定量PCR 仪为CFX Connect Real-Time PCR System;相关耗材(Tip 头、EP 管等)购自Kirgen 公司。
2 研究方法
2.1 动物模型分组及给药方法 将40 只SD 大鼠按实验设计随机分成模型组、中药组、阳性药物组、空白组,每组10 只。将模型组、中药组、阳性药物组实验大鼠经麻醉后行气管插管术,然后通过胶管将气管插管与动物人工呼吸机相连接, 并行机械通气(其中阳性药物组造模前30 min 腹腔给药Ghrelin,剂量25μg/kg),大鼠通气参数设置均为频率60 次/min,吸/呼比1:3,吸入氧浓度(FiO2)21%,通气时间均分别为6 h,潮气量大小为12 ml/kg。通气结束后,各组大鼠继续饲养2 周,期间空白组不做处理,继续室内恒温恒湿下自由进食,中药组造模后饲养2 周,连续灌胃中药1 ml/d,阳性药物组及模型组造模后饲养2 周,灌胃2 ml/d 生理盐水。
2.2 实验标本收集 2 周后各组大鼠经乙醚麻醉后取腹主动脉血离心分离血清冻存,结扎右肺气管,左肺进行灌洗取肺泡灌洗液,同时取右肺上叶进行4%甲醛固定行病理切片,其余肺组织冻存后进行后续检测。
2.3 ELISA 法检测Ghrelin、AngⅡ、IL-6、TNF-α 表达水平 将Ghrelin、AngⅡ、IL-6、TNF-α 试剂盒在室温条件下进行平衡后,按说明书分别配置标准品梯度溶液。(1)加样:溶解标准品,将标准品用标准品稀释液梯度稀释标记为1#、2#、3#、4#、5#,浓度依次降低,设置6#空白对照孔;标准品孔加入50 μl 2 倍倍比稀释的标准品,空白孔加入50 μl 标准品稀释液,其余孔加入待测样本50 μl,再加入100 μl 检测溶液A,加上覆膜,37℃下孵育1 h;(2)弃去液体每孔加入350 μl 1×Washing buffer 清洗,浸泡1 min,吸水纸上轻拍移除孔内液体,重复3 次;(3)每孔加入100 μl 检测溶液B,加覆膜,37℃下孵育0.5 h;(4)弃去液体每孔加入350 μl 1×Washing buffer 清洗,浸泡1 min,吸水纸上轻拍移除孔内液体,重复5 次;(5)每孔中分别加90 μl TMB 底物溶液,室温避光孵育5~30 min;(6) 在每孔中加入50 μl Stop Solution,轻轻混匀,单波长或者双波长读取OD 值,进行数据分析。
2.4 PCR 检测大鼠肺组织IL-6、TNF-α mRNA 表达水平 Trizol 一步法提取肺组织总RNA,分光光度计检测总RNA 浓度,按反转录试剂盒要求逆转录成cDNA。取适量cDNA,加入相应引物后PCR扩增(各组引物序列详见表1),最终反应体系为20 μl。扩增条件为95℃预变性30 s,95℃变性10 s,(60℃)退火30 s,40 个循环后,70~95℃再充分延伸10 min。电泳后凝胶成像,行扫描定量分析,以各组净光密度与β-Actin 间比值代表半定量值。

表1 引物序列
表2 各组大鼠肺含水量()
表2 各组大鼠肺含水量()
注:与空白组相比,*P<0.05。
?
2.5 肺湿干重(W/D)比值测定 取大鼠右肺(一叶)组织称量湿重后置于烘箱中,70℃烘烤至恒重后称干重,计算肺含水量。
2.6 观察肺组织病理学改变 将上述石蜡包埋的肺组织标本切片行苏木精-伊红染色后,通过光学显微镜下观察肺组织结构、肺内炎性细胞浸润及分类等改变。
2.7 统计学分析 采用SPSS22.0 软件进行统计学分析,计量资料以()表示,组间比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
3 结果
3.1 各组肺含水量比较 经机械通气饲喂2 周后,与空白组肺大鼠组织干湿比重(4.668 2±0.392 1)相比,模型组有所升高(5.046 6±0.235 4),两组间比较差异有统计学意义(P<0.05)。同时,虽机械通气前后分别经药物干预,与模型组相比,中药组(4.916 6±0.510 1),阳性药物组(4.922 0±0.052 8)干湿比重均有所降低,但差异仍无统计学意义(P>0.05)。实验表明机械通气后用中药、阳性药物干预,对大鼠肺组织干湿比均未造成无明显影响。见图1 至图4。
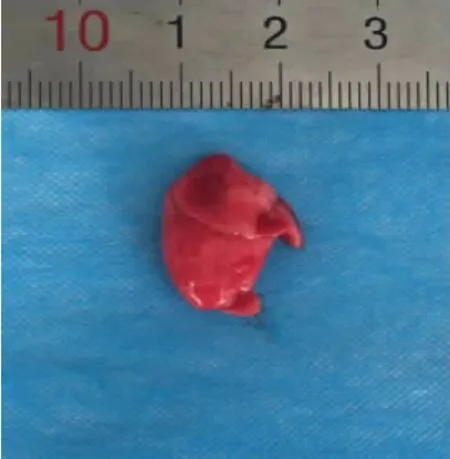
图1 空白组
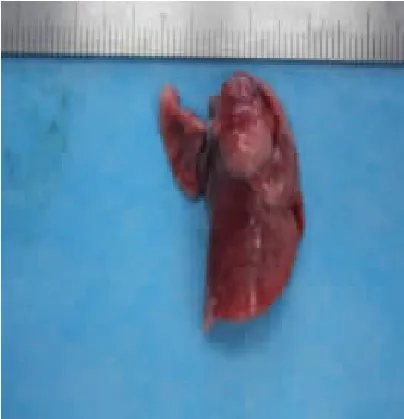
图2 模型组
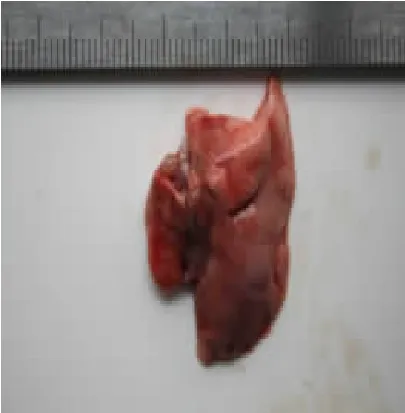
图3 中药组
图4 阳性药物组
3.2 各组肺组织HE 将大鼠肺组织经HE 染色后发现空白组大鼠肺组织无明显病理改变;中药组和阳性药物组肺组织HE 染色后可见其充血和炎症细胞浸润有所减轻;而与之形成鲜明对比的是,经机械通气后,虽继续饲喂2 周,模型组大鼠肺组织仍可见肺泡间隔增宽、塌陷,肺间质可见明显渗出和炎症浸润。见图5 至图8。
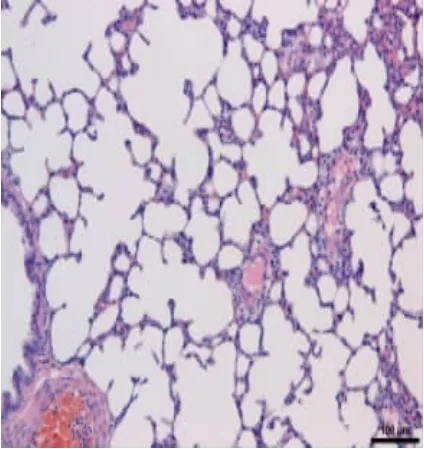
图5 空白组

图6 模型组
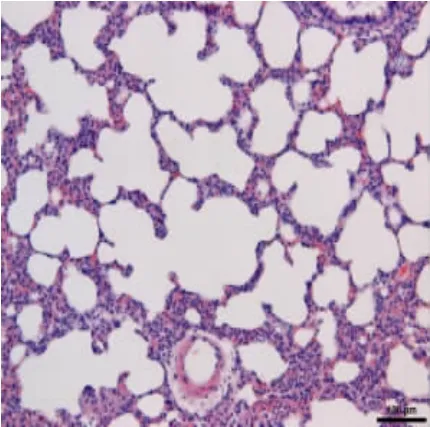
图7 中药组

图8 阳性药物组
3.3 各组肺泡支气管灌洗液及血清中TNF-α、IL-6表达 通过对比空白组、模型组、中药组及阳性药物组肺泡灌洗液和血清样本中IL-6 和TNF-α 表达发现同空白组相比,经机械通气处理后,模型组大鼠肺泡灌洗液及血清中IL-6 和TNF-α 含量均明显升高;而与之形成强烈对比的是,中药组和阳性药物组IL-6 和TNF-α 含量均下降,且阳性药物组下降较中药组更为明显。见表3。
表3 肺泡支气管灌洗液、血清中不同组别IL-6 和TNF-α 的表达比较(pg/ml,)
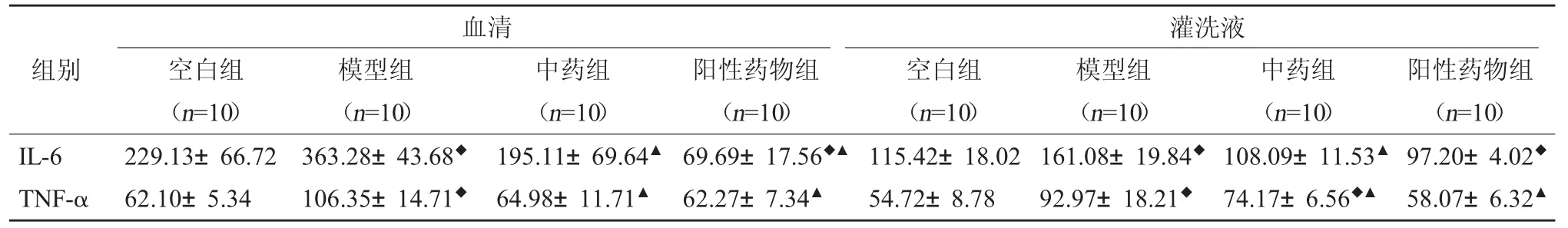
表3 肺泡支气管灌洗液、血清中不同组别IL-6 和TNF-α 的表达比较(pg/ml,)
注:与空白组相比,◆P<0.01;与模型组相比,▲P<0.01。
?
3.4 各组大鼠肺组织、血清中Ghrelin、AngⅡ、肾素表达 模型组大鼠经机械通气后肺组织和血清中AngII 和肾素含量均较空白组升高;中药组和阳性药物组通过中药及药物预处理后使大鼠AngⅡ和肾素表达下降;Ghrelin 则与上述两项指标呈相反的表达趋势,经机械通气后,模型组大鼠肺组织和血清中Ghrelin 表达较空白组下降,经中药干预和阳性药物预处理后两组大鼠Ghrelin 表达较模型组上升。见表4。
表4 各组肺组织、血清中检测不同组别Ghrelin、AngⅡ、肾素表达比较()

表4 各组肺组织、血清中检测不同组别Ghrelin、AngⅡ、肾素表达比较()
注:肺组织中各个指标的含量计算,用肺组织裂解液总蛋白水平进行校准后得到的表达含量(pg/mg)。与空白组相比,*P<0.05,◆P<0.01;与模型组相比,▲P<0.01。
?
3.5 各组大鼠肺组织IL-6、TNF-α mRNA 表达水平 经机械通气处理后,PCR 检测大鼠肺组织IL-6、TNF-α mRNA 表达水平后发现模型组大鼠肺组织中IL-6、TNF-α 基因表达水平均较空白组升高;且机械通气后中药干预和通气前阳性药物预处理,均可使大鼠IL-6、TNF-α 基因表达水平降低。见表5。
表5 各组IL-6、TNF-α 相对表达水平比较()
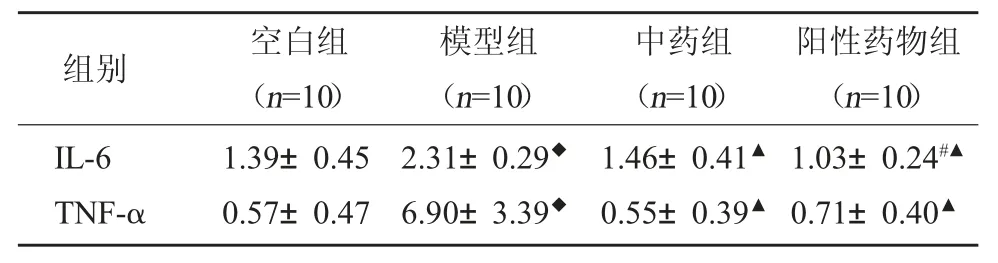
表5 各组IL-6、TNF-α 相对表达水平比较()
注:与空白组比较,◆P<0.01;与模型组比较,#P<0.05,▲P<0.01。
?
4 讨论
VILI 是在行机械通气治疗中最常出现的并发症之一,其发病率呈现出逐年递增的趋势[7],而导致VILI 产生的机制尚待研究完善,中医学虽无出现完全对应的病名,但对相类似的临床表现则早有认识,如历代医著曾有与现代医学VILI 相类似症状的记载,以由“外感、外伤、疮疡、产后、亡血”等诱因所致,无明显心胸疾患而以呼吸急促为突出表现的喘证症状则多见。故根据其临床表现及疾病演变过程的认识,可将VILI 归属于“暴喘、喘脱”的范畴[8~9]。
临床上VILI 在行有创或无创治疗的呼吸系统疾病患者中多见,该类患者大多病久体虚,肺气不足,肺气亏虚,古语云“气为血之帅”,气虚难以统帅血液正常运行,血行不畅,故血行瘀滞,而肺气愈壅滞,胸赢满闷,发为喘;另古语云“肺朝百脉”,全身血脉皆聚于肺,而“肺主气,司呼吸”,肺气与血液运行息息相关,肺气壅滞,则肺气失司,不能正常宣发与肃降,继肺气郁阻,血行不畅,发而为喘。又有“气有一息不运,则血有一息不行”,综上均说明肺气逆乱,继血行不畅,故将气虚血瘀认为是VILI 中医发病的基础[10~13],这也同时与VILI 时肺的微循环病理改变相对应。基于对VILI 中医发病基础的认识,在国医大师洪广祥补元汤的基础上拟定了益气活血方治疗VILI,可使肺气充盛,气血通畅,瘀血自除[14~15],临床上取得了一定疗效。VILI 临床上常见为气压伤、肺水肿等,其病因复杂[16~18],为了进一步评价益气活血方对VILI 的作用,通过动物呼吸机模拟高气道压通气成功复制了VILI 模型,结果表明,同空白组对比,模型组大鼠肺组织W/D 比值升高,且肺组织和血清汇总IL-6 和TNF-α 含量均上升[19],镜下可见模型组大鼠肺泡间隔增宽、塌陷,有较多炎症细胞聚集在肺间质,并且有部分肺泡腔出血合并有广泛渗出。
Ghrelin 作为目前已知的一个促生长激素分泌素受体的内源性配体[2~3],既能促进生长激素释放,又能增加进食的欲望、达到使生命体积蓄能量增加体质量的目的,可平衡能量代谢,改善血管内皮功能等。与此同时,有研究[20]通过对比COPD 急性加重期患者与COPD 缓解期患者血浆中TNF-α、IL-6、Ghrelin 水平发现,急性加重期患者较之缓解期患者而言,其血浆中TNF-α、IL-6、Ghrelin 水平明显呈现出上升趋势,表明了内源性Ghrelin 水平可能与诱发COPD 患者急性加重的炎症相关,从而提示炎症环境可以刺激内源性Ghrelin 水平的增高。通过本研究发现,模型组大鼠肺组织和血清中Ghrelin 表达较空白组下降,而经益气活血方灌胃和阳性药物处理后两组大鼠Ghrelin 表达较模型组上升,AngⅡ和肾素则出现明显下降趋势,血清、肺泡灌洗液及肺组织中IL-6、TNF-α 表达下调,肺组织病理减轻,提示Ghrelin 可抑制AngⅡ和肾素的表达进而减轻机械通气大鼠肺部的炎症反应。
