2型糖尿病对非缺血性扩张型心肌病患者左心室应变影响
2024-03-21阚傲李淑豪刘巧陶欣慰龚良庚
阚傲,李淑豪,刘巧,陶欣慰,龚良庚
非缺血性扩张型心肌病(non-ischemic dilated cardiomyopathy,NIDCM)是单侧或双侧心腔扩大伴收缩功能障碍,但排除负荷异常(高血压、瓣膜病)及冠状动脉疾病的心肌病[1]。NIDCM患者的主要病理改变为血管周围及间质纤维化[2]。2型糖尿病(type 2 diabetes mellitus,T2DM)可致心肌间质纤维化程度进一步加重[3]。NIDCM及T2DM均可导致左室形态、功能及组织特征改变,最终进展为心力衰竭。近期研究表明,合并T2DM将使NIDCM患者的预后进一步恶化[4],但合并T2DM对NIDCM患者左室功能、结构、心肌运动及组织特征的影响尚需要进一步探究。心脏磁共振组织追踪技术(cardiovascular magnetic resonance feature tracking technology,CMR-FT)可基于心脏电影序列定量测量心肌整体及节段应变。心肌应变可准确反映心肌细微的运动变化,在射血分数降低前识别心肌早期结构及功能改变,且与多种心肌病的预后相关[5-8]。延迟钆增强(late gadolinium enhancement,LGE)成像是目前CMR最常用的表征心肌组织纤维化的方法。本研究通过CMR-FT技术及LGE成像评估T2DM对NIDCM患者左室功能、应变及组织特征的影响,探究NIDCM应变的独立临床预测因子,为NIDCM患者的风险分层及临床管理提供更多依据。
材料与方法
1.一般资料
回顾性收集2018年6月-2022年1月在本院接受CMR检查确诊且合并T2DM的NIDCM患者18例[NIDCM(T2DM+)组],年龄及性别匹配的无T2DM病史的NIDCM患者20例[NIDCM(T2DM-)组]以及健康受试者20例(健康对照组)。NIDCM患者纳入标准:左心室或双心室收缩功能不全[左室射血分数(left ventricle ejection fraction,LVEF)<45%]伴心室扩张,且排除负荷异常、冠状动脉狭窄等疾病[5]。NIDCM患者排除标准:①排除先天性心脏病(如心脏瓣膜病、肥厚性心肌病、左室心肌致密化不全)、缺血性心脏病、急性心肌炎、其他代谢疾病等所致心脏增大;②梗死形式LGE即心内膜下及透壁型LGE[9];③图像伪影大,干扰诊断;④临床资料不全。对照组纳入标准:①无心血管疾病病史;②CMR检查正常。最终共纳入38例NIDCM患者,男27例,女11例,年龄31~87(56.32±12.81)岁。健康对照组共纳入20例,男14例,女6例,年龄34~79,平均(57.95±22.5)岁。收集所有受试者的临床资料包括糖化血红蛋白(glycated hemoglobin,HbA1c)、B型利钠肽(brain natriuretic peptide,BNP)等生化指标。本研究经过本院医学伦理委员会批准(批准文号:IIT-2022-175),免除受试者知情同意。
2.CMR扫描方案
采用GE 3.0T磁共振扫描仪(Signa HDxt,Discovery MR750W,America),所有图像结合心电门控和呼吸门控进行采集。心脏电影序列:采用快速平衡稳态自由进动序列获取心脏标准短轴、两腔、三腔及四腔心的电影图像,扫描参数:TR 3.9 ms,TE 1.6 ms,视野38 cm×38 cm;重建矩阵256×256,翻转角55°,层厚6 mm,层间距0 mm。LGE序列采用反转恢复快速梯度回波序列,静脉注射对比剂加乐显(拜耳药业,德国)后延迟8~10 min,开始扫描心脏标准短轴、两腔及四腔心,短轴覆盖左心室基底部至心尖部范围。对比剂剂量0.2 mmol/kg,注射流率3 mL/s,并使用10~20 mL生理盐水冲管。
3.图像后处理
CMR原始图像导入后处理软件CVI 42(Circle Cardiovascular Imaging,Calgary,Canada),心功能分析依据左室短轴电影序列,采用自动追踪技术勾画左室收缩及舒张末期心内外轮廓,若轮廓追踪不准则手动调整,心功能参数包括LVEF、左室舒张末期容积(left ventricular end-diastolic volume,LVEDV)、左室收缩末期容积(left ventricular end-systolic volume,LVESV)、左室质量(left ventricular mass,LVM)。应用Strain应变模块进行心肌应变后处理。应变分析是依据左室短轴、长轴(两腔、三腔及四腔)电影序列,于左室舒张末期勾画左室心内外膜(图1)。在左室短轴位室间隔上标出心肌分段参考点,将左室分为基底部、中间部及心尖部,得到心肌整体及各节段的应变值,应变参数包括3D整体及节段的径向应变(radial strain,RS)、周向应变(circumferential strain,CS)及纵向应变(longitudinal strain,LS),见图2。由一名有5年以上心血管疾病诊断经验的放射科主治医师判断有无LGE、LGE位置(室间隔、游离壁、室间隔伴游离壁)、LGE模式,并应用组织信号强度模块,逐层勾画左室心内膜、外膜边界,以同一层面内正常心肌为参考,将超出正常心肌5倍标准差以上的区域定义为延迟强化区域,最后自动获得LGE范围(延迟强化区域的质量与左室心肌质量的比值),见图3。
4.统计学分析

图1 CMR-FT左室应变测量示意图。a)左室舒张末期短轴位;b)长轴位四腔心;c)三腔心;d)两腔心。红色为左心室心内膜线,绿色为左心室心外膜线。

图2 女,67岁,非缺血性扩张型心肌病合并糖尿病。a)左室径向的时间-整体应变曲线图;b)左室周向的时间-整体应变曲线图;c)左室纵向的时间-整体应变曲线图;d)左室基底部、中间部及心尖部径向的时间-局部应变曲线图;e)左室基底部、中间部及心尖部周向的时间-局部应变曲线图;f)左室基底部、中间部及心尖部纵向的时间-局部应变曲线图。
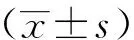
结 果
1.一般临床资料
根据T2DM病史将NIDCM组患者分为NIDCM(T2DM-)组、NIDCM(T2DM+)组。三组的一般临床资料见表1。三组年龄、性别、身高、体重、体表面积(body surface area,BSA)、心率及血脂异常差异均无统计学意义(P>0.05)。NIDCM(T2DM+)组HbA1c、高血压患病率高于NIDCM(T2DM-)组及对照组,差异有统计学意义(P均<0.01)。NIDCM(T2DM+)组eGFR显著低于对照组(P=0.006),两组NIDCM患者BNP均显著高于对照组(P均<0.001),但两组NIDCM患者间BNP、eGFR无显著差异(P>0.05)。

图3 男,68岁,非缺血性扩张型心肌病合并糖尿病。a)钆延迟强化短轴图像示左室壁中层广泛环形强化;b、c)延迟强化下左室心肌信号强度>正常心肌+5SD区域,定义为延迟强化区域(图中黄色部分所示);d)延迟强化范围牛眼图,最终强化范围为13.6%(延迟强化区域的质量与左室心肌质量的比值)。

表1 NIDCM组与对照组的一般临床资料比较

表2 NIDCM组与对照组常规心功能指标比较
2.常规心功能参数及LGE
两组NIDCM患者LVEDV/BSA、LVESV/BSA、LVM/BSA 均较对照组增高(P<0.001),LVEF、LVSV/BSA较对照组减低(P<0.001、P=0.046),差异有统计学意义。但两组NIDCM患者间常规心功能参数及LGE阳性比例差异均无统计学意义(表2)。
3.左室3D整体及节段应变指标
NIDCM(T2DM+)、NIDCM(T2DM-)及健康对照组的左室3D整体及节段应变分布见表3。两组NIDCM患者各方向整体及节段应变值均较对照组降低,差异有统计学意义(P值均<0.001)。NIDCM(T2DM+)组心尖部CS、LS及整体CS均较NIDCM(T2DM-)组降低,差异有统计学意义(P值均<0.05),两组NIDCM患者间其余应变指标无显著差异。
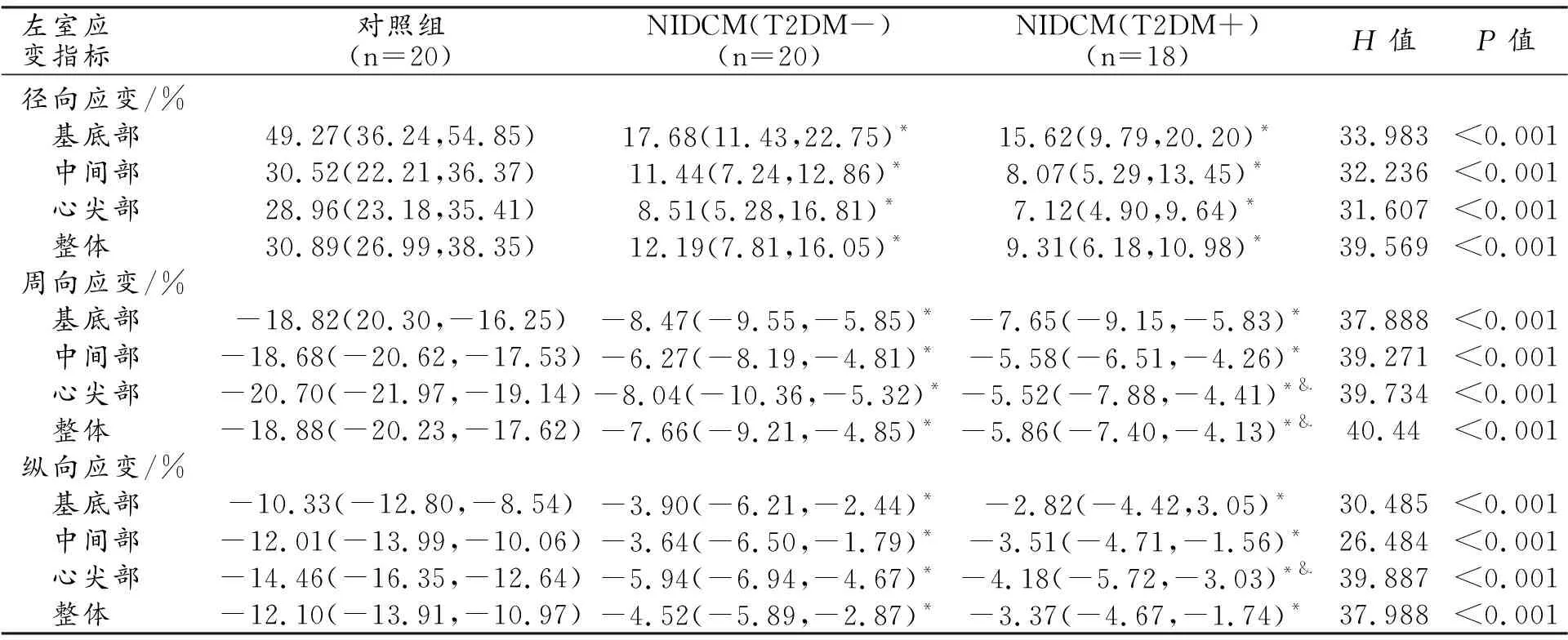
表3 NIDCM组与对照组左室应变指标比较
NIDCM患者的左室3D整体及节段应变示意图见图2。
4.两组NIDCM患者左室LGE分布特征
两组患者LGE阳性率差异无统计学意义(P=1.000,表4)。两组NIDCM患者LGE更易表现为室间隔及游离壁同时受累,且肌壁间受累更常见,但Fisher-Freeman-Halton检验及卡方检验证实LGE位置分布在两组间差异无统计学意义(P=0.274)。虽然NIDCM(T2DM+)组患者的LGE范围稍大,但两组间差异无统计学意义(P=0.292)。
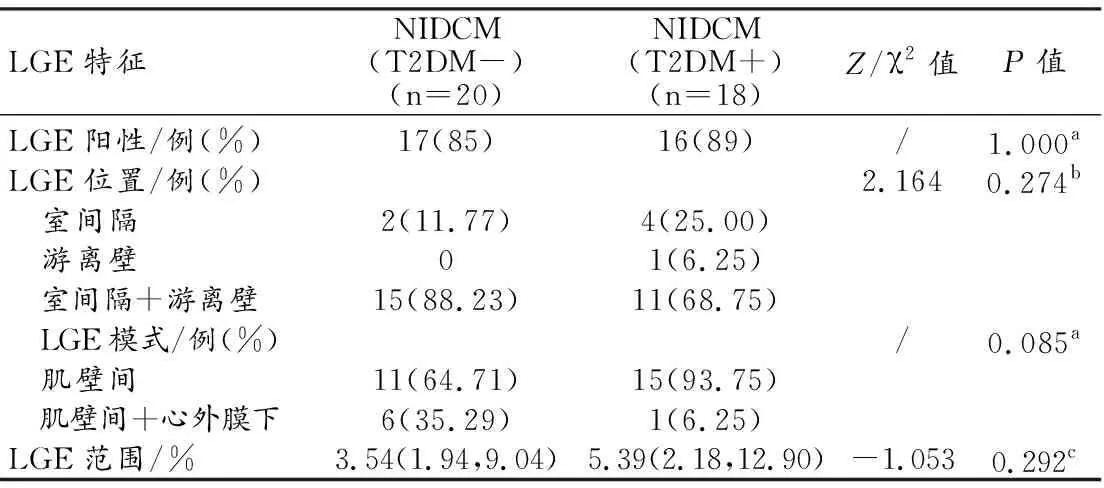
表4 两组NIDCM患者左室LGE分布特征比较
5.NIDCM患者左室整体应变变化的预测因子
将本次研究中纳入的临床变量及LGE阳性率、LGE范围纳入一元线性回归分析,判断NIDCM患者左室整体应变的重要临床预测因子,结果提示T2DM为左室整体CS(β=0.35,P=0.031)和LS(β=0.354,P=0.029)的重要临床预测因子(表5)。
讨 论
T2DM是冠心病患者发生心衰的主要危险因素,但T2DM是否会加重NIDCM等非冠状动脉疾病的心衰风险尚不清楚[10],因此本研究通过CMR-FT及LGE技术定量、定性评估T2DM对NIDCM患者的左室结构、功能、应变及组织特征的影响,进一步阐述T2DM对NIDCM患者的不良影响。本研究发现尽管合并与不合并T2DM的NIDCM患者LVEF、LVCI等常规心功能参数及LGE特征均无显著差异,但CMR-FT技术发现合并T2DM将导致NIDCM患者整体及节段应变进一步下降,且一元线性回归分析显示T2DM为左室整体RS、CS下降的独立预测因子。
表5 NIDCM组左室应变指标与相关临床指标一元线性回归分析
心室的舒缩运动是包含纵向、径向以及周向在内的整体协调运动,基于心脏电影序列的CMR-FT技术可精准定量评估心肌整体及节段运动,得到不同部位、不同时相的多参数心肌应变数据,提供了较LVEF等传统心功能参数更高的临床价值[11]。在本次研究中两组NIDCM患者的整体及节段左室应变均较健康对照组明显降低,这与既往研究结果一致[12-15]。
合并T2DM的NIDCM患者心脏改变的潜在机制十分复杂,尚不完全清晰,在心肌组织学方面,合并T2DM的NIDCM患者肌原纤维溶解,心肌线粒体变性加重,导致心肌进一步纤维化[16],这可能是本次研究中NIDCM(T2DM+)组患者较NIDCM(T2DM-)组患者LGE范围稍大的原因。但两组之间LGE阳性率、位置、分布模式均无显著差异,未来需要更多大样本进一步探究T2DM对NIDCM患者心肌纤维化等组织特征的影响。
在心肌代谢方面,DCM患者心肌摄取和利用底物由脂肪酸向葡萄糖转化,但在心脏负荷增加时无法增加相应葡萄糖摄取。合并T2DM将导致NIDCM患者心肌活性氧水平增高至5倍,降低心肌代谢敏感度,加重NIDCM患者心肌代谢异常,导致心肌顺应性减弱及心肌应力降低[17,18],这可能是本次研究中NIDCM(T2DM+)患者整体CS、心尖部CS和LS较NIDCM(T2DM-)患者显著降低的原因。但Shen等[19]通过CMR-FT技术发现合并T2DM将导致NIDCM患者3个方向的整体应力值均进一步显著降低,造成这种差异可能的原因是既往研究中左室整体LS在LVEF下降前便出现降低,此时整体CS将不同程度增加,代偿性维持正常LVEF[20,21]。而本次研究中两组NIDCM患者LVEF均显著降低(均<30%,且未见明显差异),因此整体CS失去代偿作用而降低,且合并T2DM将进一步加重整体CS,这表明在LVEF显著降低的NIDCM患者中整体CS可较LVEF更敏感发现心肌运动损伤,为临床的早期诊断及治疗提供更可靠的依据。本研究不但探讨了T2DM对NIDCM患者整体应力的影响,也探讨了相应节段应力的损伤,在本次研究中合并T2DM导致心尖部CS和LS进一步显著降低,可能的原因是心尖部心肌纤维走形复杂,斜行走形的心外膜下心肌于心尖处转入深层,延续为心内膜下心肌,故心尖部心肌纤维走行较复杂,较基底部、中间部运动稳定性差[14],因此心尖部应力受T2DM所致心肌异常代谢影响更显著。
一元线性回归分析结果提示T2DM病史为左室整体LS、CS下降的重要临床预测因子。Shu等[7]研究发现整体CS是重度扩张性心肌病患者(LVEF<35%)风险分层及结局预测的有力指标,预测能力强于LVEF。而Li等[22]研究发现整体LS降低是LVEF≥35%的NIDCM患者发生心衰再入院、全因死亡等复合不良终点事件的重要独立预测因子。而本次研究中T2DM病史为左室整体CS、LS下降的重要临床预测因子,这提示应加强合并T2DM的NIDCM患者的临床管理,严格监测并调控血糖,在出现不可逆性恶性心衰前给予患者积极治疗,降低死亡率,改善患者预后。在既往的研究中HbA1c亦为左室整体应力下降的独立预测因子[4,19],但在本研究中由于合并T2DM的NIDCM患者的人数较少,且均规律服用药物,血糖水平控制尚可,HbA1c均较正常值稍高,对于左室整体应力不具有预测价值。在接下来的研究中将继续收集相关患者,扩大样本量,根据HbA1c水平进一步分组,探究HbA1c对NIDCM患者应变的影响。
本研究存在以下几点局限性:①本次研究纳入的NIDCM(T2DM+)患者数量较少,无法根据糖尿病病程、血糖控制情况、HbA1c水平等进一步分组,未来将进一步扩大样本量,进一步探究T2DM对NIDCM患者应变的影响;②为保证统计结果的稳健性,本次研究未进行多因素线性回归分析,接下来研究中将扩大样本量,探究NIDCM患者左室应力的独立预测因子;③本研究为单中心小样本研究,部分患者随访时间较短,不良心血管事件发生较少,无法探究T2DM对NIDCM患者预后的相关性。
本次研究结果显示T2DM将导致NIDCM患者左室整体及节段应变进一步恶化,且在调整混杂因素后,T2DM仍为NIDCM患者左室整体RC、CS的独立预测因子。
