人在回路深度学习垂体分割模型的建立
2024-03-21冷渌清花蕊石峰陈明吴玉桥朱珠
冷渌清,花蕊,石峰,陈明,吴玉桥,朱珠
垂体作为人体重要的内分泌腺,与其相关病变的诊断与治疗一直受到临床关注,最常见的包括矮小症、肥胖症、垂体增生以及垂体微腺瘤等,特别是矮小症和肥胖症患儿垂体大小检查已成为常规。实际工作中都采用高度值来衡量垂体大小,因大部分垂体形态欠规则,不同的测量点可能造成值的差异性,如果用体积替代高度衡量垂体大小,将减少相应的问题并提高垂体病变检出的敏感性。目前部分设备或软件可以进行体积测量,需人工逐层勾画后计算,操作繁琐,本研究拟通过计算机深度学习,探讨人工智能(artificial intelligence,AI)用于垂体体积自动测量的可行性。
人在回路(human in the loop)机器学习方式是通过人与机器学习过程进行交互,此方法不仅可以增加机器学习的准确性,还可以明显提高人工效率,是近年来AI研究中受到业内认可的方法,通常表现为迭代式建模和纠错[1,2]。
材料与方法
训练数据来源于CoRR(Consortium for Reliability and Reproducibility)公开数据库中5~70岁年龄段颅脑3D T1WI图像1285例。纳入标准:垂体高度3~10 mm,腺垂体与神经垂体显示清晰。按照5~15岁、16~25岁、26~50岁、51~70岁年龄段分成4组,每组随机选择80例,分4批次进行试验,单次每个年龄组随机选择20例,不合格样本剔除后参照随机原则补足。
标注采用Slicer 4.11版本软件,图像格式为NIFTI,神经垂体和腺垂体独立标注,标注标准如下:①神经垂体的标注区域为垂体后叶区高T1信号区(图1),除神经垂体外,垂体窝内非低信号区均标为腺垂体,低信号灶不在标注范围(图2)。②垂体标注采用横轴面、矢状面和冠状面三个方位共同标注,其中矢状面侧重上下界线,横轴面和冠状面侧重左右界线,在矢状面图像上左右界线难判定时以横轴面或冠状面为准,而横轴面和冠状面上下界线难判定时以矢状面为准(图3)。③标注过程中,海绵窦血管、鞍区骨质、鞍旁间隙以及场强因素导致的垂体信号不均匀可能造成干扰,在人工校准时需注意修正(图4~6)。④部分样本可能存在侧壁增厚且与腺体分界不清,标注时参照邻近侧壁软组织信号厚度进行剔除(图7)。垂体分割模型使用级联的VB-Net网络进行训练,该网络是V-Net[3]的变体,在V-Net网络框架基础上加入瓶颈层,减少网络参数数量,降低显存。第一级VB-Net网络对垂体进行粗分割,定位垂体位置;第二级VB-Net网络基于垂体分割结果切块进行精细分割,把垂体分割成神经垂体和腺垂体两部分(图8)。
垂体分割模型采用迭代式标注-训练的方法获得,包含以下步骤:①初始每组选择3例图像进行人工标注神经垂体和腺垂体,将人工标注后图像作为训练集进行模型训练,直至模型收敛,可以初步完成垂体分割,获取初始模型。如果无法完成初始模型建立,追加人工标注分割病例,直至计算机获得初始模型。②应用初始模型对首批80例图像进行分割,获得分割后的神经垂体、腺垂体与垂体总体积数据,将分割结果进行人工校准,获得校准后相对应的体积数据作为金标准。③使用配对样本t检验对获得的数据进行统计分析,如果AI测量值与人工测量值任意一个年龄组差异有统计学意义,则把本次人工校准后的垂体图像与分割图像加入训练集,对上一次模型进行迭代优化。利用优化后的新模型继续进行下一批次图像AI分割与人工校准,获得新一组测试数据。④重复进行步骤③,直到AI测量值和人工测量值在所有年龄段差值均没有统计学意义为止。
进行统计分析的垂体体积数据包括神经垂体、腺垂体和总垂体3个值,采用AI识别自动测量和人工校准分别获得AI测量值与人工测量值两组数据,应用Python和SPSS软件对两组数据进行配对t检验、Dice计算和Spearman相关性分析,t检验以P>0.05为两组数据差异没有统计学意义。
结 果
经过初始12例人工标注后病例的训练,计算机能进行垂体识别与简单分割,初始模型建立成功。
经过4批次AI标注与再学习、人工校准,第4批次各年龄段神经垂体、腺垂体以及总垂体体积校正前后数据差值没有统计学意义,t值为0.137~0.928。各批次t检验结果见表1。
第4批次各年龄段人工校准前后,最小Dice值0.941为16~25岁年龄组神经垂体数据,最大值0.989为25~50岁年龄组垂体总体积数据(表2)。同组数据进行Spearman相关性分析,校准前后腺垂体、神经垂体及垂体总体积相关系数分别为0.969、0.981和0.984(表3)。

图1 a)垂体矢状面T1WI示腺垂体为等信号,神经垂体为高信号;b)标注图像,将等信号腺垂体区域标注为浅绿色,将高信号神经垂体区域标注为浅黄色。
图8 级联的VB-Net网络框架。
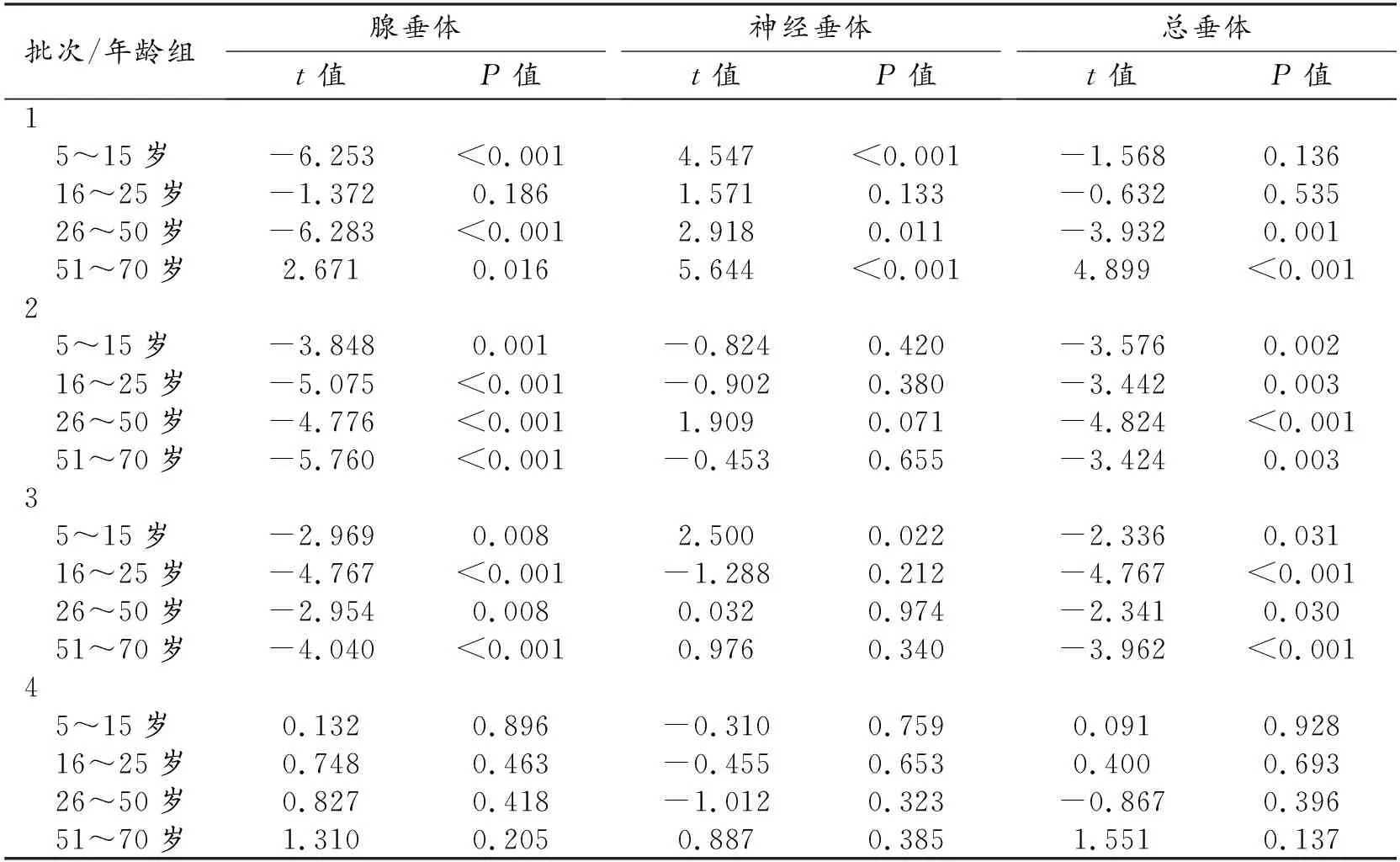
表1 不同年龄段各次人工校准前后垂体体积t检验结果

表2 第4批次各年龄段人工校准前后垂体各区域分割对比Dice值

表3 第4批次人工校准前后数据Spearman相关性分析
经过电脑反复3批次学习与人工校准,第4批次AI标注的各年龄段神经垂体、腺垂体与垂体总体积三组数据均与人工校准数据的差异没有统计学意义,Dice值为0.941~0.989,Spearman相关系数大于0.969,标志着AI深度学习的垂体分割模型建立成功。
讨 论
人工智能在医学影像方面的应用近年来不断增多,相关领域也成为医疗机构研发的重要方向[4,5]。垂体人工智能与数字化领域相关的研究,主要集中在鞍区病变的手术方案设计、AI辅助定性及放疗定位,方法上以影像学多模态结合计算机不同算法建模、动态不确定因果图以及相关放疗定位软件[6-8]。国内有人对垂体疾病建立数据库,辅助疾病诊断与治疗[9]。针对垂体区域无明显病变的研究相对较少,主要研究范围为激素相关病变垂体大小情况分析,如矮小症、肥胖症等,类似研究中,衡量垂体变化的参数多数是采用垂体高度值变化,只有少数研究基于3D软件人工勾画进行垂体体积半自动定量分析[10,11]。
针对形态规则的垂体径线测量,可重复性尚好,如果垂体形态欠规则,测量值的重复性会相应变差,垂体体积与垂体形态无关,因此采用体积来进行垂体的大小评估,将有效解决重复性差的问题。以球体体积计算为例,V=(4/3)πr3(V体积,r球体半球),当直径从4 mm增大到5 mm时,增大了约25%,但体积将从33.5 mm2增加到65.4 mm2,增大约95%,体积的变化是长度值变化的4倍,因此,体积在反映物体变化上比径线更敏感。随着3D T1WI高分辨序列在1.5T以上设备的普及,若能实现AI垂体体积自动标识,将有利于垂体定期复查并早期发现异常变化,达到早期发现病变的目的。区别于实物模型,AI垂体分割模型是指计算机获得的一种算法,是经过反复学习后计算机成功区分指定区域的技能,在本研究中表现为对神经垂体和腺垂体的自动识别。
研究所用图像为公共数据库3D T1WI颅脑矢状面图,层厚1 mm,无间隔扫描,图像设备无限制。实验中,将垂体窝内等T1组织认定为腺垂体,类似Rathke囊肿低信号灶被排除在腺垂体范围外,垂体后缘高T1信号认定为神经垂体,实验只对比两种方法对认定的腺垂体和神经垂体区域体积测量值,不涉及疾病诊断与正常值测量。
磁共振扫描中,呼吸运动、蝶窦空气、海绵窦区血管以及骨质常干扰腺垂体信号,其中以场强不均匀所致的腺垂体高信号伪影较多见,主要表现在腺垂体外周区域,校准时应注意与神经垂体区分开,将其归入腺垂体,在定位上以神经垂体解剖位置靠后作为参考依据,需横轴面、冠状面、矢状面多方位反复校正。图7所示侧壁增厚,在标注过程中不少见,产生侧壁增厚的原因可能与局部蝶窦骨质信号或海绵窦信号有关,标注中如无法与邻近腺垂体分界开,参考垂体外组织厚度进行减少标记,这样可以防止腺垂体体积假性增多。
本研究中4个年龄段参考垂体发育时段设计,通过增加时段与总数据共同对比的差异性,增加了全数据对比差异没有统计学意义的难度,进而提高了AI模型标准。
目前,垂体体积的测量没有明确的金标准,临床相关研究均以3D软件进行人工标记后计算的数据作为金标准[10,11]。评估AI分割与金标准数据比较常用相似度来分析,采用Dice值[7,12,13],该值越接近1,表示待评估的分割值与金标准分割之间相似度越高,本研究第4批次数据Dice值达0.941以上,结合同组数据校准前后腺垂体、神经垂体与垂体总体积的相关系数大于0.969,说明AI识别的相似度已接近人工标准。
本研究用12例图像进行计算机训练建立初始模型后,采用迭代学习与纠错方式反复优化,经过3批次学习,第4批次数据即达到校准前后数据差异没有统计学意义,且Dice值大于0.941,初步认为AI垂体分割建模成功。AI垂体分割模型建立后,尚需要不同单位不同机型的更多数据导入进行迭代学习与模型优化,最终训练成能识别不同设备垂体分区的成熟模型,实现垂体体积AI自动精准测量。
