肿瘤细胞线粒体氧化磷酸化功能异质性研究进展
2024-03-20白梦彩闫泽宇石彩钰邢金良任婷婷
白梦彩 闫泽宇 石彩钰 邢金良 任婷婷
作者单位:716000 延安 1.延安大学生命科学学院;710032 西安 2.空军军医大学肿瘤生物学国家重点实验室和基础医学实验教学中心;710038 西安 3.空军军医大学唐都医院普通外科;710127 西安 4.西北大学生命科学学院;710032 西安 5.空军军医大学肿瘤生物学国家重点实验室和生理与病理生理教研室
线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)代谢途径通过提供生物能量和指导大分子合成,在支持肿瘤细胞增殖和协调肿瘤微环境(tumor microenvironment,TME)方面起着关键作用[1]。在过去一个世纪中,糖酵解,即瓦伯格效应(Warburg effect)一度被认为是所有肿瘤细胞为满足能量需求而依赖的主要代谢方式。但近年来随着对肿瘤代谢机制的深入研究,越来越多的研究表明某些肿瘤亚型主要依赖于OXPHOS 而非糖酵解来实现增殖和生存[2-4]。糖酵解和OXPHOS 的活性在细胞各个阶段的细胞周期中被调整,G1 期细胞首选OXPHOS,而S 期细胞首选糖酵解[5]。另外,对化疗耐药的肿瘤干细胞或对靶向治疗原发性或获得性耐药的肿瘤细胞也表现出对OXPHOS 的高度依赖性[3,6],因此靶向OXPHOS已成为一种有前途的癌症治疗策略。
1 不同肿瘤细胞中线粒体OXPHOS功能存在异质性
不同肿瘤细胞的代谢方式存在差异,即使是在同一肿瘤组织中,肿瘤细胞的快速增殖常导致肿瘤中氧气分布不均,肿瘤细胞为适应环境会相应地调整代谢方式,同时肿瘤细胞的代谢方式与其所产生的生理功能,如增殖、转移、分化、耐药、凋亡等也不尽相同。
肝细胞癌(hepatocellular carcinoma,HCC)的特征是更高水平的氧化应激和炎症[7]。在LIU 等[8]的研究中,当HCC 的代谢方式从糖酵解转变为OXPHOS时,HCC 细胞增殖和肿瘤生长被抑制。胆管癌(cholangiocarcinoma,CCA)是原发性肝癌的第二种常见形式[9],是一种预后不良且治疗方法有限的肝癌类型。近期研究表明,线粒体OXPHOS代谢有助于维持CCA 中的干性特征,从而赋予体内致瘤能力和耐药性,该类患者总生存期和复发时间较短,且血管浸润增加[2]。与HCC 不同的是,在CCA 中OXPHOS 代谢水平升高体现在线粒体复合物Ⅱ水平的升高,而在HCC中则是线粒体复合物Ⅰ相关基因表达上调[2,9]。
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的类型,相比于正常情况,处于间歇性缺氧条件下的NSCLC 会产生更多的活性氧(reactive oxygen species,ROS),增强其炎症、增殖能力和肿瘤血管生成能力[10]。除此之外,对程序性死亡受体1(programmed cell death protein 1,PD-1)免疫治疗反应不同的NSCLC 的OXPHOS 水平也存在差异。CHEN等[3]将NSCLC 分为PD-1 耐药模型和PD-1 敏感模型,结果发现与PD-1敏感模型相比,PD-1耐药模型中OXPHOS 相关基因上调,但糖酵解能力没有增加,说明在NSCLC 中OXPHOS 利用率高会增加其对PD-1治疗的耐药性。
结直肠癌(colorectal cancer,CRC)是一种常见的消化系统恶性肿瘤,REN 等[11]首次证明在CRC 中线粒体PHB2(Prohibitin 2)表达上调,PHB2 可直接与NADH-泛醌氧化还原酶核心亚基S1(ubiquinone oxidoreductase core subunit S1,NDUFS1)相互作用,稳定复合物Ⅰ,从而提高OXPHOS 水平并促进细胞增殖,进而在CRC 的发生发展中发挥作用。根据全球基因组状况,CRC 可分为微卫星稳定型(microsatellite stable,MSS)CRC 和微卫星不稳定型(microsatellite instable,MSI)CRC[12],由于mtDNA 拷贝数的差异,mtDNA 拷贝数较低的MSI 癌细胞依赖于糖酵解,而mtDNA拷贝数较高的MSS癌细胞倾向于OXPHOS促进恶性肿瘤发展[13]。而OXPHOS活性增加会提高CRC癌症干细胞的干性,产生化疗耐药性和化学抗性[4]。
肿瘤细胞通过自主改变其各种代谢途径的通量,以满足增加的生物能量和生物合成需求以及减轻癌细胞增殖和存活所需的氧化应激,即使是同一肿瘤类型的癌细胞,其恶性进展所需的代谢途径和环境也有所不同。因此,深入研究和认识肿瘤代谢转变,对指导肿瘤代谢研究,加速靶向肿瘤代谢药物的研发以及开展个体化治疗都具有重要意义。
2 线粒体OXPHOS检测方法
目前分析细胞线粒体OXPHOS 的方法主要有代谢组学分析和生物分析,包括质谱(mass spectrometry,MS)、色谱、核磁共振(nuclear magnetic resonance,NMR)以及细胞耗氧率(oxygen consumption rate,OCR)检测等方法。
2.1 代谢组学分析
代谢组学中最常用的两种化学分析方法是MS和NMR[14]。在代谢组学中,大多数MS 方法在将样品注入质谱仪之前包含至少一个或几个化学分离步骤,以降低混合物的复杂性,同时提高MS仪器的灵敏度,并增强MS仪器检测单个代谢物的能力。最常见的化学分离方法是气相色谱法(gas chromatography,GC)、液相色谱法(liquid chromatography,LC)和毛细管电泳(capillary electrophoresis,CE)。GC 根据分子的沸点、质量、极化率和分子形状来分离分子;LC 根据疏水性、电荷和大小分离分子;而CE 主要根据电荷分离分子[15]。GC-MS 通常用于检测和分离较低分子量、较不容易电离的代谢物,而LC-MS或CE-MS用于较高分子量、更容易电离或带电的代谢物[16]。
除MS 技术外,NMR 是另一种常用的化学分析方法,可测量原子核在强磁场下对射频扰动的响应,主要用于识别和量化代谢物[17]。在基于NMR的代谢组学中,不同分子之间峰的分离是由化学位移差异而导致的,这意味着通过NMR 分析化学混合物时不需要色谱或电泳分离,因此基于NMR 的代谢组学较基于MS 的代谢组学更快、更便捷[16]。此外,与MS 不同,NMR 并非一种非常灵敏的技术,其灵敏度随磁场强度的增加而提高[18]。总之,MS和NMR 都可用于靶向和非靶向代谢组学,MS 通常更灵敏,而NMR 可提供更多的结构细节和更高的定量准确性。
2.2 OCR检测
OCR 是细胞功能正常的重要指标,常被作为研究线粒体功能的参数,也是触发癌细胞从健康的OXPHOS 转变为有氧糖酵解的标志。目前,测量线粒体OCR 主要包括细胞外通量分析仪(Seahorse)、O2k细胞呼吸分析仪(Oroboros oxygraph-2k)、Clark 型氧电极和其他O2电极。与O2k相比,Seahorse 则没有加药数量和试剂盒的限制,可一次性快速检测同一个样本中的代谢相关复合物的功能活性,深度挖掘线粒体代谢能量信息[19]。Clark 型氧电极和其他O2 电极虽不能同时测量多个样品,但其灵敏度高、检测速度快。值得注意的是,以上方法通常用于测量分离线粒体或细胞培养物中的OCR,线粒体的分离会导致意外损伤,致使提取的线粒体或细胞培养物的生理相关性低于完整的组织切片[20]。
除上述方法外,还可以通过检测线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ等酶活性来评估细胞的OXPHOS状态。市面上相关试剂盒的技术已较成熟,实验室只需配备酶标仪即可进行检测。相比之下,使用荧光探针如ATP-Red1和Mito-SOX分别检测腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)和ROS 水平只能反映细胞整体的代谢状况而无法判断OXPHOS 状态,且这种探针检测方法对细胞的状态和操作过程要求较高,一旦这两个环节出现不同实验结果,就可能导致不稳定性。
3 肿瘤中OXPHOS功能差异的原因
3.1 基因
肿瘤遗传背景的异质性决定其代谢调控的异质性。目前已经证实,能够调控肿瘤细胞代谢的基因包括癌基因、抑癌基因以及各种转录因子等,其表达产物,如蛋白磷酸化激酶等,也能对肿瘤细胞代谢产生影响。
3.1.1 原癌基因 在正常细胞的基因组中,癌基因通常处于低表达或不表达状态。一旦发生突变或被异常激活,这些癌基因可使细胞发生恶性转化。其中,最常见的能够调控细胞代谢的癌基因有PI3K/AKT、c-Myc和KRAS等。PI3K/AKT 信号转导的失调由多种机制引起,包括PTEN 丢失与突变或AKT3 异常高表达等。ZHENG 等[21]发现在表达AKT 的乳腺癌亚型细胞中,使用半乳糖代替葡萄糖培养乳腺癌细胞时,代谢模式由糖酵解转变为OXPHOS 代谢,细胞因氧化应激增加而产生过多的ROS 导致细胞死亡。这种代谢状态的改变也增加了癌症的临床治疗难度。LEE 等[22]证明在三阴性乳腺癌细胞中,MYC 与MCL1 同时扩增可增加线粒体OXPHOS 和ROS 的产生,这一过程参与了癌症干细胞(cancer stem cell,CSC)的生存维持,使患者对包括紫杉醇和多柔比星在内的化疗药物不敏感。还有研究显示,在大约25%的人类癌症中发现KRAS 发生突变,这导致一种构成性活性蛋白质形成,损害线粒体功能并降低糖酵解代谢,表现出广泛的代谢可塑性,而代谢可塑性可能会直接或间接限制靶向代谢治疗方法的有效性[23]。
3.1.2 抑癌基因 抑癌基因作为细胞内遗传因子,具有刺激或抑制癌细胞代谢的能力。通过抑制肿瘤细胞癌基因活性,抑制细胞周期、阻止细胞增殖,并促使肿瘤细胞死亡。目前已证实能够调节肿瘤代谢的抑癌基因包括p53、PTEN和LKB1等。KIM 等[24]发现当敲低HCC 细胞中的p53基因表达时,由丙酮酸驱动的氧化磷酸化系统产生的ATP增多,导致糖酵解代谢水平下降并抑制HCC 细胞增殖。此外,宫颈癌细胞系(helen lane,HeLa)和CRC 细胞系HCT116 在p53 作用下,OXPHOS 活性几乎被消除,其能量产生主要依赖于糖酵解[24]。与p53作用相反的是PTEN,当PTEN的启动子甲基化被抑制时,食管癌中糖酵解作用降低,同时OXPHOS 代谢水平得到提高,从而抑制了食管癌的增殖和迁移[25]。
3.1.3 转录因子 转录因子是一群能与基因5'端上游特定序列专一性结合,从而保证目的基因以特定的强度在特定的时间与空间表达的蛋白质分子。目前很少有药物被成功开发用于特异性地阻断癌基因编码转录因子在癌细胞中的活性。研究[26]表明,人类婆罗双树样基因4(spalt-like transcription factor 4,SALL4),作为一种锌指蛋白转录因子,对胚胎干细胞的自我更新和多能性至关重要。在肝癌中,SALL4 异常高表达,使得肝脏肿瘤细胞依赖OXPHOS 代谢途径生存,使用OXPHOS 抑制剂可诱导高表达SALL4 的肝肿瘤细胞死亡[26]。近年来发现,PGC-1α 与许多炎症和代谢性疾病有关。RIUS-PEREZ 等[27]综述了PGC-1α 调控的不同功能和分子途径,并将氧化应激和线粒体代谢与炎症反应和代谢综合征联系起来。其中,PGC-1α调节细胞中线粒体抗氧化防御相关分子的表达,如增加锰超氧化物歧化酶(MnSOD/SOD2)、过氧化氢酶、过氧化物还原蛋白(Prx)5及Prx3等的水平,从而保护细胞免受线粒体功能障碍。在三阴性乳腺癌细胞中,PGC-1α 能促进癌细胞中线粒体的生物发生和癌细胞的转移与侵袭,说明PGC-1α 表达增强与浸润性乳腺癌患者的远处转移和不良结局有关[28]。在不同癌细胞中,PGC-1α 上调通过保护细胞免受过多的线粒体ROS 生成来促进细胞存活,表明PGC-1α 对抗氧化防御的上调对于预防与线粒体衰竭相关的细胞死亡至关重要。
3.2 TME
TME 是指肿瘤细胞产生和生活的内环境[29]。肿瘤细胞和TME 之间的相互作用不仅影响肿瘤的发生、进展、转移和治疗疗效,还影响肿瘤细胞代谢功能。目前,能够影响TME的因素有很多,包括HIF-1α、CAFs、TAMs、STAT3、TNF-α、IL-1β 等。在实体瘤中,低氧是TME 的主要特征之一,HIF-1α在低氧条件下会被激活并产生相应的效应。CAFs则是TME中最为丰富的基质细胞。本文主要介绍HIF-1α和CAFs。
HIF-1α 是HIF 家族HIF-1 亚型的α 亚基中的一种,是细胞适应缺氧环境的重要转录因子和调控蛋白,能够影响肿瘤细胞代谢、血管生成和肿瘤转移等[30]。在卵巢癌细胞中,盐诱导激酶2(salt-inducible kinase 2,SIK2)激活PI3K/AKT 信号通路,致使HIF-1α表达上调,从而使糖酵解关键酶如己糖激酶2(hexokinase2,HK2)、磷酸果糖激酶(phosphofructokinase,PFKL)和单羧酸转运蛋白4(MCT4)等高表达,进而促进卵巢癌细胞的糖酵解代谢[31]。同样,在乳腺癌中,HIF-1α 过表达通过诱导代谢相关靶基因丙酮酸脱氢酶激酶1(pyruvate dehydrogenase kinase 1,PDHK1)、丙酮酸激酶肌同工酶M2(pyruvate kinase muscle isozyme M2,PKM2)等的表达增强糖酵解,但减少线粒体OXPHOS[32]。
在TME 的所有基质中,CAFs 最为丰富[29],它不仅与肿瘤进展密切相关,而且还能调控肿瘤代谢。例如,在口腔鳞状细胞癌的CAFs中,当其过表达细胞表面糖蛋白家族中的整合素β2(integrin beta 2,ITGB2)时,ITGB2 会通过PI3K/AKT/mTOR 信号通路调节CAFs 糖酵解以产生大量乳酸,乳酸氧化后产生还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH),提高其周围肿瘤细胞的OXPHOS 水平并产生大量ATP[33]。
3.3 营养条件
葡萄糖和谷氨酰胺是细胞生物循环过程中两种主要的营养物质,其在许多细胞生物合成途径中提供碳源和氮源,当其浓度发生改变时,肿瘤细胞代谢也会发生相应的变化。
3.3.1 葡萄糖 在肿瘤细胞培养过程中,培养基中葡萄糖浓度的增加会显著降低肝癌细胞HepG2 中线粒体内膜电位、耗氧量、线粒体DNA(mitochondrial DNA,mtDNA)拷贝数,以及线粒体转录因子A(mitochondrial transcription factor A,TFAM)mRNA 水平[34]。但在降低葡萄糖浓度后,胶质瘤细胞会更加依赖线粒体代谢来获得能量[35]。类似的结果在人类原代细胞成纤维细胞中也能观察到[36]。
3.3.2 谷氨酰胺 谷氨酰胺(glutamine)是一种非必需氨基酸,是三羧酸循环再生补充的主要贡献者,同时也是谷氨酸前体,以促进谷胱甘肽(glutathione,GSH)的产生和氧化还原稳态[37]。ALBERGHINA等[38]研究表明,谷氨酰胺至少占肿瘤细胞蛋白质合成所需要的非必需氨基酸的50%,许多肿瘤细胞通过摄取细胞外谷氨酰胺来产生能量,并维持细胞内氧化还原稳态。有研究报道,在缺乏谷氨酰胺的肿瘤细胞中,主要通过有氧糖酵解来维持ATP 水平,同时抑制线粒体呼吸以避免产生过高的ROS 损害细胞[39]。另有研究报道,谷氨酰胺饥饿处理会导致卵巢癌和CRC细胞有氧糖酵解增强,但OXPHOS 代谢未改变[40]。这表明可以通过控制肿瘤细胞对谷氨酰胺的摄取来调节肿瘤细胞代谢。
3.3.3 丙酮酸 丙酮酸(pyruvic acid)是所有生物细胞糖代谢及体内多种物质相互转化的重要中间体。超生理浓度的丙酮酸盐在常氧条件下会稳定缺氧诱导因子HIF-1α 的表达,从而影响细胞内的线粒体OXPHOS代谢。例如,在乳腺癌细胞BT549中,HIF-1α表达水平随培养环境中丙酮酸浓度的增加而升高[41]。在HCC 细胞中,p53 可调控PUMA(凋亡调控因子)减少线粒体对丙酮酸的摄取,以降低OXPHOS能力并增强糖酵解代谢功能[24]。
综上,肿瘤代谢模式改变是为了满足其快速生长和增殖对生物原料和能量的需求,线粒体OXPHOS 功能产生差异也是基于此,总体上产生差异的主要原因有基因、TME、外来营养物质等3 个方面,详见表1。
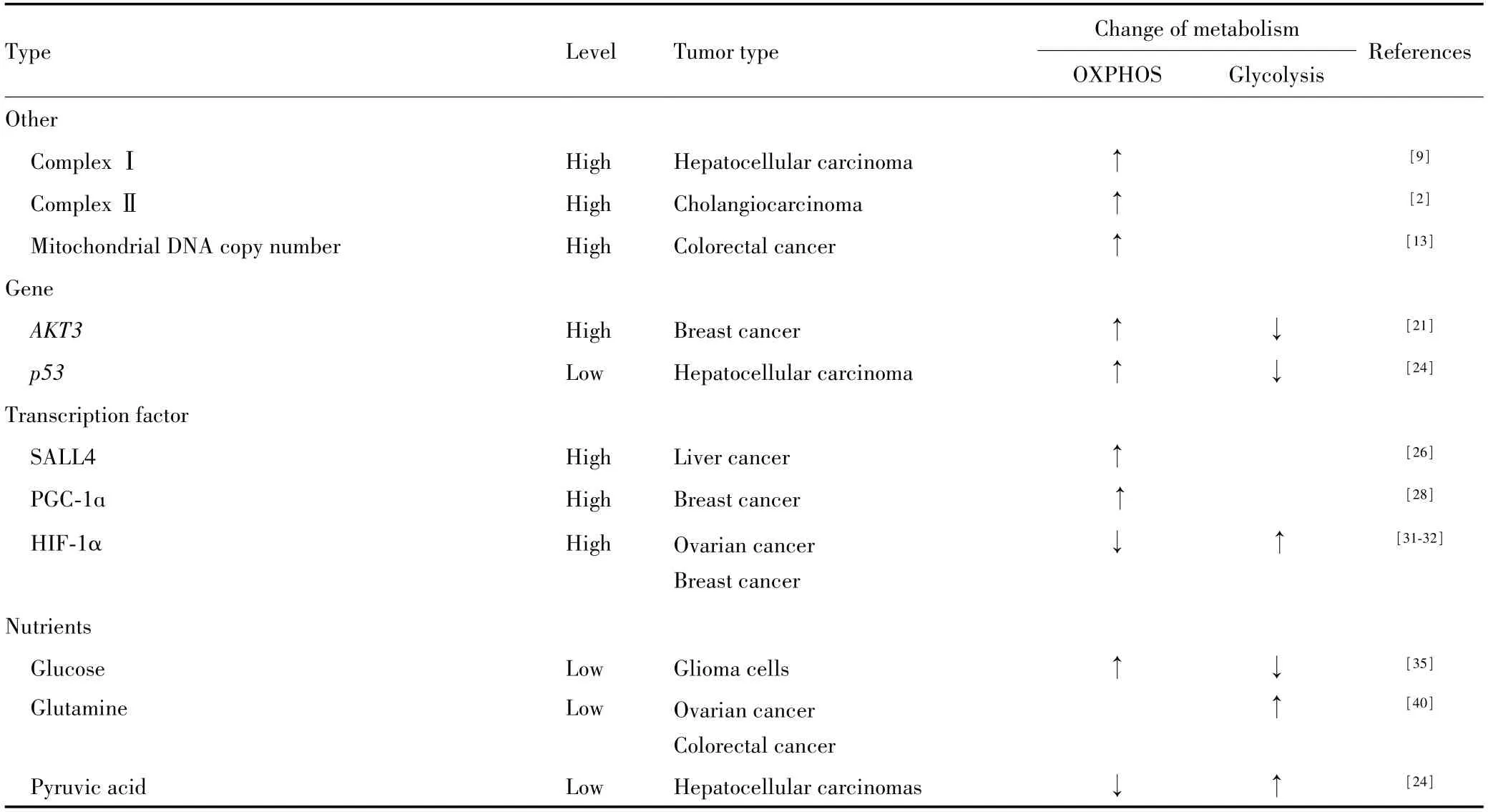
表1 肿瘤中OXPHOS功能差异的原因Tab.1 Reasons for differences in OXPHOS function in tumors
4 小结
肿瘤细胞与正常细胞的代谢模式有所不同,能满足肿瘤细胞增殖及转移等过程中物质、能量及还原当量的需求,为肿瘤药物开发提供了众多潜在的靶点。目前,已有研究聚焦于OXPHOS系统中的ROS相关酶的表达与活性在肿瘤治疗中的潜力,也有研究探索将Warburg效应与OXPHOS代谢联系起来,采用联合用药的策略,以提高肿瘤治疗的疗效。本文详细地阐述了线粒体OXPHOS在肿瘤中的异质性,为加速靶向肿瘤代谢药物的研发和开展个体化肿瘤代谢治疗提供了新思路。
