糖酵解在非小细胞肺癌吉非替尼耐药中的作用研究
2024-03-20李楠路晨阳祝阿妮杨栋才马倩严奉奇贾卫红
李楠 路晨阳 祝阿妮 杨栋才 马倩 严奉奇 贾卫红
作者单位:710083 西安 1.西北大学附属医院西安市第三医院呼吸与危重症医学科;710038 西安 2.空军军医大学唐都医院泌尿外科
肺癌是最常见的恶性肿瘤之一,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)是其主要的病理类型,约占所有肺癌的80%~85%,且大部分的NSCLC患者初诊时即为晚期[1]。吉非替尼(Gefitinib)是第一代广泛用于晚期NSCLC 患者一线治疗的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI),可通过阻断表皮生长因子受体(epidermal growth factor receptor,EGFR)磷酸化抑制肿瘤进展[2]。吉非替尼对大部分具有EGFR激活突变的NSCLC患者最初都有效,但几乎所有患者在治疗后都会出现吉非替尼耐药[3]。自2005 年首次发现T790M耐药突变以来,越来越多的吉非替尼耐药机制被发现[4-5]。尽管吉非替尼耐药机制的研究已取得了巨大的进展,但是不同机制间可以相互影响,且仍有部分耐药机制尚不清楚[6],包括吉非替尼耐药在物质代谢方面的研究尚不清楚。本研究通过构建NSCLC吉非替尼耐药细胞,探讨吉非替尼耐药与糖酵解的关系,以期为进一步阐明NSCLC的吉非替尼耐药机制,逆转吉非替尼耐药提供理论基础。
1 材料与方法
1.1 主要材料
人NSCLC细胞PC-9和A549由空军军医大学张艰教授惠赠;吉非替尼(ZD1839)购自Selleck Chemicals公司;2-脱氧-D-葡萄糖[(2-deoxy-D-glucose,2-DG),(154-17-6)]购自MedChemExpress公司;CCK-8检测试剂盒(CK04)购自Dojindo Laboratories公司;乳酸测试盒(A019-2-1)购自南京建成生物工程研究所有限公司;葡萄糖摄取检测试剂盒(S0201M)、Trizol(R0011)和RIPA裂解液(P0013C)均购自上海碧云天生物技术股份有限公司;反转录试剂盒(RR037A)、SYBR Green PCR Master Mix(RR820A)购自Takara Bio 公司;qRT-PCR引物由北京擎科生物科技股份有限公司合成;HK1(2024T)、HK2(2106S)、PKM2(4053T)、LDHA(43723SF)、PFKP(12746S)和β-Actin(4970S)抗体及HRP-IgG(7074)二抗购自Cell Signaling Technology 公司;RPMI 1640 培养液(11875176)、胎牛血清(A5209401)购自HyClone公司。
1.2 细胞培养及耐药细胞株构建
人NSCLC 亲本细胞PC-9 和A549 均培养于含10%胎牛血清的RPMI 1640 培养基,条件为37 ℃、5% CO2。采用浓度递增法构建NSCLC 吉非替尼耐药细胞PC-9-GR、A549-GR,具体如下:亲本细胞PC-9 和A549 贴壁生长24 h 进入对数生长期后,分别以含0.20µmol/L、0.50µmol/L、1.00µmol/L、1.50µmol/L 和2.00µmol/L 吉非替尼的培养基依次递增持续诱导培养,各浓度吉非替尼诱导2~3 周,待细胞状态稳定3 d后调整为更高浓度继续诱导,最终能在含2.00µmol/L吉非替尼的培养基中稳定存活的细胞即为耐药细胞PC-9-GR和A549-GR。
1.3 CCK-8实验检测细胞活力
亲本和耐药细胞(PC-9、PC-9-GR、A549、A549-GR)分别接种至96 孔板(5×103个/孔),待细胞贴壁,吸弃上清液,按0.00 μmol/L、0.02 μmol/L、0.20 μmol/L、2.00 μmol/L、20.00 μmol/L 分组并分别加入200 μL 含相应浓度吉非替尼的培养基,检测不同浓度的吉非替尼对细胞活力的影响;按0.00 mmol/L、0.10 mmol/L、0.50 mmol/L、1.00 mmol/L、5.00 mmol/L 分组并分别加入200 μL含有相应浓度2-DG的培养基,检测不同浓度的2-DG 对细胞活力的影响。将耐药细胞按吉非替尼(0.00 μmol/L、0.02 μmol/L、0.20 μmol/L、2.00 μmol/L、20.00 μmol/L)单药或联合2-DG(0.50 mmol/L)分组,分别加入200 μL含相应浓度吉非替尼或吉非替尼+2-DG的培养基,检测吉非替尼联合2-DG 对耐药细胞活力的影响。以上实验各组均设5个复孔,继续培养48 h;吸弃上清液,加入100 μL 预先在避光条件下以1∶10比例配置含CCK-8 试剂的培养基,3 h 后用酶标仪读取各孔在450 nm 波长处的光密度(OD)值,并计算细胞活力。细胞活力=[(OD待测组-OD空白组)/(OD0.00μmol/L组-OD空白组)]×100%。
1.4 平板克隆形成实验检测细胞克隆形成情况
亲本和耐药细胞分别取1×103个细胞接种于培养皿内并摇匀,细胞贴壁后更换为含2.00µmol/L吉非替尼的培养基(10 mL)继续培养,待肉眼可见细胞克隆形成后,取出培养皿,吸弃上清液,经PBS漂洗,4%多聚甲醛固定,结晶紫染色后,拍照,用Image J软件计数并制图。
1.5 葡萄糖摄取检测试剂盒检测细胞葡萄糖代谢情况
亲本和耐药细胞分别接种至6孔板(1×106个/孔),同时设置空白组,每组各设3 个复孔。待细胞贴壁后,更换培养基(3 mL),继续培养48 h后,收集上清液(即样本液)。根据葡萄糖摄取检测试剂盒说明书操作方法,配置标准浓度葡萄糖溶液(即标准液)后,分别测定标准液与样本液于505 nm 波长处的OD 值并计算各孔上清液中的葡萄糖含量。各组细胞葡萄糖消耗量即空白组与实验组葡萄糖含量之差。
1.6 乳酸测试盒检测细胞乳酸产出水平
亲本和耐药细胞分别接种至6孔板(1×106个/孔),同时设置空白组,每组各设3 个复孔。待细胞贴壁后,更换培养基(3 mL),继续培养48 h后,收集上清液(即样本液)。根据乳酸测试盒说明书的操作方法,配置标准浓度乳酸溶液(即标准液)后,分别测定标准液与样本液于530 nm 波长处的OD 值并计算各孔上清液中的乳酸含量。各组细胞乳酸产出水平即实验组与空白组乳酸含量之差。
1.7 qRT-PCR 实验检测细胞内糖酵解关键酶的mRNA水平
收集各组细胞,4 ℃条件下用Trizol提取各组细胞中的总RNA 并测定浓度后,取500 ng RNA,按反转录试剂盒说明书的方法反转录为cDNA,反转录程序:37 ℃15 min,85 ℃5 s,4 ℃保存。将所得cDNA稀释5倍后,取cDNA 2µL、SYBR Green PCR Master Mix 5µL、上下游引物各1µL、ddH2O 1µL,混合,各样本均设置5 个复孔,按PCR 扩增程序(95 ℃变性30 s、65 ℃退火5 s、72 ℃延伸30 s,40个循环),测得各样本CT值。以β-Actin 为内参,采用2-ΔΔCt法计算各样本中目的mRNA的相对表达量。PCR引物序列见表1。

表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.8 Western blot 实验检测细胞内糖酵解关键酶的蛋白水平
收集各组细胞,用RIPA 裂解液裂解,提取细胞中的总蛋白并测定浓度。取20 μg蛋白样品上样至SDSPAGE凝胶孔内,分别按浓缩胶80 V、分离胶120 V电压电泳100 min,100 V 恒压转膜120 min,取出硝酸纤维素(nitrocellulose,NC)膜并封闭洗涤,分别加入HK1(1∶1 000)、HK2(1∶1 000)、PKM2(1∶1 000)、LDHA(1∶1 000)、PFKP(1∶1 000)、β-Actin(1∶1 000)抗体孵育过夜,洗涤NC 膜,加入相应二抗,继续孵育1 h,洗涤后用ECL 处理并发光显像,得到目的蛋白条带。以β-Actin为内参,利用Image J 软件分析条带的灰度值。
1.9 统计学方法
采用SPSS 15.0 软件分析数据,计量资料用均数±标准差()表示,两组间采用两独立样本t检验对比分析;同一样本组内不同浓度间,以0.00µmol/L 为参照,采用Dunnett-t 检验对比分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 细胞吉非替尼耐药性
CCK-8 实验结果(图1A)显示,与0.00 µmol/L 组相比,不同浓度(0.02、0.20、2.00、20.00 μmol/L)吉非替尼处理PC-9、PC-9-GR、A549和A549-GR细胞后,亲本与耐药细胞的活力均下降,但相较于各自亲本细胞,PC-9-GR 与A549-GR 细胞均显示出更强的吉非替尼抵抗效应(均P<0.01)。其中,高浓度(20.00µmol/L)吉非替尼作用时,PC-9细胞与PC-9-GR细胞相对活力分别为(23.26±4.98)%和(40.72±5.32)%,A549 细胞与A549-GR 细胞相对活力分别为(17.62±6.41)%和(35.62±5.20)%,差异均具有统计学意义(均P<0.01)。平板克隆形成实验结果(图1B)显示,2.00µmol/L吉非替尼处理PC-9、PC-9-GR、A549 和A549-GR 细胞后,与各自亲本细胞相比,PC-9-GR 与A549-GR 细胞的克隆形成个数均显著增加[细胞:(PC-9/PC-9-GR99.80±12.46)个vs(493.80±22.58)个,P<0.001;A549/A549-GR细胞:(106.80±16.33)个vs(416.00±32.52)个,P<0.001]。以上实验结果表明,吉非替尼耐药细胞株构建成功。
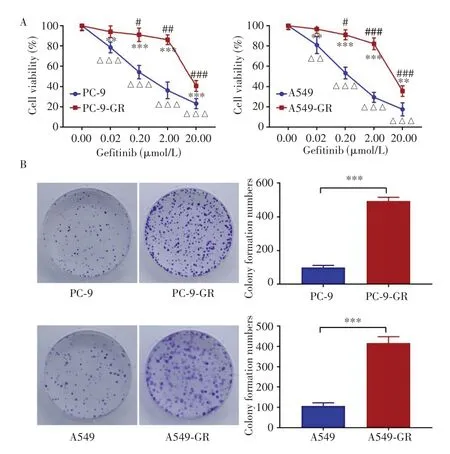
图1 亲本和耐药细胞的吉非替尼耐药性情况Fig.1 Resistance of parents and drug-resistant cells to Gefitinib
2.2 细胞葡萄糖代谢和乳酸产出水平
细胞葡萄糖代谢水平检测结果(图2A)显示,相较于各自亲本细胞,PC-9-GR 与A549-GR 细胞均具有更高的葡萄糖代谢速率(PC-9/PC-9-GR 细胞:1.00±0.10vs1.37±0.10,P=0.002;A549/A549-GR 细胞:1.00±0.09vs1.46±0.14,P=0.009),提示PC-9 和A549细胞的吉非替尼耐药产生伴随着葡萄糖代谢的增强。

图2 亲本和耐药细胞的葡萄糖代谢和乳酸产出水平Fig.2 Glucose metabolism and lactate production levels in parents and drug-resistant cells
鉴于糖酵解在肿瘤发生、发展中的重要作用及乳酸是葡萄糖代谢中糖酵解途径的重要代谢产物[7],为进一步明确PC-9-GR 和A549-GR 细胞葡萄糖代谢变化的具体方式,通过乳酸测试盒检测两种细胞与各自亲本细胞的乳酸产出水平,结果(图2B)显示,相较于各自亲本细胞,PC-9-GR 与A549-GR 细胞都具有更高的乳酸产出水平(PC-9/PC-9-GR 细胞:1.00±0.08vs1.85±0.16 ,P=0.001; A549/A549-GR细胞:1.00±0.10vs1.64±0.17,P=0.005),提示PC-9 和A549 细胞的吉非替尼耐药产生伴随的葡萄糖代谢变化可能与糖酵解增强相关。
2.3 细胞内糖酵解关键酶的表达水平
通过qRT-PCR 实验分别检测PC-9、PC-9-GR、A549 和A549-GR 细胞内糖酵解关键酶HK(HK1、HK2)、LDH(LDHA、LDHB)、PKM(PKM1、PKM2)和PFK 的mRNA 表达水平,结果(图3A)显示,相较于各自亲本细胞,PC-9-GR 与A549-GR 细胞中HK2、LDHA和PFK 的mRNA 表达水平升高,差异均有统计学意义(均P<0.001),提示糖酵解关键酶的过表达可能参与了NSCLC 细胞的吉非替尼耐药。为进一步验证qRTPCR 实验结果,通过Western blot 实验检测糖酵解关键酶的蛋白水平,结果(图3B)显示,相较于各自亲本细胞,PC-9-GR和A549-GR 细胞中糖酵解关键酶HK2、LDHA、PKM2和PFKP的蛋白表达水平增加,差异均有统计学意义(均P<0.001),进一步证实糖酵解关键酶的过表达可能参与了NSCLC细胞的吉非替尼耐药。
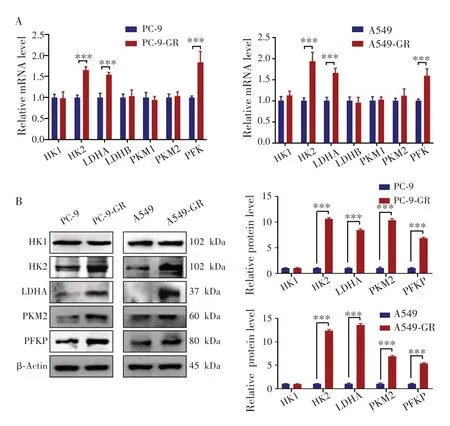
图3 亲本和耐药细胞内糖酵解关键酶的mRNA和蛋白表达水平Fig.3 The mRNA and protein expression levels of key enzymes of glycolysis in parents and drug-resistant cells
2.4 抑制糖酵解对细胞活力和吉非替尼耐药性的影响
为进一步验证糖酵解变化对吉非替尼耐药的影响,采用梯度浓度的糖酵解抑制剂2-DG分别处理PC-9、PC-9-GR、A549 和A549-GR 细胞,CCK-8 实验检测结果(图4A)显示,与0.00 mmol/L组相比,0.10 mmol/L和0.50 mmol/L 的2-DG 对PC-9、PC-9-GR、A549 和A549-GR 细胞的活力均无明显影响(均P>0.05),但2-DG 浓度增至1.00 mmol/L和5.00 mmol/L时,其对亲本和耐药细胞的活力有抑制作用,且对耐药PC-9-GR细胞[(94.62±4.74)%vs(90.38±5.93)%,P=0.246;(83.84±6.94)%vs(69.66±9.50)%,P=0.027]和A549-GR 细胞[(93.84±5.13)%vs(83.96±7.83)%,P=0.028;(78.11±3.77)%vs(58.13±4.60)%,P<0.001]的抑制作用更明显,提示吉非替尼耐药细胞对糖酵解依赖性更强,糖酵解可能参与了吉非替尼的耐药形成。
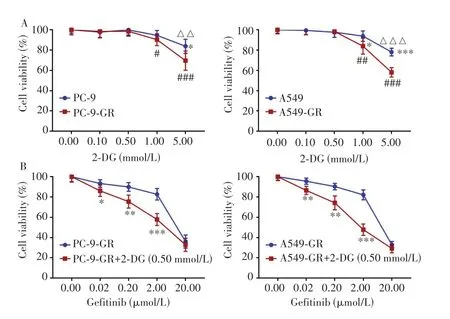
图4 抑制糖酵解对细胞活力和吉非替尼耐药性的影响Fig.4 Effects of inhibiting glycolysis on cell viability and Gefitinib resistance
为消除2-DG 自身对细胞活力的影响,进一步利用0.50 mmol/L 2-DG抑制糖酵解后检测不同浓度的吉非替尼对PC-9-GR 和A549-GR 细胞的杀伤效应,结果(图4B)显示,与相应浓度的吉非替尼单药组相比,0.02 µmol/L、0.20 µmol/L 和2.00 µmol/L 吉非替尼联合2-DG 组耐药细胞的相对活力均降低,差异均具有统计学意义(均P<0.05),而0.00µmol/L和20.00µmol/L吉非替尼联合2-DG 组耐药细胞的相对活力则无明显变化(均P>0.05),提示抑制糖酵解可部分逆转耐药细胞对吉非替尼的耐药性,糖酵解的激活参与了吉非替尼的耐药形成。
3 讨论
代谢重编程是肿瘤为满足能量、物质等方面的需求而对物质代谢方式作出的改变,可改变细胞状态、基因表达甚至微环境并影响肿瘤进展和耐药等[8-9]。代谢重编程主要包括葡萄糖、脂质和谷氨酰胺等物质的代谢改变,其中葡萄糖代谢变化是代谢重编程的主要体现方式。肿瘤的葡萄糖代谢重编程主要表现为肿瘤细胞倾向于通过有氧糖酵解而不是线粒体氧化磷酸化途径满足其能量需求,也被称为Warburg 效应[8]。Warburg 效应在肿瘤中普遍存在,已被认定为肿瘤的十大特征之一[10]。随着对Warburg 效应研究的不断深入,越来越多的证据提示其可能影响抗肿瘤药物的疗效[9,11]。HK、PFK、PK和LDH 是糖酵解关键酶,研究证实在多种耐药肿瘤细胞中糖酵解关键酶和其代谢产物乳酸水平升高,提示糖酵解可能参与肿瘤耐药过程[11-13]。目前已有研究发现,在肝癌、乳腺癌、食管癌等多种耐药肿瘤组织中HK2、PFK、PKM2 和LDH等过表达,且与多种肿瘤化疗和靶向治疗的耐药密切相关[14-15]。本研究同样发现在NSCLC 吉非替尼耐药细胞中葡萄糖代谢速率升高,乳酸产出水平增加,且HK2、LDHA、PFKP 和PKM2 表达明显升高,说明在吉非替尼耐药细胞中糖酵解活性增强,提示糖酵解的激活可能参与了NSCLC 的吉非替尼耐药,且该过程可能与糖酵解酶的表达升高有关。此外,本研究发现PKM2 仅仅体现蛋白水平升高,但mRNA 水平变化不大,提示PKM2 可能是通过转录后水平实现PKM2的表达升高。
随着对糖酵解在肿瘤耐药中作用的不断认识,研究者开始探索靶向肿瘤糖代谢重编程以降低肿瘤耐药性,并开发了一系列针对糖酵解关键酶的抑制剂[16]。例如,有研究报道己糖激酶抑制剂2-DG 可以有效逆转乳腺癌对曲妥珠单抗的耐药性[17];PKM2 抑制剂紫草素、二甲双胍和维生素K 等可以改善结肠癌、膀胱癌和宫颈癌等对铂类药物的耐药性[18]。PFK和LDH 抑制剂也正在开发中[19],结果值得期待。虽然当前开发的糖代谢通路关键酶抑制剂还处在初步阶段,但现有的研究结果提示其在逆转肿瘤耐药性方面具有广阔的前景[20]。本研究发现,相较于各自亲本细胞,2-DG 对耐药细胞活力的抑制作用更强,说明吉非替尼耐药细胞更依赖糖酵解;同时吉非替尼联合2-DG 可增强吉非替尼对耐药细胞的杀伤效应,提示抑制糖酵解可能逆转吉非替尼耐药,这进一步证实了糖酵解的激活可能参与了吉非替尼的耐药过程。
综上,本研究发现NSCLC 吉非替尼耐药伴随糖酵解的激活和糖酵解关键酶表达升高,抑制糖酵解可部分逆转吉非替尼耐药,且该过程可能通过提高糖酵解关键酶表达水平实现,因此抑制其水平或活性可能是治疗吉非替尼耐药性NSCLC 的有效策略。本研究证实了糖酵解的激活与NSCLC 的吉非替尼耐药有关,进一步揭开了吉非替尼耐药机制。但该结论仅进行了体外实验论证,缺乏相关动物学研究的进一步论证,且其具体调控机制亦有待进一步研究。
