锰离子对肝癌细胞增殖及凋亡的影响
2024-03-20贺紫云王昊伦范倩青刘志辉
贺紫云 王昊伦 范倩青 刘志辉
作者单位:530021 南宁 1.广西医科大学研究生院;2.广西医科大学附属肿瘤医院日间病房
目前肝癌在全球范围内的发病率仍呈上升趋势,是全球第六大常见肿瘤[1],其中肝细胞癌(hepatocellular carcinoma,HCC)是最常见的病理类型,约占肝癌患者的90%[2]。手术、射频消融、分子靶向治疗、免疫检查点抑制剂治疗、化疗是HCC 常用的治疗方法[3-6]。然而,在我国HCC 的长期预后仍不理想,患者5 年生存率不足12.5%[7]。因此,深入探索肝癌发病机制,寻找新的治疗靶点仍是肝癌治疗中亟需解决的难题。
锰是机体必须的微量元素,是精氨酸酶、超氧化物歧化酶等的组成部分。锰能减少脂肪含量,促进胆固醇合成,缺锰后肝细胞出现粗面内质网肿胀和破裂,高尔基体肿大,线粒体异常。本课题组前期研究[8]发现肝癌组织中的锰含量低于癌旁和正常组织,且HCC 中锰含量与化疗敏感性相关,表明锰在肝癌的发生发展以及对抗癌药物的敏感性中扮演重要角色。本研究在此基础上进一步在细胞层面探索锰离子(Mn2+)对肝癌细胞增殖及凋亡的影响,以期明确锰离子在肝癌中的作用。
1 材料与方法
1.1 细胞与主要试剂
肝癌细胞株Huh7和HepG2.2.15细胞购自中国科学院细胞库;DMEM/MEM 培养基购自美国Gibco 公司;无水氯化锰购自上海麦克林生化科技股份有限公司;CCK-8试剂购自美国APExBIO 公司;4%多聚甲醛和0.1%结晶紫溶液购自北京索莱宝生物科技有限公司;Annexin V-APC/7-AAD 凋亡试剂盒购自杭州联科生物技术股份有限公司。
1.2 CCK-8实验检测细胞增殖情况
将Huh7 和HepG2.2.15 细胞接种至96 孔板(分别接种1.5×103个/孔、4×103个/孔),空白组为相同体积的培养基,对照组为相同体积的细胞培养基,实验组分别滴加不同浓度锰离子溶液(1、4、16、64、256、1 024 µmol/L)孵育48 h 后,吸弃孔内液体,每孔继续加入10 µL CCK-8 试剂和90 µL 培养基的混匀液,2 h 后用酶标仪检测每孔在450 nm 波长处的吸光度(OD)值。
1.3 平板克隆形成实验检测细胞增殖能力
将Huh7 和HepG2.2.15 细胞接种至6 孔板(分别接种5×102个/孔、2×103个/孔),设置对照组、锰离子各浓度实验组(1、4、16、64、256µmol/L),每3 d 更换1 次培养基,连续培养14 d 后,形成肉眼可见菌落,经4%多聚甲醛固定,0.1%结晶紫溶液染色,PBS 清洗,自然风干。Image J 计算细胞集落数(细胞数>50),相机拍摄集落图像。
1.4 流式细胞术检测细胞凋亡情况
将Huh7 和HepG2.2.15 细胞接种至6 孔板(分别接种1.6×105个/孔、2.1×105个/孔),锰离子实验组浓度为4、64、1 024µmol/L,培养48 h 后,收集上清液,消化细胞,PBS 清洗,加入Binding buffer 500 µL 重悬细胞,加入Annexin V-APC 和7-AAD 各5 µL,避光孵育30 min,利用贝克曼Cyto FLEX 流式细胞仪采集数据、分析细胞凋亡率。
1.5 统计学方法
采用SPSS 26.0 软件进行数据分析和GraphPad Prism 8.0 软件作图。计量数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,若组间差异有统计学意义,采用LSD或Tamhane检验行多重比较。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度锰离子溶液对肝癌细胞增殖活力的影响
CCK-8实验结果显示,与对照组相比,除在1 μmol/L浓度锰离子溶液处理下Huh7细胞增殖活力差异无统计学意义(P=0.067)外,其余浓度锰离子溶液处理后细胞增殖活力均降低(均P<0.05),且随着锰离子浓度增大,对细胞增殖活力的抑制作用越明显,见图1A;HepG2.2.15 细胞在1 µmol/L、4 µmol/L 浓度锰离子溶液处理下细胞增殖活力差异无统计学意义(P=0.101,P=0.125),其余浓度锰离子溶液处理后细胞增殖活力均降低,差异有统计学意义(均P<0.0001),且随着锰离子浓度增大,对细胞增殖活力的抑制作用越明显,见图1B。

图1 不同浓度锰离子溶液对Huh7和HepG2.2.15细胞增殖的影响Fig.1 Effects of different concentrations of Mn2+ solution on the proliferation activity of Huh7 and HepG2.2.15 cells
2.2 不同浓度锰离子溶液对肝癌细胞克隆形成的影响
平板克隆形成实验结果显示,与对照组相比,Huh7细胞的细胞克隆形成数在1µmol/L、4µmol/L 浓度锰离子溶液处理下差异无统计学意义(P=0.744,P=0.179),其余浓度锰离子溶液处理后细胞克隆形成数均降低,差异有统计学意义(P<0.01),且随着锰离子浓度的增大,细胞克隆形成数量降低越明显,见图2A;HepG2.2.15细胞在1µmol/L浓度锰离子溶液处理下,细胞克隆形成数差异无统计学意义(P=0.214),其余浓度锰离子溶液处理后细胞克隆形成数均降低,差异具有统计学意义(均P<0.0001),且随着锰离子浓度的增大,细胞克隆形成数量降低越明显,见图2B。
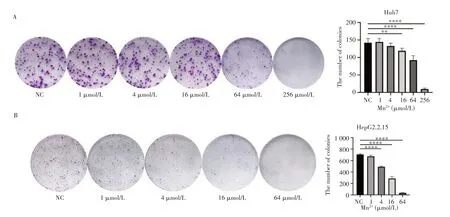
图2 不同浓度锰离子溶液对Huh7和HepG2.2.15细胞克隆形成的影响Fig.2 Effects of different concentrations of Mn2+ solution on colony formation of Huh7 and HepG2.2.15 cells
2.3 不同浓度锰离子溶液对肝癌细胞凋亡的影响
流式细胞术检测结果显示,与对照组相比,在64µmol/L 和1 024µmol/L浓度锰离子溶液处理下,Huh7 细胞(图3A)和HepG2.2.15 细胞(图3B)的细胞凋亡率增加,差异均有统计学意义(均P<0.01),且随着锰离子浓度的增大凋亡率越高。

图3 Huh7和HepG2.2.15细胞在不同浓度锰离子溶液处理下的细胞凋亡率Fig.3 Apoptosis rate of Huh7 and HepG2.2.15 cells in different concentrations of Mn2+solution
3 讨论
在肝癌的发生、发展过程中,硒、锰、铁、铜、锌等微量元素发挥了一定作用,但具体作用机制尚未被充分了解。既往研究报道肝癌组织中铁、铜、锌水平显著低于周围组织[9]。本课题组前期研究[8]测定了55 例HCC 患者的新鲜癌组织、癌旁组织及无癌肝组织中的锌、铜、锰及硒含量,结果显示4 种元素的含量梯度从癌组织、癌旁组织到无癌肝组织依次升高,提示微量元素硒、锰等的含量在肝癌组织中呈“低洼”状态。但低水平的微量元素含量是肝癌发生发展的必要条件还是仅为伴随现象目前尚无定论。本研究在不同锰离子浓度下观察肝癌细胞恶性生物学行为的改变,以探索微量元素锰在肝癌发生发展中的作用。
一般认为微量元素含量的失衡可导致DNA 的不稳定,从而构成了癌症发生的前提条件。LV 等[10]研究发现,在锰缺失的小鼠体内,肿瘤细胞的生长和肿瘤肺转移显著增强,肿瘤浸润的CD8+T 细胞明显减少,表明锰元素不足可能导致肿瘤加速增长,其在抑制肿瘤的发生发展中可能发挥至关重要作用。BO 等[11-12]在胃癌细胞AGS、BGC-823 中添加锰离子,发现可增强牛乳铁蛋白水解物的抗癌效果,使其具有更强的生长抑制作用,并促进细胞凋亡,同时导致更多的细胞被阻滞在G0/G1 期。还有研究表明,锰可以通过激活细胞caspase-3 途径和caspase-12 途径诱导宫颈癌细胞HeLa 和小鼠胚胎成纤维细胞NIH3T3 细胞凋亡[13-14]。另有研究发现前列腺癌细胞于不同时间暴露于不同浓度锰离子后,锰离子以浓度依赖的方式抑制细胞活力,并诱导细胞凋亡[15]。本研究在肝癌Huh7和HepG2.2.15细胞中也观察到锰离子在多个浓度下均能抑制肝癌细胞增殖活力及克隆形成,并促进细胞凋亡,而且随着锰离子溶液浓度的增大,细胞增殖活力及克隆形成能力随之降低,而凋亡率随之增大,说明锰离子对肝癌细胞的抑制作用具有剂量依赖性,且肿瘤微环境中低浓度的锰可能更有利于肝癌的发生发展。但是,锰离子作用于Huh7 和HepG2.2.15细胞的浓度阈值不同,如Huh7 细胞在大于1 µmol/L浓度的锰离子溶液处理后细胞增殖活力降低,而HepG2.2.15 细胞增殖活力须在大于4µmol/L 浓度锰离子溶液处理下才能被抑制,表明两株细胞对锰离子浓度的敏感性不同,但造成差异的原因仍不清楚,有待进一步探索。
综上所述,锰离子能抑制肝癌细胞的增殖和克隆形成,并诱导细胞凋亡,但其具体的作用机制仍不明确,今后将进一步深入研究肝癌细胞调控细胞内以及微环境中锰离子浓度的分子机制,挖掘锰离子调控的信号通路相关蛋白的上下游基因,寻找新的治疗靶点并明确锰离子在肝癌中的作用,为肝癌的治疗提供新策略。
