UBQLN2基因在结肠癌中的表达及其免疫调控作用
2024-03-20孙光源王晓元向骁任艳丽尹洁胡智洁武雪亮薛军
孙光源 王晓元 向骁 任艳丽 尹洁 胡智洁 武雪亮 薛军
作者单位:075000 张家口 1.河北北方学院附属第一医院普通外科;510000 广州 2.中山大学附属第一医院肝胆外科
结直肠癌是一种常见的消化道恶性肿瘤,发病率和死亡率高居全球恶性肿瘤前3 位[1]。结肠癌起病隐匿且进展迅速,大部分患者在初诊时已为晚期,丧失了手术的最佳时机。因此,对于不可切除的结肠癌患者亟需发现新的有效治疗手段。
以PD-1 为代表的免疫疗法在多种癌症的治疗上表现出卓越的疗效,但在结直肠癌治疗中的效果则因患者个体差异而有所不同。例如,微卫星高度不稳定和基因错配修复功能缺陷的结直肠癌患者对免疫检查点抑制剂反应良好;而微卫星稳定和基因错配修复功能完整的结直肠癌患者对免疫检查点抑制剂几乎无应答,治疗效果较差[2]。因此,进一步探索结肠癌肿瘤及微环境的差异,寻找有效的干预靶点对提高结肠癌患者预后具有重大意义。UBQLN2基因在肌萎缩性侧索硬化疾病中被报道[3],与肝细胞癌预后相关,也在肺癌增殖、侵袭中有着重要作用[4-5]。但是在结肠癌中的作用尚未明确。本研究利用来自TCGA数据库和受手术切除的结肠癌患者的两个数据集联合分析,检测结肠癌肿瘤与癌旁转录组差异基因,探索UBQLN2基因与结肠癌患者预后以及与免疫微环境的关系,以及靶向UBQLN2 能否作为结肠癌的潜在治疗选择。
1 资料与方法
1.1 一般资料
选取2021 年1 月至2023 年6 月于河北北方学院附属第一医院普通外科行结肠癌切除术的32 例标本,其中男性23 例,女性9 例,平均年龄为56 岁。所有患者术前均未接受任何放化疗或者其他新辅助治疗,术后病理结果经2 名以上高年资病理医师确认核实。所有患者均签署知情同意书,并具有完整的临床病历资料。本研究经河北北方学院附属第一医院医学伦理委员会审查批准(伦理批准号为K2021091)。
1.2 免疫组织化学检测
免疫组织化学采用EnVision 两步法,福尔马林固定,石蜡包埋,抗原修复,封闭,抗体孵育,DAB 显色,苏木精复染,透化,封片。所用抗体包括兔单克隆抗UBQLN2 抗体(Cat#ab190283),兔单克隆抗TGF-β 抗体(Cat# ab215715),山羊抗兔生物素偶联二抗(Cat#ab150077)均购自美国Abcam 公司。所用试剂包括TRIzolTM试剂(Cat# 12183555),RNeasy Mini 试剂盒(Cat#74106)分别购自美国Invitrogen 公司、德国Qiagen 公司。图像处理:封片后用全自动数字病理切片扫描仪进行扫描,得到病理图像。按染色强度记分,染色强度分级评分:无着色为(-);10%着色定义为弱染色(+);30%着色定义为中等染色(++);50%着色定义为强染色(+++)。
1.3 多色免疫荧光
从福尔马林固定的石蜡块上切下厚度4µm 的石蜡切片,烘箱中烤片2 h。将玻片浸泡至二甲苯溶液中作用10 min,浸泡至不同浓度乙醇中水化,再通过福尔马林溶液固定。将玻片置于EDTA 抗原修复液中,用微波加热进行抗原修复。加入10%山羊血清,室温下封闭10 min。孵育UBQLN2 抗体(美国Abcam公司,Cat# ab190283)和兔单克隆抗TGF-β 抗体(美国Abcam 公司,Cat# ab215715),山羊抗兔荧光二抗(美国Abcam 公司,Cat# ab172730),加入用信号放大液稀释的荧光素进行酪酰胺信号放大(tyramide signal amplification,TSA)显色,室温下孵育10 min。加入DAPI溶液染色细胞核,晾干后用抗淬灭封片剂和盖玻片封片。用TissueFAXS Spectra成像系统(TissueGnostics)对玻片进行扫描。
1.4 流式细胞术
制备单个细胞悬液,计数,按照每个EP(1.5 mL)管(1~2)×106个细胞分装,3 500 rpm,4 ℃离心。用100µL PBS 重悬,封闭,加入PD-1 抗体(美国Abcam公司,Cat# ab52587)孵育,清洗重悬后加入山羊抗兔荧光二抗(美国Abcam 公司,Cat#ab172730)孵育。通过流式细胞仪检测。
1.5 RNA提取与转录组测序
用TRIzolTM试剂(美国Invitrogen公司,Cat#12183555)纯化组织样品,RNeasy Mini 试剂盒(德国Qiagen 公司,Cat#74106)分离总RNA,反转录成cDNA。鉴定总RNA 浓度和质量,然后去除核糖体RNA 后进行文库构建,文库通过Illumina Hiseq 2500 测序平台进行双端2×150 bp 测序。使用fastp(https://github.com/OpenGene/fastp)软件[6]对下机原始数据进行质控,包括去除接头、重复序列和低质量序列,参数为默认参数。使用HISAT[7](https://ccb.jhu.edu/software/hisat2)将测序数据比对到基因组上(Homo sapiens,GRCh38)。采用RSeQC[8]测量基因表达丰度并用RPKM(reads per kilobase per million mapped reads)定量。通过Metascape[9](https://metascape.org/gp/index.html)和clusterProfier[10](https://guangchuangyu.github.io/software/clusterProfiler/)进行通路富集分析。
1.6 肿瘤免疫逃逸评分
通过特征基因集评分评估高UBQLN2和低UBQLN2肿瘤的免疫逃逸情况。特征基因集根据既往文献报道确定[11]。本研究使用AUCell(https://github.com/aertslab/AUCell)包计算特征基因集评分,先提取转录组数据作为输入文件进行细胞排序,输入特征基因集作为“geneSets”,然后使用“AUCell_calcAUC”计算特征基因集的评分。
1.7 单细胞转录组测序
将新鲜收集的肿瘤组织切成直径1~3 mm 的组织碎块,移至5 mL 解离酶中,在37 ℃下消化10 min。用70µm MACS smartfilter(德国Miltenyi Biotec 公司,Cat#130-098-462)和30 µm MACS smartfilter(德国Miltenyi Biotec 公司,Cat#130-098-458)过滤细胞悬液,然后染色评估单细胞悬液的细胞浓度和细胞活力。将细胞悬液浓度调整至700~1 300 个/µL,用于文库构建。制备好的细胞悬液及反应混合物分别加入Chromium Next GEM Chip G 的不同加样孔,经由微流体“单十字”交叉系统形成油包水结构。然后进行反转录,获得带有10× Barcode 的全长cDNA 序列,cDNA 纯化后在DNA聚合酶作用下对cDNA进行扩增。扩增的cDNA用于建库和转录组文库构建。文库构建完成后,采用Illumina NovaseqTM6000进行测序。
1.8 无监督聚类和细胞类型鉴定
采用Seurat R 包[12]中的“LogNormalize”函数对所有细胞的基因表达数据集进行标准化,用“FindVariable-Features”函数识别高度变异的基因,用“ScaleData”函数对高度变异基因的表达进行归一化。然后,使用“RunPCA”函数对高度变异基因进行主成分分析,以“Elbowplot”函数确定用于后续细胞分类的主成分(PCs)数目,并用“FindNeighbors”函数和“FindClusters”函数进行细胞聚类,以UMAP(uniform manifold approximation and projection)算法或t-SNE(t-distributed stochastic neighbor embedding)算法进行聚类结果的可视化。最后,使用“FindAllMarkers”功能识别每种类型细胞的特异性基因,并根据已知的经典基因进行细胞类型注释。
1.9 单细胞拟时序分析
采用Monocle2 包[13]对细胞进行发育轨迹分析。Monocle2 是根据每个细胞基因表达谱的相似和连续变化来推断并构建细胞的发育轨迹,先从Seurat 对象中将单细胞基因表达矩阵提取出来创建Monocle2 对象,然后用Monocle2中的“differentialGeneTest”函数计算不同亚群中的特征基因,再基于“DDRTree”方法进行数据降维,然后使用“orderCells”函数对轨迹上的细胞进行排序。最后,使用“plot_cell_trajectory”函数进行轨迹可视化。
1.10 TCGA数据库分析
通过GEPIA(http://gepia.cancer-pku.cn)及GEPIA2(http://gepia2.cancer-pku.cn/#index)整合TCGA 数据库的分析网站,根据网站说明,选择TCGA 的结肠癌数据库进行肿瘤及癌旁的差异基因分析、UBQLN2 与免疫抑制因子的相关性分析以及UBQLN2与TGF-β和结肠癌预后分析。
1.11 统计学方法
采用R 和GraphPad Prism 6.0 软件进行统计学分析。计量资料以均数表示,当数据中存在离群值时用中位数表示,使用独立样本t检验进行两两比较。分类变量使用χ2检验或Fisher确切概率法进行比较。采用Pearson 检验进行相关性分析。采用Kaplan-Meier法进行生存分析,Log-rank检验进行组间比较。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 UBQLN2在结肠癌组织中的表达
对20 例结肠癌组织及其匹配的癌旁组织进行转录组分析,火山图(图1A)显示结肠癌组织高表达UBQLN2基因;柱状图(图1B)显示结肠癌组织中UBQLN2 mRNA 表达明显高于癌旁组织(t=5.739,P<0.01)。进一步通过TCGA数据库进行验证,共275例结肠癌组织及41例癌旁组织纳入分析,结果(图1C)显示结肠癌组织中的UBQLN2 mRNA 相对表达量高于癌旁组织(P<0.001)。免疫组织化学结果(图1D)显示,UBQLN2 蛋白主要在细胞质中表达,肿瘤组织蛋白的阳性表达强度明显高于癌旁组织。qRT-PCR 检测结果(图1E)显示,结肠癌组织中UBQLN2 mRNA表达高于癌旁组织(t=8.331,P<0.001)。以上结果提示UBQLN2在结肠癌组织中高度表达。

图1 UBQLN2在结肠癌组织中高表达Fig.1 High expression of UBQLN2 in colon cancer tissues
2.2 UBQLN2高表达的结肠癌免疫微环境处于抑制状态
为了进一步评估UBQLN2 在结肠癌中的功能及作用,以总样本的UBQLN2 转录组测序表达的平均值(4.4)为临界值,将UBQLN2 mRNA表达分为高表达组(≥4.4,n=21)及低表达组(<4.4,n=11)。通路富集分析结果显示,UBQLN2 高表达组肿瘤增殖通路显著上调,免疫激活及效应通路显著下调(图2A);肿瘤免疫逃逸评分显示,与UBQLN2 低表达组相比,UBQLN2高表达组的免疫逃逸评分更高(P<0.05,图2B)。比较两组间免疫微环境细胞的表达和功能情况,结果(图2C)显示,UBQLN2 高表达组CD8+T 细胞特异性标志物CD3E 、CD8A 表达量更低(均P<0.01),免疫趋化因子CXCL9、CXCL10 表达也更低(均P<0.05),表明UBQLN2 高表达组CD8+T 细胞占比更少。与此同时UBQLN2 高表达组有更低的免疫杀伤分子GZMB(P<0.01)、IFNG(P<0.001)和更高的免疫耗竭分子PDCD1(P<0.01)、TIGIT(P<0.05)表达,表明UBQLN2高表达组CD8+T 处于功能失调的耗竭状态。以上结果说明UBQLN2 高表达的结肠癌可能呈现抑制性免疫微环境。

图2 UBQLN2高表达的结肠癌呈抑制性免疫微环境Fig.2 High expression of UBQLN2 in colon cancer exhibits an inhibitory immune microenvironment
2.3 UBQLN2高表达的结肠癌高表达TGF-β且预后较差
为了更进一步了解UBQLN2 高表达结肠癌影响肿瘤微环境的原因,比较了TGF-β、IDO1、IL10、ARG1、ARG2、PGE2 等6 种较公认的对免疫微环境有显著抑制作用的细胞因子的表达情况,结果显示,在UBQLN2 高表达组中,TGF-β、IL10 和ARG1 表达高于UBQLN2 低表达组(均P<0.05,图3A)。通过TCGA 数据库在更大样本的结肠癌队列中用UBQLN2 与上述免疫抑制细胞因子进行相关性分析,结果显示在结肠癌中,UBQLN2与TGF-β正相关(r=0.280,P<0.0001,图3B)。接下来的多色免疫荧光实验在UBQLN2高表达组中发现UBQLN2与TGF-β在肿瘤中共表达(图3C)。最后,TCGA的生存分析结果显示,高表达TGF-β 组(P=0.044)和UBQLN2与TGF-β联合高表达组(P=0.004)均有较差的预后(图3D、图3E)。以上结果说明UBQLN2 高表达的结肠癌可能通过调控TGF-β表达发挥免疫抑制功能。

图3 UBQLN2高表达的结肠癌可能通过TGF-β抑制免疫微环境Fig.3 High expression of UBQLN2 in colon cancer may inhibit the immune microenvironment through TGF-β
2.4 单细胞转录组测序分析UBQLN2 高表达的结肠癌对肿瘤T细胞的调控作用
通过单细胞测序进一步验证结肠癌中UBQLN2高表达及其对肿瘤T细胞的调控作用。本研究用1例已通过qRT-PCR 明确检测出有高表达UBQLN2 的结肠癌组织和对应的癌旁组织进行单细胞转录组测序研究。经过严格的质量控制后,共纳入21 528 个细胞,并根据其特点基因的表达情况[14],将其分为9 个细胞亚群(图4A、图4B),通过对癌组织和癌旁组织的基因表达差异分析发现肿瘤中免疫杀伤因子如GZMB、IFNG、PRF1 等表达显著降低,免疫抑制因子如TGF-β、IL10、PD-1、PD-L1等的表达显著增加(图4C);通路富集分析显示肿瘤中TGF-β 通路和增殖通路上调,免疫激活相关通路下调(图4D)。进一步通过单细胞转录组TGF-β 评分提示肿瘤中有显著的TGF-β 表达(图4E)。以上结果证明UBQLN2高表达的结肠癌高表达TGF-β,且微环境呈现免疫抑制状态。
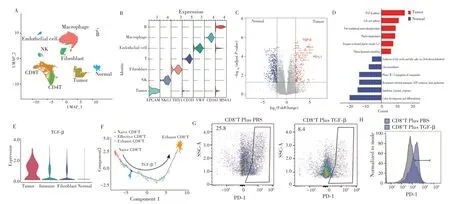
图4 单细胞转录组测序分析UBQLN2高表达的结肠癌中TGF-β的表达及功能Fig.4 Single-cell transcriptome sequencing analysis of the expression and function of TGF-β in colon cancer with high expression of UBQLN2
为了确认肿瘤是否通过TGF-β 抑制CD8+T 细胞的杀伤能力,实现免疫逃逸,进一步通过单细胞拟时序分析探索肿瘤中CD8+T 细胞的杀伤功能,结果显示,初始T 细胞(未被肿瘤激活T 细胞)位于分化轨迹的起始端,耗竭CD8+T 细胞位于轨迹的末端,且随着TGF-β 表达量的提高,CD8+T 细胞的杀伤功能越来越弱,直至耗竭(图4F)。流式分析结果(图4G、图4H)显示,在CD8+T 细胞中加入TGF-β 会显著增加CD8+T细胞中PD-1 的表达,从而发挥免疫抑制功能。以上结果均进一步证实UBQLN2 高表达的结肠癌可能通过高表达TGF-β,抑制CD8+T 细胞杀伤功能,实现免疫逃逸。
2.5 UBQLN2 表达与结肠癌临床病理特征及预后的关系
为了进一步评估UBQLN2 与结肠癌临床病理特征及预后的关系,本研究将样本量扩展到32 例,并以总样本的UBQLN2 转录组测序表达的平均值(4.4)为临界值,将UBQLN2 mRNA 表达分为高表达组(≥4.4,n=21)及低表达组(<4.4,n=11)。癌组织中UBQLN2表达情况与淋巴结转移及肿瘤位置(右半结肠)有关(均P<0.05),而与年龄、性别及肿瘤大小等无关(均P>0.05),见表1。术后24 个月内共9 例患者出现肿瘤复发,其中UBQLN2 高表达组7 例,UBQLN2 低表达组2例。UBQLN2 高表达组12 个月、24个月的无病生存率分别为75.3%、49.4%,UBQLN2 低表达组分别为100.0% 、86.5%,UBQLN2 高表达组的无病生存率均低于UBQLN2 低表达组(P=0.042,图5A)。TCGA 数据库分析结肠癌UBQLN2 高表达组的无病生存率也低于UBQLN2 低表达组(P=0.038,图5B)。
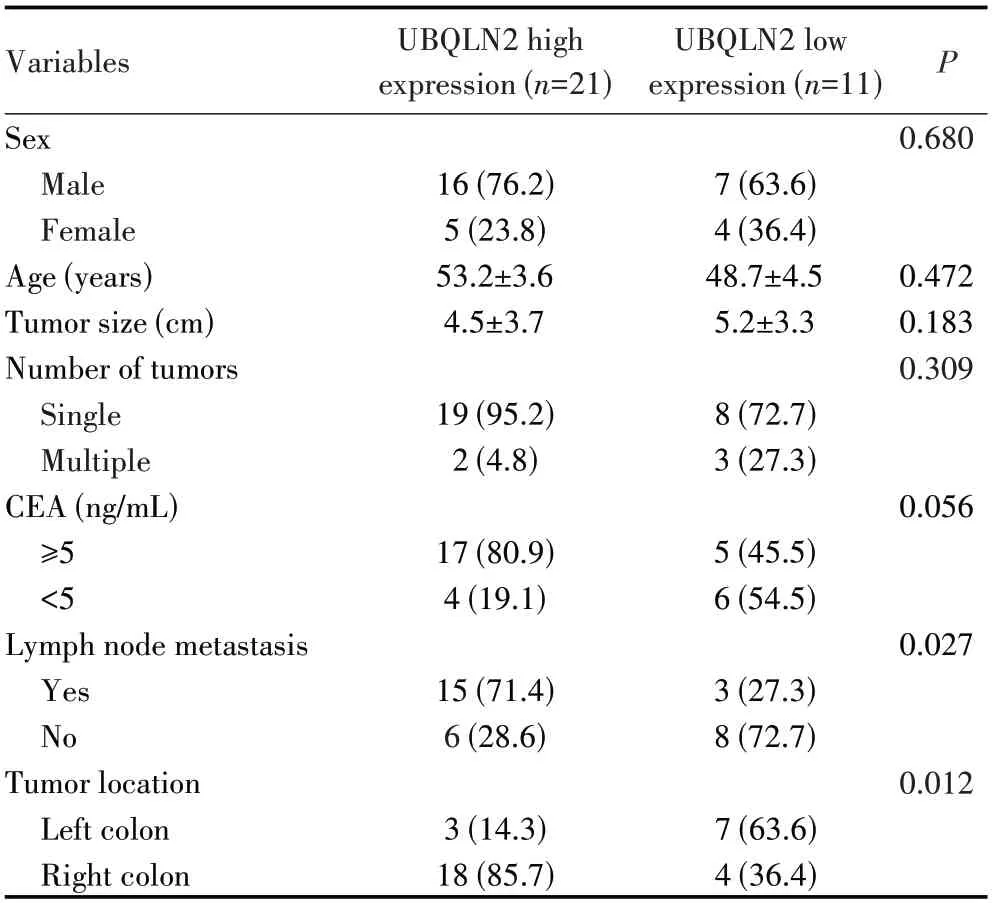
表1 UBQLN2表达与结肠癌患者临床病理特征的关系Tab.1 Relationship between UBQLN2 expression and clinical pathological characteristics of colon cancer patients[n (%)]
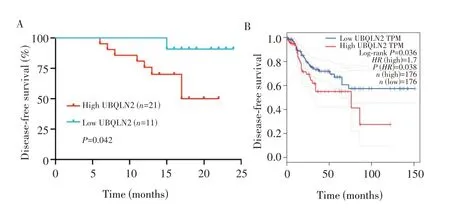
图5 结肠癌中UBQLN2表达与预后的关系Fig.5 Relationship between the expression of UBQLN2 and tumor prognosis
3 讨论
结肠癌是肠黏膜上皮组织因自身遗传、外界环境等因素而发生的一种恶性病变,预后较差,尤其是不可切除的结肠癌对放化疗不敏感,且尚缺乏有效的治疗靶点[15-17]。因此,挖掘新的有效的肿瘤标志物对提高结肠癌预后有着重要意义。本研究发现,结肠癌高表达UBQLN2基因,且UBQLN2 与结肠癌患者的预后高度相关;UBQLN2 高表达的结肠癌可能通过调控TGF-β 抑制CD8+T 细胞的杀伤效应功能,诱导抑制性免疫微环境,促进肿瘤进展,靶向UBQLN2 可能作为结肠癌的潜在治疗选择。
TGF-β,也被称为转化生长因子,是调节T细胞发育、活化、增殖、分化和死亡的关键细胞因子。TGF-β可以抑制免疫细胞的增殖和分化成熟。此外,TGF-β能抑制炎症杀伤因子(GZMB、IFNG)的合成与释放,下调CD8+T 淋巴细胞活性,促进其凋亡[18-19]。TGF-β在调节人体固有免疫和适应性免疫反应中发挥重要的作用。本研究发现UBQLN2 表达与TGF-β 呈正相关性,通过多色免疫荧光实验证实了UBQLN2 和TGF-β 在肿瘤细胞中共表达,单细胞结果也发现肿瘤中UBQLN2高表达与TGF-β分子和TGF-β通路上调相关,并且随着TGF-β表达的增加,T细胞耗竭也增加,以上结果说明UBQLN2高表达的结肠癌可能通过调控TGF-β抑制免疫微环境。
本研究还分析了UBQLN2 表达与结肠癌临床病理特征及预后的关系,发现UBQLN2 高表达与淋巴结转移及肿瘤位置(右半结肠)有关,且高表达患者的预后较差。临床上基于胚胎发育、血液供应、解剖和功能的差异,将结肠以脾区为分界分为左半结肠和右半结肠,同时将对应部位发生的恶性肿瘤称为左半结肠癌与右半结肠癌。“左半结肠癌和右半结肠癌之争”成为结肠癌的热点话题之一。左、右半结肠癌在流行病学、临床特征、肿瘤分化程度及侵袭性、对治疗的反应、预后、分子学特征等多方面存在显著差异[20]。有研究报道,右半结肠癌肿瘤分化程度较低,肿瘤侵袭能力更强,对放化疗不敏感,预后更差[21]。免疫治疗逐渐成为肿瘤治疗的发展方向,对多种癌症表现出明显优势和生存益处[22]。本研究中UBQLN2高表达患者主要分布在右半结肠癌,且与预后显著相关,考虑可能是因为右半结肠癌中UBQLN2普遍高表达,其通过大量释放TGF-β诱导了抑制性免疫微环境的形成,从而促进了肿瘤进展。UBQLN2表达的差异可能为二者的生物学行为差异提供解释,联合UBQLN2和PD-1的免疫治疗有可能给这部分结肠癌提供潜在的治疗方式。
综上,本研究结合了临床样本和生物信息学分析验证了UBQLN2 在结肠癌组织中高表达,并且与预后显著相关,UBQLN2 高表达的结肠癌可能通过TGF-β抑制免疫微环境,UBQLN2 可能是结肠癌一个潜在的治疗靶点。然而,本研究样本量较少,UBQLN2 对结肠癌调控机制的探索还不够深入,后续仍需进一步在体内和体外深入证实。本研究初步探索了UBQLN2在结肠癌中的作用及机制,能为靶向UBQLN2 治疗提供科学依据以及为结肠癌的精准治疗提供新思路和新靶点。
