新辅助放疗联合免疫治疗在局部进展期直肠癌中的研究进展
2024-03-20王明非商亮种微田锋李乐平靖昌庆
王明非,商亮,种微,田锋,李乐平,靖昌庆
1 山东大学,山东济南 250012;2 山东省立医院胃肠外科,山东济南 250021;3 山东第一医科大学附属省立医院胃肠外科,山东济南 250021
直肠癌是常见的消化道肿瘤之一,其发病率和病死率在所有恶性肿瘤中分别排名第3 位和第2位[1]。在我国,70%的直肠癌患者确诊时已发展成为局部进展期直肠癌(LARC),即肿瘤侵出肠壁肌层及侵入周围组织或存在区域淋巴结转移且无远处转移的中低位直肠癌[2]。随着多学科综合治疗的不断成熟,全程新辅助治疗(TNT)或新辅助放化疗(nCRT)后进行全直肠系膜切除术或等待观察策略被推荐为LARC 的标准治疗模式[3-4]。随着免疫治疗在实体肿瘤中应用的研究和临床试验不断展开,免疫检查点抑制剂(ICIs)在LARC 中,尤其是在微卫星高度不稳定(MSI-H)或错配修复缺陷(dMMR)的患者中取得了较好的疗效[5];但由于MSI-H/dMMR 患者比例较小,大部分微卫星稳定(MSS)或错配修复正常(pMMR)LARC 患者如何在免疫治疗中获益是目前的研究重点[6]。近年来,通过新辅助放疗来增敏ICIs 的疗效,让“冷肿瘤”向“热肿瘤”转变进而改善患者预后的临床研究取得了突破性的进展,但就ICIs 的选择、放疗的剂量分割和放疗及ICIs 序贯治疗的先后顺序等问题未能达成一致[7]。本文将对新辅助放疗联合免疫治疗在LARC 中的临床研究进行综述,同时探讨放疗增敏免疫治疗的具体机制及放疗联合免疫治疗疗效预测的生物标志物。
1 新辅助放疗联合免疫治疗在LARC中的临床应用
目前,LARC 相关放疗联合免疫治疗的临床研究大多涉及新辅助化疗,关于放疗剂量与分割的选择,免疫治疗与放疗的先后顺序及ICIs 与化疗方案的配伍问题,是目前研究中存在争议的热点。表1归纳了2023 年在美国临床试验注册库(clinicaltrials. gov)登记的目前仍在活跃进行中的LARC 相关新辅助放疗联合免疫治疗的临床试验。
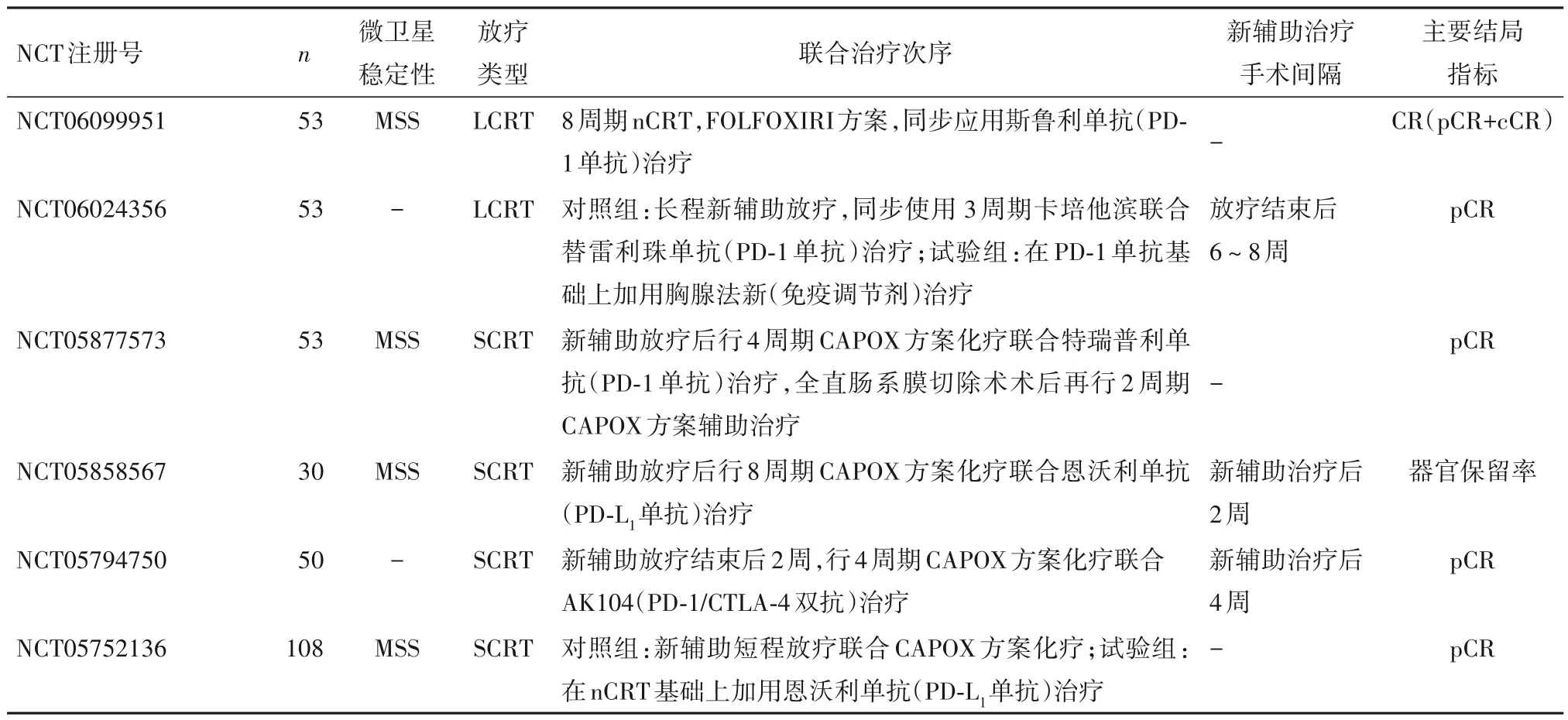
表1 2023年注册LARC新辅助放疗联合免疫治疗临床研究
1.1 放疗剂量与分割 与常规分割、长程放疗(LCRT,50.4 Gy,28 次)相比,大分割、短程放疗(SCRT,25 Gy,5次)在肿瘤降期、减少远处转移和提高患者依从性方面存在显著优势,但在局部复发率方面存在一定风险[4,8]。2021年,一项来自意大利的二期临床研究AVANA,研究探索了卡培他滨+常规分割LCRT(50.4 Gy,28 次)联合阿维鲁单抗(PD-L1单抗)在LARC 患者中的治疗效果,结果提示在96例可进行病理评估的LARC 患者中,常规分割长程nCRT 联合免疫治疗可达到23.0%的病理完全缓解(pCR)率[9]。另一项由华中科技大学同济医学院附属协和医院发起的二期、单臂临床试验研究了先行SCRT(5×5 Gy),再行2周期CAPOX 化疗方案联合卡瑞利珠单抗(PD-1单抗)治疗在LARC患者中的安全性及疗效,试验结果表明,在接受手术的27 例患者中,pCR 率达48.1%[10]。而来自英国在研的二期、开放标签、随机对照临床试验PRIME-RT 研究中,对照组为先行SCRT(5×5 Gy)+度伐鲁单抗(PD-L1单抗),再行6 周期FOLFOX+度伐鲁单抗治疗;实验组则为先行卡培他滨联合LCRT(2×25 Gy)+度伐鲁单抗,再行4 周期FOLFOX+度伐鲁单抗治疗。研究的主要结局指标为pCR 率或临床完全缓解(cCR)率[11]。期待该在研的临床试验完成时,其结果的公布能回答关于LARC 患者新辅助联合治疗方案中放疗的分割与周期选择的争议。
1.2 免疫治疗联合放疗的时机 免疫治疗联合新辅助放疗应用的时机对治疗效果至关重要,当前主要分为三种模式:免疫治疗诱导后进行放(化)疗、放疗增敏后ICIs巩固治疗、新辅助放疗同步免疫治疗。2023 年复旦大学附属肿瘤医院的一项TORCH 研究纳入了62 例肿瘤距肛缘10 cm 的LARC 患者,巩固组(34 例)先行SCRT,再进行6 个疗程CAPOX 化疗方案联合特瑞普利单抗(PD-1 单抗)治疗,诱导组(28 例)先行2 个疗程上述化疗+免疫治疗,再行SCRT,最后行后续4 个疗程化疗+免疫治疗。结果发现巩固组cCR 率为55.9%,显著高于诱导组的35.7%;而在接受全直肠系膜切除术手术的32 例患者中,诱导组pCR 率为69.2%,高于巩固组的47.4%[12]。这提示放疗增敏序贯免疫治疗可提高临床缓解率和器官保留(保肛)机会,同时也存在一定的局部复发风险。来自瑞士的二期、单臂临床试验PEMREC 研究招募了25 例局灶性直肠癌患者,进行SCRT 的同时同步使用了帕博利珠单抗(PD-1 单抗),主要研究终点为肿瘤退缩分级[13]。在另一项多中心、单臂临床试验REGINA 研究中则对LARC 患者首先进行了2周期纳武利尤单抗(PD-1单抗)联合瑞戈非尼诱导治疗后,行SCRT,后续再行3 周期免疫联合靶向治疗,主要结局指标为pCR 率[14]。上述研究的完成将进一步阐明新辅助放疗和免疫治疗的组合次序对LARC患者治疗效果的影响。
1.3 手术时间及辅助治疗选择 对接受新辅助放疗联合免疫治疗的LARC 患者,新辅助治疗与全直肠系膜切除术手术间隔尚未有定论。目前标准治疗方案推荐在完成nCRT后5~12周后进行手术治疗以期获得最大获益(最高的pCR 率)[3]。但同时最新研究提示,并非所有LARC 患者都适合延迟手术[15]。大部分新辅助放疗联合免疫治疗的临床研究在新辅助治疗后2~4 周进行全直肠系膜切除术,部分应用LCRT 的临床研究在新辅助治疗后8~10周后进行手术治疗[9]。在比利时开展的一项二期临床试验RIMMUNE 研究,对照组使用常规nCRT,新辅助治疗10周后进行手术治疗;实验组则在nCRT后接受3周期阿替利珠单抗(PD-L1单抗)治疗,全部新辅助治疗结束3 周后(以放化疗结束为基准,同样约为10 周)进行手术治疗[16]。
依据RAPIDO研究公布的结果[4],TNT治疗模式因其治疗依从性的提高、器官保留的优势,受到越来越多的重视,但TNT 联合免疫治疗模式在术后局部复发控制方面仍存在争议。复旦大学在研的两项分别基于MSS(NCT04411537)和MSI-H(NCT04411524)LARC 患者的二期临床试验,2 周期PD-1 单抗治疗后,行LCRT(50 Gy),再行3 周期PD-1 单抗治疗后1~2 周行全直肠系膜切除术,且术后进行6 周期XELOX 方案辅助化疗。期待该研究能进一步明确术后进行辅助治疗在新辅助放疗联合免疫治疗方案中的必要性和安全性。
目前,依照RAPIDO 研究设计,大部分在LARC中开展的新辅助放疗联合免疫治疗的临床研究多采用SCRT 模式,术前给予大分割,SCRT 拥有等待手术时间短、患者依从性高及远处转移率低等优势,但在肿瘤退缩及器官保留方面仍有缺陷。仍有临床试验给予LCRT 模式,给予传统的长程nCRT 设计方案,部分研究还在全直肠系膜切除术术后补充了辅助化疗进行巩固,以期获得更有效的肿瘤退缩及术后复发控制。LARC 中新辅助治疗联合免疫治疗的疗效优于单纯nCRT 及单纯ICIs 治疗已得到初步证实,目前在研的临床试验已逐渐在设计阶段注重新辅助放疗与ICIs的配伍方式及免疫治疗具体的使用周期等问题,也希望更合理的联合治疗模式能够为LARC患者带来更好的疗效及预后。
2 新辅助放疗联合免疫治疗LARC的机制
2.1 免疫浸润 肿瘤微环境可通过影响肿瘤细胞增殖、代谢、侵袭迁移和远处转移,进而在直肠癌的发生与进展中发挥重要作用。肿瘤微环境中T 细胞、B 细胞、肿瘤相关巨噬细胞及树突状细胞等免疫细胞的存在和分布情况称为免疫浸润,对nCRT 及免疫治疗的疗效存在深远影响[17-18]。研究发现,一方面,放疗可通过增加肿瘤微环境中肿瘤相关抗原、损伤相关的分子模式等的释放,促进抗原呈递细胞,尤其是树突状细胞的活化,引发炎症级联反应,进而改善免疫治疗疗效[18];同时,直肠癌及癌旁组织中的CD8+T 细胞浸润会受放射影响增加,从而易化ICIs的抗肿瘤作用[19]。另一方面,SCRT可能增加肿瘤微环境中免疫抑制细胞群,如免疫调节T 细胞、M2 巨噬细胞和髓源抑制性细胞的浸润[17,20]。放疗作为一把双刃剑,如果应用得当,可发挥原位肿瘤疫苗的作用,促进免疫治疗疗效,反之则将进一步恶化肿瘤微环境中的免疫抵抗与免疫逃逸环境。
2.2 远隔效应 对原发肿瘤放疗的同时,对放射野外的肿瘤细胞产生杀伤的效果称为远隔效应。放疗联合免疫治疗可增强远隔效应强度,引起全身抗肿瘤反应,对晚期肿瘤及转移瘤的治疗意义重大[21]。研究发现,单纯放疗极难引发远隔效应,且存在剂量依赖,而在免疫激活、免疫抑制、免疫缺陷三种环境中,放疗引发远隔效应的难度逐渐增大[22]。这提示抗肿瘤免疫环境在放疗发挥肿瘤杀伤作用的过程中发挥着关键作用。电离辐射可通过促进远端肿瘤微环境中肿瘤相关巨噬细胞由免疫抑制的M2 型向免疫促进的M1 型转变,清空肿瘤引流淋巴结中免疫抑制及促肿瘤的细胞因子,诱导p53信号通路活化,进而介导远端肿瘤病灶发生衰老、自噬;还可经由肿瘤相关外泌体将肿瘤相关抗原传递给抗原呈递细胞,激活自身免疫系统造成肿瘤杀伤,促进远隔效应的发生[23]。越来越多的基础和临床研究报道了结直肠癌中的远隔效应及其诱导条件[24-25],相信进一步的机制研究将为扩大新辅助放疗联合免疫治疗在进展期直肠癌中的应用范围提供理论支撑。
2.3 肠道菌群 肠道菌群被称为人类第二基因组,不仅与肠功能障碍、营养与代谢相关,同时能够影响消化道肿瘤,尤其是结直肠癌的发生与发展[26]。此外,肠道菌群及其代谢产物在二级淋巴器官和三级淋巴结构中也发挥重要作用,可直接或间接影响T细胞成熟及分化过程[26]。因结直肠癌与肠道菌群的空间关系密切,对原发肿瘤的放疗可重塑肠道微生态,进而影响免疫治疗效果[27]。有研究表明,肠道菌群及其代谢产物在放疗后的改变,可促进肿瘤相关抗原的释放并增加干扰素γ,以增强免疫微环境抗肿瘤作用[28]。现阶段探讨肠道菌群在放疗或免疫治疗中作用的相关研究多集中于某一具体菌属或特定代谢产物,且对其调节多通过抗菌药物完成。进一步探索肠道菌群及其代谢产物参与LARC 发生发展过程中的具体机制,为LARC 新辅助治疗提供新的靶点或免疫调节剂。
对LARC 的肿瘤免疫微环境的研究一直是领域内的热点,放疗带来的包括免疫增敏和免疫抵抗在内的双面效应,也为进一步探索改善免疫治疗在LARC 中疗效打开了大门。随着单细胞测序、空间转录组学及多组学联合分析等技术的不断突破,对新辅助放疗增强LARC 免疫治疗疗效内在机制的理解也在不断丰富和刷新。如何将最新的机制研究进展转化为指导临床诊疗实践及预测患者预后的成果,将是未来LARC 中应用放疗联合免疫治疗相关研究的重点。
3 新辅助放疗联合免疫治疗LARC 的疗效预测生物标志物
2017 年,MSI-H/dMMR 首次被美国食品药品监督管理局(FDA)认定为单一基因标志物,从而批准帕博利珠单抗用于晚期实体瘤的治疗,自此拉开了结直肠癌免疫治疗的序幕[5]。随着越来越多新辅助放疗联合免疫治疗临床试验的结果公布,数据显示部分病理类型为MSS/pMMR 的LARC 患者在新辅助放疗联合免疫治疗中获益[9-10,24,29]。除MSI-H/dMMR、PD-1/PD-L1等成熟的标志物之外,明确新的生物标志物以预测新辅助治疗疗效,寻找新的治疗靶点逐渐成为研究热点。
3.1 遗传学特征
3.1.1 肿瘤突变负荷(TMB) 指的是特定基因组区域内体细胞非同义突变的个数(mut/Mb),当TMB≥10 mut/Mb 时被定义为TMB-H。作为相对独立的预测标志物,TMB-H 与肿瘤细胞表面新抗原表达增加相关,可易化抗原识别与呈递,加速免疫系统肿瘤杀伤作用[30]。经临床试验KEYNOTE-158 研究证实,在部分种类的实体瘤患者中,相较非TMB-H 组,TMB-H 组患者具有更高的客观缓解率,这也使得TMB成为继MSI-H/dMMR后第二个泛实体瘤免疫治疗预后预测生物标志物[31]。但TMB在LARC中的检测不在常规考虑范围内,TMB 对LARC 的免疫治疗效果预测仍有待进一步考证。
3.1.2 共识分子分型(CMS) 于2015 年首次提出,旨在区分结直肠癌患者在基因表达水平的异质性,用于指导临床诊治[32]。随着免疫治疗在结直肠癌领域的不断开展,CMS 分型对接受免疫治疗的LARC 患者预后的预测价值不断凸显。其中CMS1亚型占患者人群的14%,以MSI-H 及TMB-H 为特征,免疫反应处激活状态;CMS2 亚型占患者人群的37%,以WNT 及MYC 信号通路激活为特征,上皮细胞特性降低,肿瘤微环境以免疫逃逸为主;CMS3 亚型占患者人群的13%,以代谢失调为特征;CMS4 亚型占患者人群的23%,以转化生长因子-β 活化、细胞间质纤维化及血管生成为特点,免疫反应同样处于抑制状态[33]。如何通过新辅助放疗或免疫增敏剂实现免疫抑制的CMS 亚型向免疫激活的亚型转变将是未来研究的重点。
3.1.3 基因突变 随着基因组学的飞速发展及大规模癌症基因组测序的展开,可精准预测LARC 免疫治疗疗效的基因组标志物正不断涌现。编码DNA 聚合酶ε(POLE)及DNA 聚合酶δ1(POLD1)的基因突变与TMB-H 相关,且临床研究表明POLE/POLD1 突变指示直肠癌患者可从免疫治疗中获益[34]。此外,还有研究表明,ARID1A 突变可作为MSS/pMMR 结直肠癌患者免疫活跃及可从免疫治疗中获益的基因组标志物[35]。
3.2 循环血生物标志物 ①循环肿瘤细胞从原发肿瘤表面脱落进入血液、淋巴循环,进而被用于预测结直肠癌患者预后及术后复发风险,作为现行血清学肿瘤标志物的补充,液体活检的特点是便捷且依从性高,但在准确性方面有待进一步提高[36]。②循环肿瘤DNA 作为进入外周循环血的肿瘤DNA 片段,是液体活检中最成熟的生物标志物,其主要作用包括鉴别ICIs 作用模式,预测nCRT 及免疫治疗疗效、预后,评估肿瘤耐药性及肿瘤负荷,早期诊断直肠癌及预防术后局部复发[37]。③中性粒细胞淋巴细胞比值(NLR)和血小板淋巴细胞比值(PLR)可用于预测接受nCRT 的LARC 患者预后,新辅助治疗前的高PLR与更差的预后密切相关[38]。
3.3 肠道菌群及代谢物 在结直肠癌中,已证明与抗肿瘤效应相关,可提高ICIs 疗效的肠道菌群菌属包括另枝菌属、瘤胃球菌属、乳状乳球菌属、真杆菌属、梭杆菌属、考拉杆菌属、拟杆菌属、副普雷沃氏菌属和副拟杆菌属等[39]。此外,肠道菌群代谢物丁酸和部分其他短链脂肪酸的衍生,或提示肿瘤增殖、微生物稳态增强和免疫治疗抗肿瘤效率下降[28,39]。
虽然随着nCRT的不断成熟,TNT概念的逐渐普及和免疫治疗的引入,使得LARC 患者的生存和生活质量都有了显著改善,但仍有部分患者无法从现存的治疗方案中显著获益。对新的疗效预测生物标志物的探索,一方面可为患者选择最适治疗方案,另一方面也可为进一步的基础、亚临床及临床研究指示方向。
综上所述,LARC 免疫治疗方兴未艾,越来越多的研究数据提示联合新辅助放疗能够让LARC 患者,尤其是MSS/pMMR 患者获益。但关于新辅助放疗的剂量、分割,联合使用ICIs的周期、应用配伍,新辅助治疗与全直肠系膜切除术手术的间隔,是否行全程新辅助治疗等问题,仍有待后续多中心、大样本的随机对照研究进一步证实。同时,随着放疗联合ICIs 改善LARC 患者预后的机制探索不断深入,以及除MSI-H/dMMR之外更多新的生物学标志物的涌现,相信新辅助放疗联合免疫治疗应用于LARC 的前景可期。
利益冲突声明所有作者声明不存在利益冲突
作者贡献声明王明非:论文撰写;种微:论文修订;田锋:论文最终版本修订;商亮:论文审核;李乐平:提出研究方向;靖昌庆:设计论文框架、研究指导监督
