基于小鼠谱系追踪的围着床期子宫内膜上皮-间质转化探究
2024-03-20唐心怡曹志文王晓莹周继东张阳岳秋玲姜瑞伟李朝军颜桂军孙海翔
唐心怡,曹志文,王晓莹,周继东,张阳,岳秋玲,姜瑞伟,李朝军,颜桂军,孙海翔*
(1.南京大学医学院附属鼓楼医院生殖医学中心,南京 210008;2.南京医科大学生殖医学与子代健康全国重点实验室,南京 211116)
子宫内膜是女性生殖系统的重要组织器官,具有周期性重塑、蜕膜化和胚胎种植等生理功能,而这些关键生理功能需要该组织的细胞在间质和上皮表型之间转换[1-2],这一过程被称为上皮-间质转化(epithelial-mesenchymal transition,EMT)或间质-上皮转化(mesenchymal-epithelial transition,MET)。其中,MET主要参与子宫内膜的周期性重塑与蜕膜化过程,而EMT主要参与胚胎着床过程[1,3]。在胚胎种植过程中发生的EMT,使子宫内膜腔上皮细胞获得细胞间黏附减少、迁移能力增加的间充质特征,有利于胚胎滋养层细胞的侵袭[4]。然而,由于伦理和技术等方面的限制,目前关于子宫内膜的EMT研究主要为体外实验[5],尚无动物实验证据证明子宫内膜在胚胎种植过程能够发生EMT。因此,用动物模型证明该过程中EMT的发生,尤其是找到上皮细胞EMT后成为间质细胞的直接形态学证据,对于这一领域的研究具有重大意义。
谱系追踪技术是一种用于追踪和分析细胞增殖分化过程中细胞谱系的方法。通过引入遗传标记物(如荧光基因)对特定细胞群进行标记,随着细胞的增殖与分化,这些标记物会被传递给后代细胞,因此可根据遗传标记物的存在判断细胞的谱系来源。本研究拟构建LtfcreRosa26mT/mG小鼠用于研究胚胎种植过程中的子宫内膜上皮细胞的EMT行为,利用谱系追踪技术寻找子宫内膜中上皮细胞EMT后转化为间质细胞的直接形态学证据,并进一步探究围着床期与激素刺激下子宫内膜EMT的变化情况。
材料与方法
一、实验动物
本研究中使用的Rosa26mT/mG(Rosa26KI/KI)小鼠由厦门大学王海滨教授团队赠与,Ltf-Cre(LtfCre/WT)小鼠由华南农业大学苏仁伟教授团队赠与。实验(不包括繁育过程)共使用可育雄鼠12只,LtfcreRosa26mT/mG雌鼠36只,其中21 d雌鼠3只,6周龄雌鼠3只,8周龄雌鼠30只。所有小鼠均饲养于南京大学医学院附属鼓楼医院动物房,饲养环境温度为19~22℃,相对湿度40%~70%,采用12 h明/暗光照循环(7:00—19:00),自由饮水和进食,适应性喂养一周后进行下一步实验。所有动物实验均在江苏省实验动物管理委员会指导下进行,并经南京鼓楼医院实验动物伦理委员会(SYXK 2021-0509)批准。
二、实验试剂
雌二醇(E2,E2758)、孕酮(P4,P0130)、芝麻油(S3547)均购自美国Sigma-Aldrich公司;兔抗E-Cadherin单抗(3195S)购自美国CST公司;兔抗Vimentin多抗(BS1855)购自美国Bioworld公司;兔抗CD45多抗(ab10558)和驴抗兔Alexa Fluor647荧光二抗(ab150075)均购自英国Abcam公司;PCR试剂盒(P213-01)购自南京诺维赞公司,PCR引物由南京金斯瑞公司合成。
三、实验方法
1.LtfcreRosa26mT/mG小鼠的配繁与鉴定:将P0代Rosa26mT/mG(Rosa26KI/KI)小鼠和P0代Ltf-Cre(LtfCre/WT)小鼠杂交,P1代中50%为LtfCre/WTRosa26KI/WT小鼠,50%为LtfWT/WTRosa26KI/WT小鼠。通过P1代LtfCre/WTRosa26KI/WT小鼠与P0代Rosa26KI/KI小鼠再次杂交,P2代中25%为LtfCre/WTRosa26KI/KI小鼠,即LtfCreRosa26mT/mG小鼠。繁育过程中,通过鼠尾PCR方法鉴定小鼠基因型。PCR反应条件为:95℃预变性3 min;95℃变性30 s,61℃退火30 s,72℃延伸45 s,共35个循环;72℃进一步延伸10 min。引物及序列见表1。

表1 引物及序列
2.胚胎种植时间点小鼠收样:6:00 pm将12只8周龄的LtfcreRosa26mT/mG雌鼠与12只可育雄鼠按1∶1合笼,次日8:00 am检查雌鼠阴道及阴道口周围,若见到白色阴栓,则判定雌雄鼠交配,当天上午记为0.5 dpc(0.5 day post copulation),在2.5 dpc、3.5 dpc、4.0 dpc或4.5 dpc时处死小鼠,取出小鼠子宫,液氮速冻后保存于-80℃。每个时间点取3只小鼠进行实验。
3.雌孕激素序贯刺激造模:15只8周龄的雌性LtfcreRosa26mT/mG小鼠分为5组(每组3只),进行卵巢切除手术。术后休息2周后,处死第1组小鼠,记为“卵巢切除术后2周”组;剩余4组小鼠连续3 d皮下注射50 μl含有100 ng E2的芝麻油,第三次注射E2后6 h后处死第2组小鼠,记为“E2后6 h”组,2 d后处死第3组小鼠,记为“E2后休息2 d”组;剩余2组小鼠连续2 d皮下注射50 μl含有1 mg P4、10 ng E2的芝麻油,第二次注射P4+ E2后6 h处死第4组小鼠,记为“P4后6 h”组,剩余1组小鼠休息5 d后处死,记为“P4后休息5 d”组。小鼠处死后快速收取子宫组织,液氮速冻后保存于-80℃。具体造模与收样方法见图4A。
4.组织冰冻切片与染色:待测组织离体后去除表面多余水分,经液氮冷冻后,进行冰冻切片(厚度为10 μm);37℃烤片3 min,随后使用4% PFA/PBS室温避光固定15 min;PBS洗3遍,每次5 min;山羊血清室温封闭1 h后,一抗(1∶500稀释)4℃避光孵育过夜,PBS洗3遍,每次5 min;二抗(1∶500稀释)室温避光孵育1 h,PBS洗3遍,每次5 min;DAPI室温避光染色10 min,PBS洗3遍,每次5 min;抗淬灭剂封片,荧光显微镜拍照。
四、统计学分析
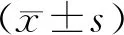
结 果
一、LtfcreRosa26mT/mG小鼠模型验证
为了验证LtfcreRosa26mT/mG小鼠子宫内膜上皮细胞的重组效率,以及确定开始重组、完成重组的时间,我们收集了出生后21 d、6周龄、8周龄的雌性LtfcreRosa26mT/mG小鼠子宫组织进行冰冻切片,荧光显微镜下镜检。结果显示,出生后21 d的小鼠子宫内膜未见EGFP绿色荧光,证明该模型鼠不存在胚胎期Cre酶表达(图1B),用于谱系追踪研究时不会受到胚胎发育过程信号的干扰。在6周时,仅部分上皮细胞表现出EGFP荧光,而在8周小鼠完全性成熟后,所有上皮细胞均表现出EGFP荧光。此外,间质中也存在零星分布带EGFP荧光的细胞(图1C)。

A:LtfcreRosa26mT/mG小鼠模型构建图;B:出生21 d后LtfcreRosa26mT/mG小鼠子宫冰冻切片荧光染色(5×);C:6周龄与8周龄LtfcreRosa26mT/mG小鼠子宫冰冻切片荧光染色(10×、20×)。
二、性成熟后LtfcreRosa26mT/mG小鼠子宫内膜中存在由上皮细胞EMT形成的间质细胞
收集8周龄的雌性LtfcreRosa26mT/mG小鼠子宫组织进行冰冻切片,分别与上皮细胞、间质细胞、免疫细胞的标志物E-cadherin、Vimentin、CD45共染后,confocal镜下观察,间质中零星分布的EGFP+细胞中无E-cadherin+细胞,部分为CD45+的免疫细胞,部分为Vimentin+的间质细胞,这部分Vimentin+EGFP+细胞即为由上皮细胞EMT形成的间质细胞(图2)。
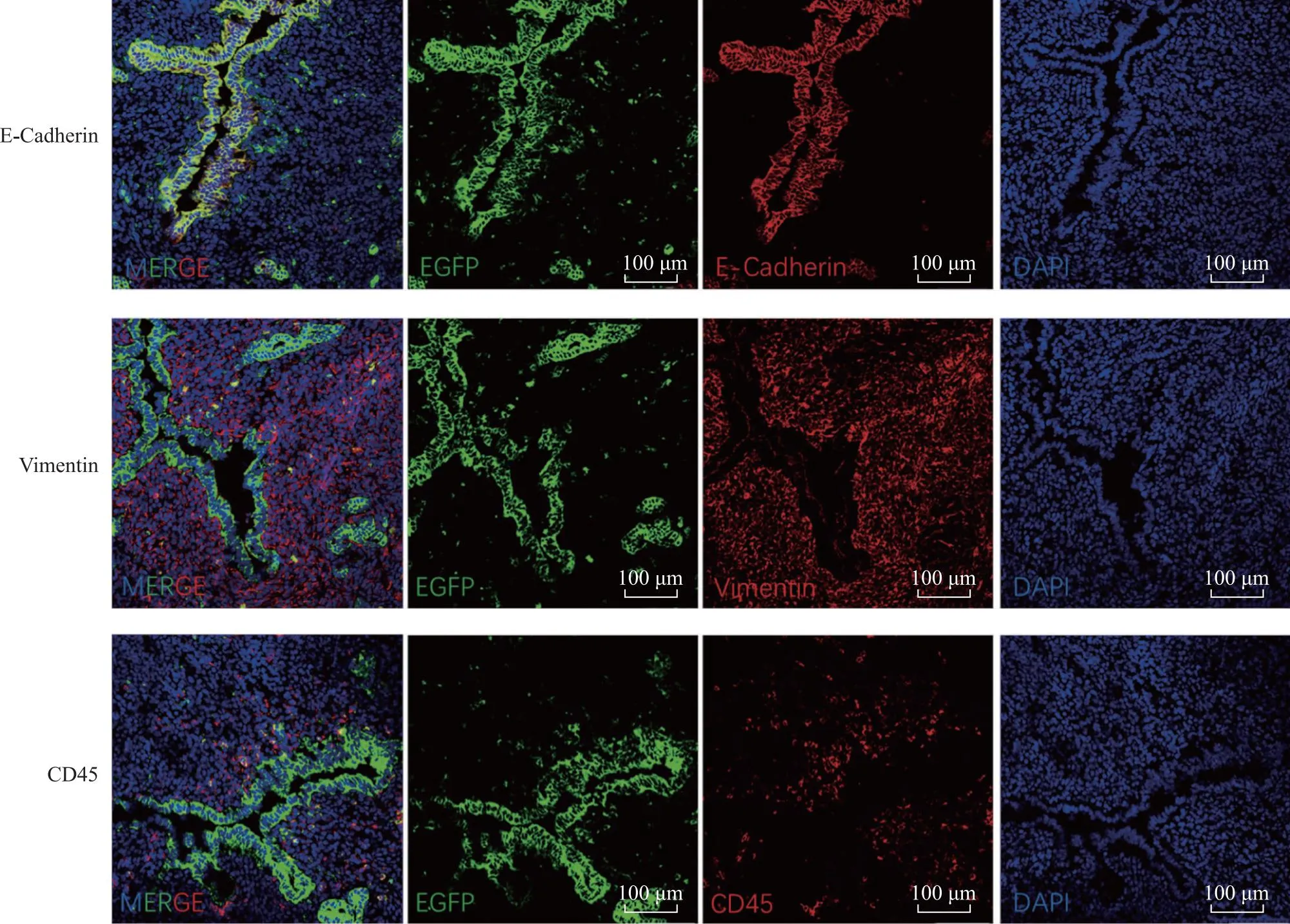
子宫切片分别与E-cadherin、Vimentin、CD45共染,confocal成像(20×)。
三、胚胎围着床期LtfcreRosa26mT/mG小鼠子宫内膜间质EGFP荧光变化情况
为了探究胚胎种植过程中子宫内膜上皮细胞EMT的变化情况,以见栓当日上午为0.5 dpc,我们收集了2.5 dpc、3.5 dpc、4.0 dpc、4.5 dpc的LtfcreRosa26mT/mG小鼠子宫进行冰冻切片(图3A),并计数间质中EGFP+细胞个数,发现在3.5 dpc间质中EGFP+细胞个数显著降低(P<0.01)(图3B)。

A:围着床期不同时间点LtfcreRosa26mT/mG小鼠子宫冰冻切片荧光染色(20×);B:20×视野下胚胎围着床期EGFP+间质细胞计数。注:与2.5 dpc比较,**P<0.01;与3.5 dpc比较,##P<0.01。
四、LtfcreRosa26mT/mG小鼠子宫内膜间质EGFP+细胞受激素调控明显
为了探究激素水平与子宫内膜上皮EMT的相关性,我们利用LtfcreRosa26mT/mG小鼠建立了雌孕激素序贯刺激模型(图4A)。分别收集不同时间点的LtfcreRosa26mT/mG小鼠子宫内膜进行冰冻切片(图4B),计数间质中EGFP+细胞数量,结果发现E2刺激后间质中EGFP+细胞数量显著降低(P<0.05),E2刺激休息2 d后间质中EGFP+细胞数量显著增加(P<0.05),P4刺激后间质中EGFP+细胞数量又显著降低(P<0.05)(图4C)。

A:雌孕激素序贯刺激模型构建图;B:雌孕激素序贯刺激不同时间点 LtfcreRosa26mT/mG小鼠子宫冰冻切片荧光染色(20×);B:20×视野下胚胎围着床期EGFP+间质细胞计数。注:与卵巢切除术后2周比较,*P<0.05;与E2后6 h组比较,#P<0.05;与E2后休息2 d组比较,ΔP<0.05。
讨 论
在本研究中,我们构建了LtfcreRosa26mT/mG上皮特异性谱系追踪小鼠模型,首次在子宫内膜中找到了上皮细胞EMT形成的间质细胞,获得了子宫内膜EMT的直接形态学证据。并且我们发现,8周龄性成熟的LtfcreRosa26mT/mG小鼠在未交配、无胚胎存在时,子宫内膜中已经存在由上皮细胞EMT形成的间质细胞,说明EMT可能不仅仅发生在胚胎种植过程中。在围胚胎着床期,我们发现3.5 dpc的LtfcreRosa26mT/mG小鼠间质中EGFP+细胞个数显著降低,而此时胚胎进入子宫但尚未开始种植,并且母体处于雌激素水平的高峰,因此我们认为激素水平对EMT可能存在影响,进一步研究雌孕激素对EMT的作用。在雌孕激素序贯模型中,我们发现LtfcreRosa26mT/mG小鼠在E2刺激后间质中EGFP+
细胞数量显著降低,E2刺激休息2 d后间质中EGFP+细胞数量显著增加,P4刺激后间质中EGFP+细胞数量又显著降低,提示雌孕激素均能快速抑制子宫内膜EMT,而雌激素的撤退能够促进子宫内膜EMT。
EMT是一系列引起细胞从上皮表型向间质表型转化的生物过程的总称[6]。上皮细胞通常具有顶-底极性,呈多角形,底面连接基膜,细胞间连接丰富,运动迁徙能力很弱;而间质细胞一般为长梭形,具有多极性,细胞间连接较少,可以通过细胞膜形成的伪足在细胞外基质间移动,具有较强的迁移和侵袭能力,并且能够产生大量的细胞外基质[1]。根据EMT发生的场景和行使的功能,可将其分为三类[6]。I型EMT在胚胎种植、胚胎和器官发育过程中出现,过程既不产生纤维化,也没有经脉管系统的转移行为;Ⅱ型EMT在伤口愈合、组织再生、器官纤维化过程中出现,常常是损伤性修复的结果,往往伴随着炎性反应;Ⅲ型EMT发生于肿瘤细胞,导致肿瘤的侵袭和远处转移[6]。本研究聚焦I型EMT过程,即胚胎种植过程中的EMT现象。
胚胎种植是指胚胎嵌入母体子宫壁的过程,是哺乳动物妊娠的关键步骤之一[7]。在胚胎发育过程中,囊胚滋养层细胞表现出上皮的特性,包括表达E-Cadherin等上皮特征性分子、具有顶-底极性、附着于基底膜、侧壁与周围细胞较为稳定的细胞连接等[1]。而在进入子宫,与子宫内膜相互作用以完成胚胎种植的过程中,滋养层细胞逐渐失去上皮表型,细胞连接消失、顶-底极性减弱、细胞骨架重塑、迁移能力增强[8],转化为移动性、侵袭性更强的间充质表型,即发生了EMT[9]。子宫内膜上皮层作为与胚胎最先发生接触的母体部位,相应地也发生EMT过程,以适应和促进胚胎的侵入过程。EMT过程受损,将会引起胚胎种植失败[4]。EMT的时间和程度受到严格调控,过度的EMT会引起癌症,而EMT不足将引起胎儿生长受限、子痫前期等妊娠期并发症[10]。
目前大量体外实验提示了胚胎种植过程中EMT的存在,但尚缺少动物实验的结果,因此为了获得子宫内膜EMT的直接形态学证据,我们以Rosa26mT/mG小鼠为基础,通过Cre-LoxP重组酶系统建立模型小鼠,进行谱系追踪研究。Rosa26是一个位于小鼠6号染色体的非编码基因,在大部分组织和细胞中都有表达,是常用的插入外源基因表达的安全位点。Rosa26mT/mG小鼠的Rosa26基因中,插入的tdTomato(mT) 盒两侧具有 loxP 位点,其后具有终止密码子,无Cre重组酶存在时使细胞表达tdTomato红色荧光,在表达Cre重组酶的组织中敲除了mT盒及其后的终止密码子,允许位于下游的EGFP(mG) 盒表达,使细胞呈现EGFP绿色荧光,而不表达Cre重组酶的组织仍然呈现出tdTomato红色荧光。目前已有的标记上皮的Cre体系包括Wnt7a-Cre、Sprr2f-Cre和Ltf-Cre[11]。其中,Sprr2f-Cre在小鼠子宫上皮中引起的loxP重组并不均匀,仅有部分上皮细胞完成重组[12]。而Wnt7a在子宫发育过程具有重要功能,Wnt7a-Cre的重组发生在子宫完全成熟之前,不适合用于成年后生育相关的谱系追踪研究[13]。Ltf-Cre虽然存在着免疫细胞表达的问题[14],但在子宫内膜上皮细胞中重组较为均匀、稳定,且在出生后性成熟时期才开始表达,是研究子宫内膜EMT的最适重组系统[11]。因此,我们选择构建LtfcreRosa26mT/mG小鼠用于研究胚胎种植、激素作用过程中的子宫内膜上皮细胞的EMT行为。通过将LtfcreRosa26mT/mG小鼠子宫冰冻切片与E-cadherin、Vimentin、CD45共染结合激光扫描共聚焦荧光显微镜,我们成功找到了上皮细胞EMT形成的间质细胞,获得了子宫内膜EMT的直接形态学证据,对女性生殖系统的EMT研究具有重大意义。
研究表明,小鼠着床部位存在EMT相关蛋白的改变,包括N-cadherin上调、E-cadherin和细胞角蛋白下调,而假孕小鼠中未观察到这一现象,提示EMT可能仅发生在胚胎植入时[4]。然而,本研究表明,8周龄性成熟的LtfcreRosa26mT/mG小鼠在未交配、无胚胎存在时,子宫内膜已经存在由上皮细胞EMT形成的间质细胞,说明EMT可能不仅仅发生在胚胎植入时期,提示EMT可能参与子宫内膜的其他功能,需要进一步深入研究。
雌激素和孕激素是胚胎种植成功的必要因素[15]。雌孕激素可通过下调E-cadherin、上调N-cadherin和Vimentin进而诱导人子宫内膜腺癌细胞系Ishikawa细胞发生EMT,并增加人绒毛膜癌细胞系JAR球体的黏附与Ishikawa细胞的迁移能力[16]。雌激素受体β的拮抗剂PHTPP可以逆转雌二醇在EMT中的作用[17]。浓度在0.1至10 μmol/L之间的雌激素可以调节EMT相关因子和肌动蛋白的重组,并增加子宫内膜上皮细胞的迁移和侵袭性[18]。雌二醇还通过上调MALAT1和下调miR200s表达在子宫内膜上皮细胞中诱导EMT,而MALAT1缺失或miR200c过度表达可显著抑制雌二醇介导的EMT[17]。另一方面,孕酮在EMT诱导中的作用尚未得到证实[19-20]。在本研究中,我们利用LtfcreRosa26mT/mG小鼠建立了雌孕激素序贯刺激模型,发现E2刺激后间质中EGFP+细胞数量显著降低,E2刺激后休息2 d后间质中EGFP+细胞数量显著增加,P4刺激后间质中EGFP+细胞数量又显著降低,提示在体内实验中,雌孕激素均能快速抑制子宫内膜EMT,雌激素的撤退能够促进子宫内膜EMT,这与体外实验的结果矛盾,其原因可能在于动物体内细胞类型的复杂性和激素响应的延迟性,需要进一步深入研究。
鉴于EMT在成功植入中的重要性,通过药物或其他治疗手段调节EMT过程为提高辅助生殖技术的临床妊娠率提供了新的思路。一些研究表明,表皮生长因子(epidermal growth factor,EGF)和转化生长因子(transforming growth factor,TGF)可能是介导雌激素诱导EMT的中间调控分子[21],在人类早期妊娠细胞滋养层培养物中添加EGF可使这些细胞的侵袭性增加数倍。这种生长因子增强人类细胞滋养层细胞侵袭的可能机制之一是增加细胞的运动性,这是与EMT过程相关的一个特定特征[22]。此外,据报道,单侧宫内输注EGF加静脉注射EGF可增加大鼠子宫的胚胎着床数量[23]。然而,迄今为止的大部分临床研究都集中在子宫内膜容受性的标志物上,对于EMT支持和增加胚胎着床的意义关注较少。因此,开发针对EMT相关信号分子的治疗策略可能是提高临床胚胎植入率的重要研究方向。
综上所述,通过构建LtfcreRosa26mT/mG小鼠进行谱系追踪研究,我们首次在子宫内膜中找到了上皮细胞EMT形成的间质细胞,获得了子宫内膜EMT的直接形态学证据。另外,我们探究了围胚胎着床期和雌孕激素序贯刺激对LtfcreRosa26mT/mG小鼠子宫内膜中EMT的影响,发现EMT可能不仅仅发生在胚胎植入时期,EMT可能参与子宫内膜的其他功能并受到雌孕激素的严格调控,需要后续进一步深入研究。
