果树分子标记辅助育种研究进展
2024-03-20孙雨桐刘德帅姚文孔
孙雨桐, 刘德帅, 冯 美, 齐 迅, 姚文孔
(宁夏大学农学院/宁夏优势特色作物现代分子育种重点实验室/林木资源高效生产全国重点实验室,宁夏 银川 750021)
果树育种的常规手段主要有杂交育种、诱变育种、倍性育种等,但由于果树杂种比较多、品种来源复杂、多为多年生木本植物、生长周期长等因素,导致传统育种周期长、效率低、不确定因素多。相比于常规育种,分子标记辅助选择(Molecular marker assisted selection,MAS)可以提高育种效率,缩短育种周期,并且在遗传多样性、品种鉴定等方面也有较好的效果[1]。分子标记技术种类繁多,如随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD)、扩增片段长度多态性(Amplified fragment length polymorphism,AFLP)、简单序列重复(Simple sequence repeat,SSR)、单核苷酸多态性(Single nucleotide polymorphism,SNP)等,这些分子标记被广泛应用于果树的遗传育种、亲缘关系判断、遗传图谱构建以及数量性状座位(QTL)定位等研究中。这将加速果树品种的改良进程,提高育种效率。
1 果树上应用分子标记的主要类型
1.1 RAPD分子标记
为适应不良环境以及抵御病虫危害,培育具有一定抗性的果树品种至关重要。Tartarini[2]从5种不同的RAPD标记中筛选出与MdVf基因紧密相关的OPAM192200和OPAL07580,标记了苹果(Malusdomestica)抗赤霉病Vf基因。杨亚州等[3]以燕山葡萄和河岸葡萄的F1代为材料,通过7个RAPD标记对其抗旱性进行研究,将RAPD标记5226-1100转化成专一性的SCAR(Sequence characterized amplified regions,特定序列扩增)标记DR-760。其次RAPD分子标记多用于果树遗传多样性及品种鉴定,余智城等[4]对16份柑橘包括11份琯溪蜜柚进行遗传多样性分析,通过15条RAPD引物将16份材料分为2大类(表1)。

表1 随机扩增多态性DNA(RAPD)分子标记在果树上的应用
1.2 AFLP分子标记
分析果树遗传多样性,有助于果树的分类。董美超等[9]针对90份鳄梨品种材料从24对AFLP引物中筛选出8对进行遗传多样性分析,根据遗传相似系数可划分为4个类群。Lai等[10]采用AFLP和甲基化敏感扩增多态性(Methylation sensitive amplified polymorphism,MSAP)的分子标记技术探究车道晚脐橙与芽变南瓜状脐橙之间的基因和基因组甲基化差异,结果表明芽变南瓜状脐橙的出现是由于基因突变。可见AFLP结合MSAP分子标记技术可以研究橙的早熟及果实形状的基因突变,这为此方面其他果树的研究提供了理论及技术的支持(表2)。

表2 扩增片段长度多态性(AFLP)分子标记在果树上的应用
1.3 SSR分子标记
SSR标记的优点是大量标记及其共显性遗传,也正因如此SSR分子标记被广泛应用在果树育种中。王立新等[15]从144对SSR引物中筛选出3对引物对40份苹果进行检测,结果表明,这3对引物可以鉴定区分40份苹果。Kimura等[16]用9个SSR标记鉴别60个亚洲梨品种,研究结果表明其中7个SSR标记能将58个品种区分开。刘国彬等[17]以19种欧李种质及其近缘种杏李、李资源为试验材料,利用SSR标记进行品种鉴定并构建分子身份证。魏姗姗等[18]以95份桃品种为试材,利用18对SSR引物对桃进行遗传多样性分析,发现了桃品种的8个连锁群。胡光明等[19]以红阳猕猴桃为材料,从435对SSR引物中筛选出67对引物,用于猕猴桃属种质资源的亲缘关系及遗传多样性分析。Mahjbi等[20]以20个突尼斯柑橘品种为材料,通过7个SSR位点建立了它们的亲缘关系来探究其遗传多样性。此外SSR分子标记也被用于果树品质育种、抗性育种以及遗传图谱构建(表3)。

表3 简单序列重复(SSR)分子标记在果树上的应用
1.4 SRAP分子标记
相关序列扩增多态性(Sequence related amplified polymorphism,SRAP)标记与RAPD标记的原理和步骤极为相似,但SRAP相对于RAPD,稳定性高,重复性好,多态性较高。董星光[27]以黄冠和鸭梨为试材,用SRAP和AFLP标记对其抗病基因进行分析,发现与抗黑星病相关的1条SRAP标记和1条AFLP标记,可见SRAP与AFLP可联合用于梨的抗病品种的选育。冯涛等[28]以小白桃、津柳早红为试材,用12条SRAP引物对其早熟基因进行分析,结果表明SRAP标记可以用于鉴定桃成熟期芽变(表4)。

表4 相关序列扩增多态性(SRAP)分子标记在果树上的应用
1.5 SCAR分子标记
测序的扩增区段(Sequence characterized amplified region, SCAR)标记最初是从RAPD分子标记技术衍生而来的,并且重复性和特异性比RAPD更好。为减少农药对环境和人体的危害,选育抗病品种具有重要意义,SCAR分子标记在果树抗病育种方面发挥着重要的作用。祁楠等[33]以秦冠和富士F1代群体为试材,将苹果抗斑点落叶病相关基因的1个RAPD标记转换为SCAR标记(表5)。Deng等[34]以柑橘为材料克隆并测序了20个与抗柑橘三叶草病毒基因连锁的RAPD片段中的7个,并将它们转化为SCAR标记。赵伟[35]以用8种葡萄作为亲本的杂交后代为材料,用SCAR标记SCO11-914对其白粉病抗性进行检测。

表5 测序的扩增区段(SCAR)分子标记在果树上的应用
1.6 SNP分子标记
SNP检测方法主要有酶切扩增多态性序列(CAPS)、单链构象多态性(SSCP)、直接测序和基因芯片等。Baldi等[38]通过2个苹果品种Fiesta和Discovery之间杂交的分离群体开发CAPS和SSCP标记,标记其抗性基因的定位,实现了克隆序列的遗传作图。SNP多用于遗传图谱的构建。Antanaviciute等[39]使用来自28种海棠基因型的SNP数据为海棠开发了全基因组基因分型阵列。该阵列为任何给定的海棠后代提供了高通量基因分型和连锁图谱开发的前景。将2 272个SNP标记的数据整合到M432子代的图谱中,并展示了最完整和最饱和的普米拉分枝杆菌17个连锁群的图谱。唐海霞等[40]以冬枣和金丝4号的F1代103株群体为材料,用简化基因组测序技术(GBS)开发的SNP构建了1张包含12条连锁群的遗传图谱。相关研究(表6)为果树数量性状定位、功能基因挖掘以及图位克隆等研究提供了有效的理论依据。

表6 单核苷酸多态性(SNP)分子标记在果树上的应用
2 果树遗传图谱构建概况
分子标记已被广泛用于构建遗传图谱,遗传图谱是基于遗传距离的图谱,它反映的是不同基因座之间的遗传距离和连锁程度。目前,大量分子标记如SNP、SCAR、SSR、AFLP、SRAP等被用于果树遗传作图。Wu等[44]以八月红和砀山酥梨杂交的102个梨F1代单株为作图群体,用SNP与SSR整合构建了梨的高密度连锁图谱,该图谱是用快速和稳健的限制性相关DNA测序技术(RADseq)绘制的。连锁图谱由SNP标记和SSR标记组成,共3 241个标记,跨度为2 243.4 cM,平均标记距离为0.70 cM。刘更森[45]以富士和金冠杂交的F1代122个单株为作图群体,选用已开发的SNP,结合SSR标记构建了苹果遗传图谱。以杧果金黄和贵妃杂交的98株F1代植物为作图群体,用SRAP、AFLP和ISSR分子标记进行作图,该图谱由33个连锁群组成,总遗传距离为1 561.1 cM[46]。已构建遗传图谱的果树品种见表7。

表7 果树遗传图谱构建概况
3 QTL基因定位在果树育种中的应用
通常没有一种基因能唯一决定某些性状,一般一组基因作为一个整体控制着某一特性。与特定数量性状相关的基因所在的基因组区域称为QTL,即数量性状位点。自从分子标记出现以来,研究人员和育种人员一直致力于识别与这些QTL相关的功能标记,在果树的重要性状QTL定位和分子标记辅助育种等方面均取得较好的成果,如果树生长发育、果实的品质、抗逆性的强弱等。前人已对苹果、梨、柑橘等多种果树的生长发育特性(开花、生根能力、矮化等)、果实品质(质量、大小、颜色、硬度、风味等)、抗生物胁迫、抗非生物胁迫(耐盐碱、抗干旱、抗寒等)等重要农艺性状进行分析,有助于培育特定目标性状的果树品种。
3.1 与苹果相关的QTL
苹果QTL的鉴定集中于其主要农艺性状[如矮化、果实品质(包括果实质量、果实大小、果实颜色以及果肉的糖酸含量)、苹果的抗逆性(抗寒、抗旱、耐盐碱等)]。Foster等[62]对41份M93Robusta5(非矮化)与Braeburn接穗嫁接的砧木群体的QTL进行分析,结果表明,连锁群LG5上的一个主要QTL对接穗的矮化有显著影响。Zheng等[63]用来自海棠、红富士、金冠、乔纳森家系9 422株苹果F1代杂交种为试材,检测得到9个与苹果果皮颜色遗传变异有关的微效QTL(表8)。孙瑞[64]以红玉、金冠以及红玉和金冠的F1代杂交群体297株苹果为试材,对其品质性状进行QTL定位,共得到12个QTL位点。
3.2 与梨相关的QTL
迄今,QTL定位在梨的研究上取得了一定的成果。赵亚楠[65]利用苹果梨和八月红150株F1代材料对14个果实品质性状进行基因定位分析,共获得28个QTL位点,其中与单果质量相关的QTL位点有5个、与果心大小相关的QTL位点有2个、与果肉硬度相关的QTL位点有3个、与果实横径相关的QTL位点有6个、与果梗长度相关的QTL位点有1个、与可溶性固形物含量相关的QTL位点有6个、与可滴定酸含量相关的QTL位点有2个,共扫描到2 266个基因。Sun等[66]以131个亚洲梨和欧洲梨为试验材料,在已被鉴定的病害相关QTL区域中找到41个核苷酸结合位点(NBS)编码基因(表9)。
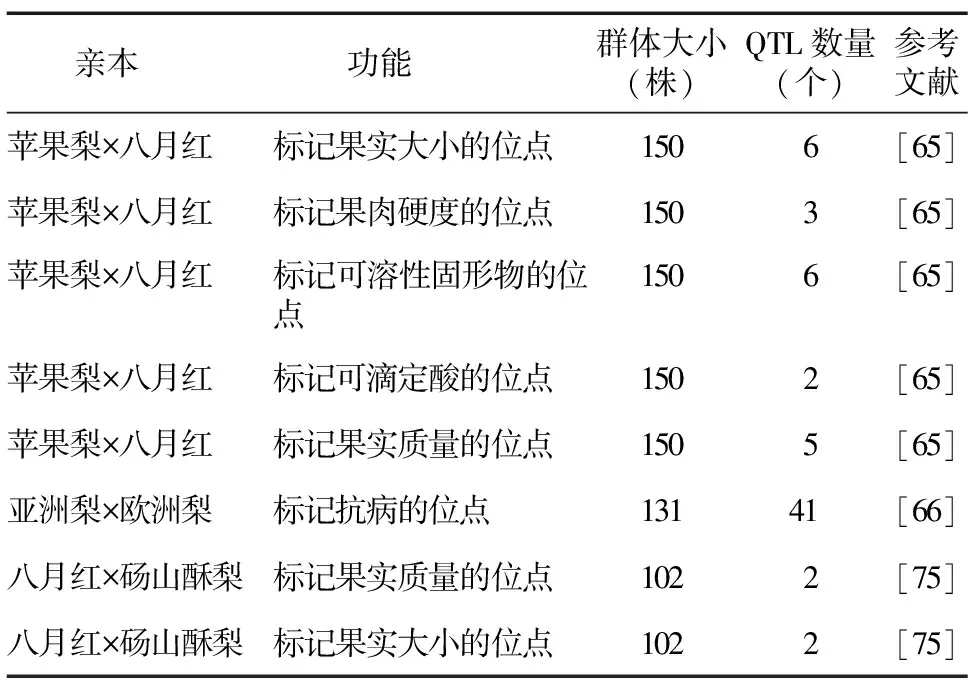
表9 梨相关的数量性状座位(QTL)
3.3 与柑橘相关的QTL
通过分子标记构建柑橘的遗传连锁图谱可以获得果实发育等农艺性状和应答逆境胁迫的QTL。罗艾等[72]以晚蜜2号和梨橙2号的94株F1代材料为群体,进行QTL定位分析,发现4个与果实质量相关的QTL定位,7个与果实大小相关的QTL定位。马喜军[73]以晚蜜2号和梨橙2号的350株F1代为试验材料对柑橘抗寒性相关的QTL进行定位,得到7个与柑橘抗寒性相关的QTL,分布于4个连锁群上,分别为LW1、LW2、LW3和LW8。Huang等[74]对甜橙×枳橙属间杂交的170株F1代进行基因分型分析,在枳遗传图谱上鉴定到4个与柑橘黄龙病相关的QTL(表10)。
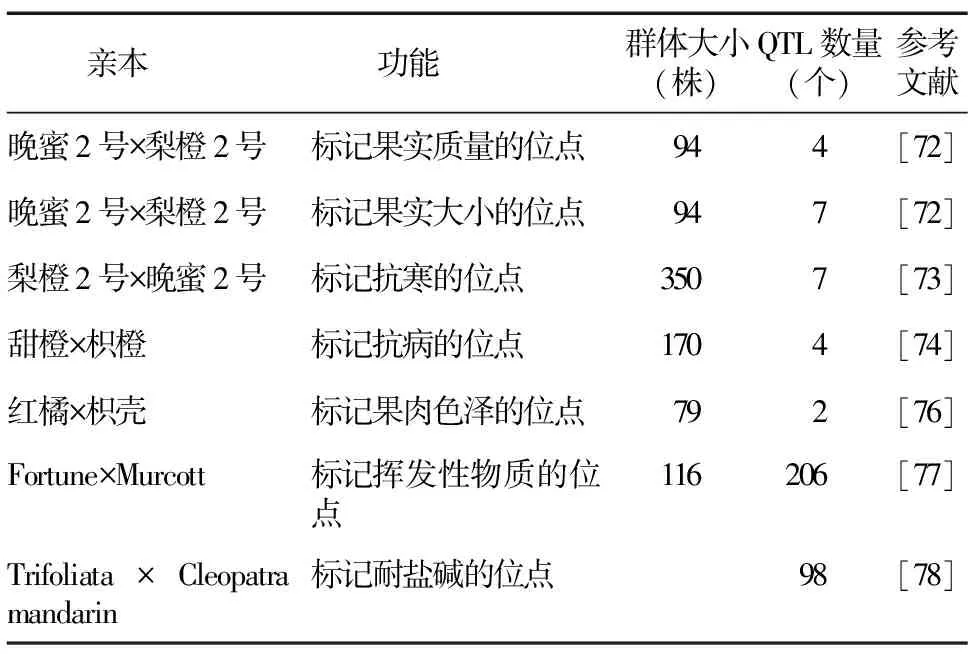
表10 柑橘相关的数量性状座位(QTL)
3.4 与其他果树相关的QTL
除常见果树外,其他果树重要性状相关的QTL定位研究也取得了很大进展。Cirilli等[79]评估133份桃种质,定位到1个可以推迟桃花期的QTL。鲍荆凯[80]用JMS2和交城5号枣的150株F1代材料对其QTL定位进行分析,共获得104个QTL位点,其中与果实大小相关的QTL位点57个、与果实糖组分相关的QTL位点17个、与果实酸组分相关的QTL位点30个。刘春燕[81]以桂海4号和山梨猕猴桃的杂交后代开展QTL定位研究,共检测到44个QTL位点,其中与果实质量相关的QTL位点7个,与果实横纵径相关的QTL位点21个。史晓畅[82]以山东大绵球和新宾软籽山楂的130株杂交F1代为材料,检测到2个与单果质量相关的QTL位点,6个与果皮穿刺硬度相关的QTL位点,3个与果实大小相关的QTL位点,5个与果皮脆性相关的QTL位点,5个与果肉平均硬度相关的QTL位点。这些研究(表11)不仅丰富了果树的遗传学研究,也为果实品质及果树抗逆的遗传机制和育种研究提供了理论基础。
4 展 望
在果树的品种鉴定、辅助育种(早熟、无核、矮化、品质以及抗性等)、遗传图谱的构建和农艺性状基因定位等方面,DNA分子标记被广泛应用。DNA分子标记技术种类多样,大致可分为三类。第一类:以电泳技术和分子杂交技术为核心的分子标记技术,如RFLP;第二类:以DNA聚合酶链式反应(Polymerase chain reaction,PCR)为基础的分子标记技术,包括RAPD、SSR、SCAR等;第三类:以DNA测序为核心的分子标记技术,如SNP标记[83]。RFLP具有共显性且不需要先验序列信息,但它耗时长,需要大量纯DNA,价格也比较昂贵[84]。RAPD操作简单,所需DNA量少,多态显性,但需要高度纯化的DNA并且再现性低。DNA的数量和质量、PCR缓冲液、氯化镁浓度、退火温度和TaqDNA聚合酶是影响RAPD标记再现性的一些重要因素[85]。AFLP标记将RFLP和PCR技术结合在一起,先对DNA进行消化,然后进行PCR。AFLP标记物具有低成本,并且不需要先前的序列信息。在AFLP中,既可以使用高质量的DNA,也可以使用部分降解的DNA,但是,该DNA不能含有任何限制性内切酶或PCR抑制剂[86]。相较于RFLP、RAPD、AFLP等分子标记,SSR标记具有多态性检出率高、基因组中分布广泛、结果稳定可靠等特点,是检测品种真实性、分析品种间遗传差异以及鉴定纯度的理想标记[87]。SNP可以提供最简单和最大数量的标记。SNP在植物和动物中大量存在[88-91],植物中的SNP频率为每100~300 bp中有1个SNP。SNP成本低,在基因组中广泛分布,无需先验序列信息,再现性高,共显性标记,但其开发成本较高。人们基于不同的等位基因识别技术和检测平台已经开发了大量的SNP基因分型方法,其中,RLFP(SNP-RFLP)是最简单的方法,CAPS标记技术也可以应用于SNP检测[92]。分子标记种类繁多,功能优势也有所不同,根据试验的目的选择合适的分子标记有助于解决具体问题。
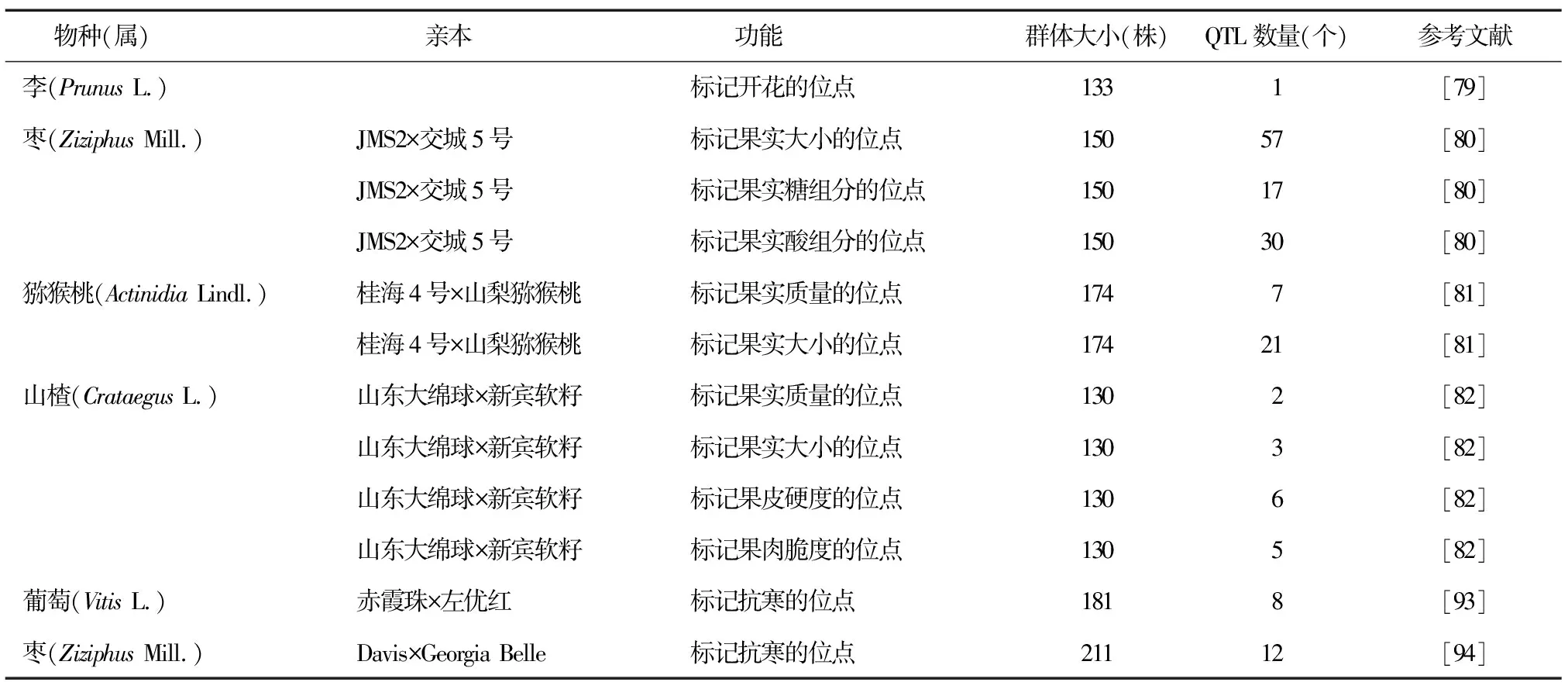
表11 与其他果树相关的数量性状座位(QTL)
为同时提高育种效率、缩短育种周期,寻找与农艺性状密切相关的分子标记至关重要。分子标记辅助育种(MAS)的优势可以体现在以下3个方面。一、允许提前选择。在育种中,有些性状需要特定的生长环境和一定的生长周期。二、同一性状利用多个等位基因。在不同的育种材料中,可能存在多个基因影响同一性状(如抗病性和品质),利用表型很难识别这些等位基因。三、允许同时选择多个性状。所选单株或品系不仅要在单株抗病、品质、产量等方面表现良好,综合性状也要相对较好。因此,有必要对育种的种群中每个目标性状逐一进行识别和筛选。以往的研究大多将目的基因的分子标记与育种工作分离,不能很好地应用于实际。今后分子标记技术的发展将与传统育种相结合,使其尽快为育种工作服务。这有助于提高果树作物育种效率,加快育种发展进程。
