包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的制备及佐剂活性
2024-03-20侯立婷乔绪稳杜露平于晓明张元鹏郑其升
秦 竹, 陈 瑾, 侯立婷, 乔绪稳, 李 兰, 杨 利, 杜露平, 于晓明, 张元鹏, 郑其升
(1.江苏省农业科学院动物免疫工程研究所/国家兽用生物制品工程技术研究中心/江苏省食品质量与安全重点实验室,江苏 南京 210014; 2.兽用生物制品国泰技术创新中心,江苏 泰州 225300)
重组CTA1-DD蛋白是由霍乱毒素(Cholera toxin,CT)的A1亚基(CTA1)与金黄色葡萄球菌蛋白A的二聚体(D-dimer,DD)相连组成,其佐剂效应于1997年被首次报道。随后,CTA1-DD被广泛应用于人类免疫缺陷病毒(HIV)、人乳头瘤病毒(HPV)、埃博拉病毒(EBOV)、甲型H1N1流感病毒和轮状病毒小颗粒等疫苗产品中,显著增强了疫苗的免疫保护效力,验证了其佐剂功效[1-5]。研究结果表明,CTA1-DD融合蛋白具有与完整CT分子相当的全身性和黏膜佐剂功能,大大提升了机体对与其联合免疫的特异性抗原的免疫应答水平[6-7],是一种具有前途的蛋白类佐剂。但是,CTA1-DD蛋白在复杂的生理环境中通常容易被酶或者酸降解,生物利用率不高,因此在生产应用中受到很大的限制。
为了解决上述问题,本研究利用载体材料将CTA1-DD蛋白包裹成纳米颗粒进行体内递送,以保护CTA1-DD蛋白在生理环境中不易被快速降解,能够高效到达靶标组织和细胞,发挥佐剂作用。本研究以同样具有佐剂活性的多糖(壳聚糖和葡聚糖)衍生物[8-9]为载体材料。壳聚糖是自然界中广泛存在的甲壳素的脱乙酰产物,分子表面的伯胺基质子化后带正电,具有良好的生物相容性和生物可降解性[10-11],亦可作为佐剂增强疫苗的体液免疫和细胞免疫应答[12-13]。由于壳聚糖在生理pH下的溶解性较差,研究者常常将壳聚糖通过离子交联、乳液交联、自组装等方法制备成纳米颗粒使用[14]。研究结果表明,壳聚糖纳米颗粒可诱导炎性细胞因子IL-1β、TNF-α、MCP-1、MIP-1α的释放,并促进CD4+和CD8+T细胞的增殖[15-17]。Günbeyaz等[18]将壳聚糖纳米颗粒用于牛疱疹病毒疫苗的黏膜递送,提高了细胞免疫水平。Zhao等[19]将新城疫病毒疫苗用壳聚糖纳米粒包裹,通过黏膜途径免疫鸡,提升了疫苗的缓释性、安全性及有效性。葡聚糖的免疫活性调节作用主要与巨噬细胞相关[20]。葡聚糖分子上含有大量羟基,链间氢键可形成稳定的三级结构,与巨噬细胞表面 Dectin-1和Toll样受体结合,增强其吞噬活性,并诱导机体炎性细胞因子的释放,从而间接激活B细胞和T细胞,增强免疫应答[21-22]。
本研究采用葡聚糖的硫酸盐衍生物和实验室前期合成的壳聚糖衍生物——O-羧甲基壳聚糖,通过离子交联法制备包裹有CTA1-DD蛋白的纳米颗粒。研究纳米颗粒的制备工艺对颗粒基本性能的影响,包裹有CTA1-DD蛋白纳米颗粒的包封率和载药率,并进一步探讨包裹有CTA1-DD蛋白纳米颗粒的体液免疫和黏膜免疫水平。
1 材料与方法
1.1 试验材料
霍乱毒素基因融合蛋白CTA1-DD和O-羧甲基壳聚糖(相对分子质量3×104)均为本实验室自制,硫酸葡聚糖(相对分子质量5×105)购自索莱宝公司,3,3,5,5-四甲基联苯胺(TMB)购于博士德公司,其余试剂均购于国药集团。健康BALB/c雌性小鼠(5周龄)购于扬州大学实验动物中心。
1.2 O-羧甲基壳聚糖-硫酸葡聚糖(OCS-DS)纳米颗粒的制备
分别配制2 mg/ml的O-羧甲基壳聚糖(OCS)和硫酸葡聚糖(DS)溶液,加入NaCl调节其离子强度为0.1 mol/L,0.22 μm滤膜过滤。分别以2 ml的OCS或DS为底液,在高速搅拌条件下,采用注射泵以20 ml/h的流速加入不同体积的反向电荷溶液,再继续搅拌10 min,静置6 h后,将样品倒入离心管中,10 000 r/min离心20 min,弃上清,再用去离子水分散、离心2次,冷冻干燥,4 ℃保存待用。
1.3 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒制备
将CTA1-DD蛋白以不同终质量浓度加入2 mg/ml的DS溶液中,搅拌溶解,取2 ml为底液。在高速搅拌的条件下,采用注射泵以20 ml/h的流速加入不同体积的OCS溶液(2 mg/ml),再继续搅拌10 min,静置6 h后,将样品倒入离心管中,10 000 r/min离心20 min,弃上清,再用去离子水分散、离心2次,冷冻干燥,4 ℃保存待用。
1.4 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的基本性能表征
利用Zetasizer Nano ZS测定单一OCS-DS纳米颗粒及包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的水合粒径和Zeta电位,利用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观测样品的本体粒径和外观形态。
1.5 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的载药量和包封率评价
将包裹有CTA1-DD蛋白的OCS-DS纳米颗粒和单一OCS-DS纳米颗粒在37 ℃条件下分别搅拌至完全溶解,得到确定纳米颗粒质量浓度的澄清溶液。溶液中CTA1-DD蛋白的质量浓度通过BCA试剂盒在570 nm波长下测定吸光度,进一步计算求得。单一纳米颗粒溶解液的吸光度值作为空白对照值。OCS-DS纳米颗粒对蛋白CTA1-DD的载药量(DL)和包封率(EE)计算公式分别如下:
DL=(W/Wn)×100%;
EE=(W/W0)×100%。
式中,W:包裹有CTA1-DD蛋白的OCS-DS纳米颗粒中CTA1-DD蛋白的质量;Wn:包裹有CTA1-DD蛋白的OCS-DS纳米颗粒中OCS-DS的质量;W0:在包裹有CTA1-DD蛋白的OCS-DS纳米颗粒制备时CTA1-DD蛋白的投入质量。
1.6 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的CTA1-DD蛋白释放特性评价
将一定质量的包裹有CTA1-DD蛋白的OCS-DS纳米颗粒和单一OCS-DS纳米颗粒分别分散于pH 7.4的PBS缓冲溶液中,在37 ℃的摇床中以54 r/min的速率恒温振荡。在不同时间点,各取1 ml振荡中的PBS溶液,同时补充1 ml新鲜PBS溶液。取出的PBS溶液在4 ℃条件下10 000 r/min离心20 min。取上清液,通过BCA试剂盒测定CTA1-DD蛋白质量浓度,绘制释放曲线。每个时间点取3个平行样进行测定,以单一OCS-DS纳米颗粒的释放情况作为对照。
1.7 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的佐剂活性评价
以猪伪狂犬病毒(PRV)灭活抗原为模式抗原,与包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的PBS溶液直接混合制备PRV疫苗,并设置不同对照组。将健康BALB/c雌性小鼠按表1随机分组,每组8只。PRV疫苗以液滴形式直接涂抹在小鼠的双鼻孔上,疫苗用量为1只20 μl。首次免疫后21 d,所有小鼠均以相同方式增强免疫1次。首次免疫后42 d,眼眶采血分离血清,并将小鼠处死后收集支气管肺泡灌洗液,用ELISA法检测特异性IgG和IgA抗体水平。ELISA检测法的具体步骤如下:将96孔白板用PRV抗原包被,每孔5 μg,4 ℃孵育过夜,再用含5% BSA的DPBS(每孔100 μl)37 ℃条件下封闭1 h,洗涤,晾干。每孔加入100 μl稀释后的待测血清(稀释度:1∶100~1∶12 800)或肺泡灌洗液(稀释度:1∶20~1∶2 560),37 ℃孵育1.5 h。洗涤5次后,分别加入100 μl的HRP偶联的山羊抗小鼠IgG抗体(血清样品检测孔)或IgA抗体(肺泡灌洗液检测孔)孵育1 h。洗涤5次,加入100 μl TMB室温下孵育显色,15 min后,以2 mol/L的H2SO4(50 μl)终止酶底物反应,检测450 nm波长下的吸光度值(OD450),判定IgG和IgA抗体滴度。

表1 免疫分组
2 结果与分析
2.1 制备参数对羧甲基壳聚糖-硫酸葡聚糖(OCS-DS)纳米颗粒的影响
以O-羧甲基壳聚糖(OCS)为聚阳离子,硫酸葡聚糖(DS)为聚阴离子,二者碰撞过程中可通过离子交联形成凝胶纳米颗粒。由于OCS与DS各自所带电性的强弱程度不同,因此阴阳离子的碰撞过程中,哪方为过量底物,哪方为渐进增加的成分,二者最终比例都决定了颗粒的结合紧密程度(体现为颗粒粒径)和颗粒表面的电荷强度(体现为Zeta电位)。此外,颗粒的粒径还与反向电荷的加入速率、二者结合时的搅拌速率密切相关。
本研究通过前期预备试验,确定了OCS和DS溶液的质量浓度均为2 mg/ml,反向电荷溶液的加入流速为20 ml/h。重点研究OCS、DS分别为底物时,反向电荷溶液加入比例和二者混合速率这两个关键因素对纳米颗粒形成的影响。
由表2可以看出,以聚阴离子DS为底物时,形成的OCS-DS纳米颗粒粒径大部分在250 nm以下,始终保持负电性。随着反向电荷OCS溶液加入量的增加,颗粒粒径呈先减少再逐渐增加的趋势。当反向电荷OCS溶液加入量达到一定值(约1.2 ml左右)时,由于Zeta电位的负电性显著降低,颗粒间排斥力减少,颗粒粒径显著增大,且很快絮凝沉降。随着颗粒形成时搅拌速率的增加,OCS-DS纳米颗粒的粒径先降低,再趋于一致。颗粒粒径变化进入平台期,表明该因素对颗粒粒径的影响力饱和。
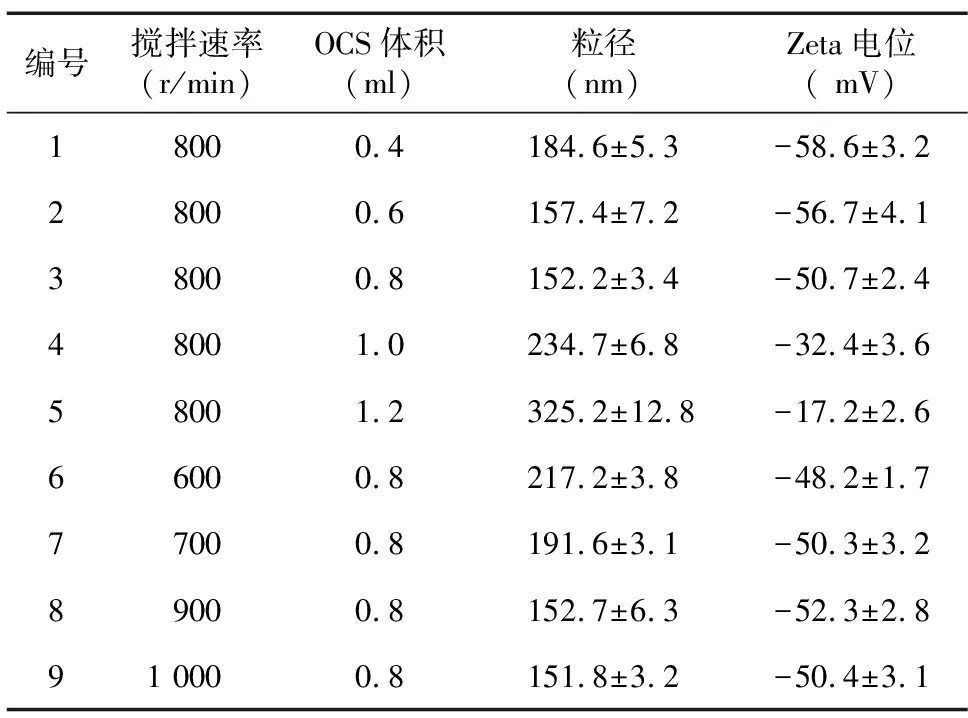
表2 2 ml硫酸葡聚糖(DS)为底物时O-羧甲基壳聚糖-硫酸葡聚糖(OCS-DS)纳米颗粒的粒径与Zeta电位
分析表3结果可知,以聚阳离子OCS为底物时,OCS-DS纳米颗粒粒径大部分在250 nm以上,呈弱正电性。随着反向电荷DS溶液加入量的增加,颗粒表面正电性越来越弱,粒径也随之增加。当二者混合时搅拌速率提高,粒径略有下降。
综合表2和表3的颗粒参数来看,以DS为底物制备的OCS-DS纳米颗粒,其Zeta电位的绝对值大部分在30以上,表明溶液中颗粒间的排斥力较强,不易团聚。而以OCS为底物制备的颗粒粒径偏大,Zeta电位绝对值在20左右,稳定性也较差。因此,本研究选择DS为底物,反向电荷溶液OCS加入量为0.8 ml,搅拌速度800 r/min的制备条件开展后续CTA1-DD蛋白的包裹研究。
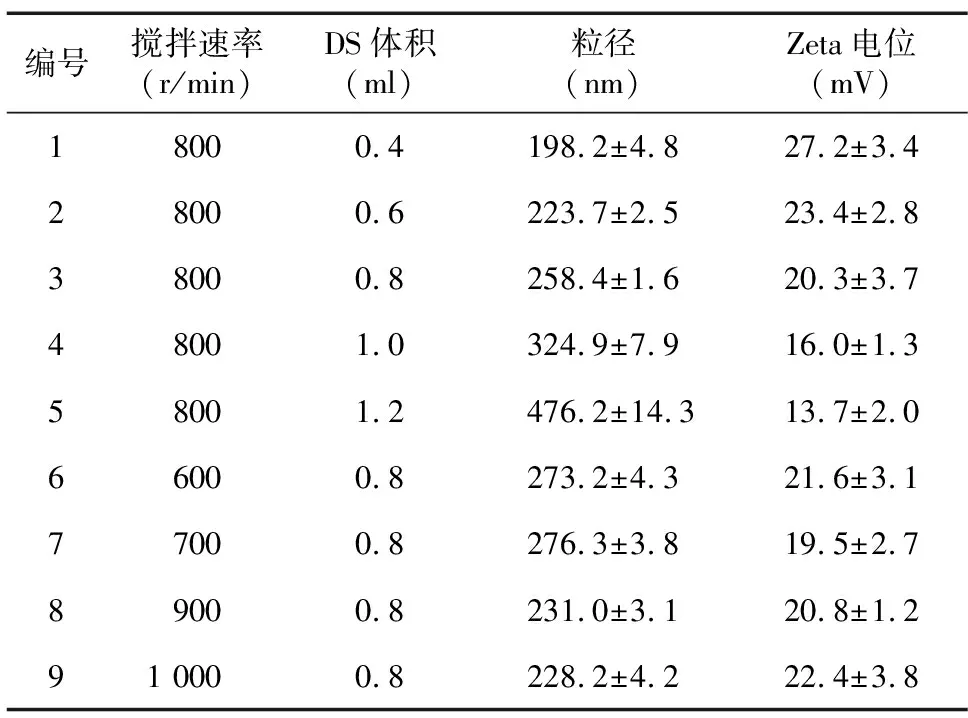
表3 2 ml O-羧甲基壳聚糖(OCS)为底物时O-羧甲基壳聚糖-硫酸葡聚糖(OCS-DS)纳米颗粒的粒径与Zeta电位
2.2 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的粒径与电位表征
由于制备的CTA1-DD蛋白整体呈偏弱的负电性,因此将CTA1-DD蛋白加入到聚阴离子DS的溶液中,在CTA1-DD蛋白投入质量浓度分别为0.5 mg/ml、1.0 mg/ml、1.5 mg/ml、2.0 mg/ml、2.5 mg/ml时制备纳米颗粒。制备过程中其他固定参数为:底物为2 ml含不同质量浓度CTA1-DD蛋白的DS溶液(2 mg/ml),注入液为0.8 ml的OCS溶液(2 mg/ml),注入液流速20 ml/h,搅拌速率800 r/min。
由图1可知,当投入的CTA1-DD蛋白质量浓度≤1.0 mg/ml时,包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的粒径和Zeta电位变化不大。随着投入的CTA1-DD蛋白质量浓度的上升,包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的粒径显示出增加的趋势,估计是过量的蛋白质未能被充分包裹;而表面电位仅略微下降,表明颗粒表面仍是强烈负电性的葡聚糖硫酸根占主导,弱负电性的CTA1-DD蛋白仅起到辅助作用。
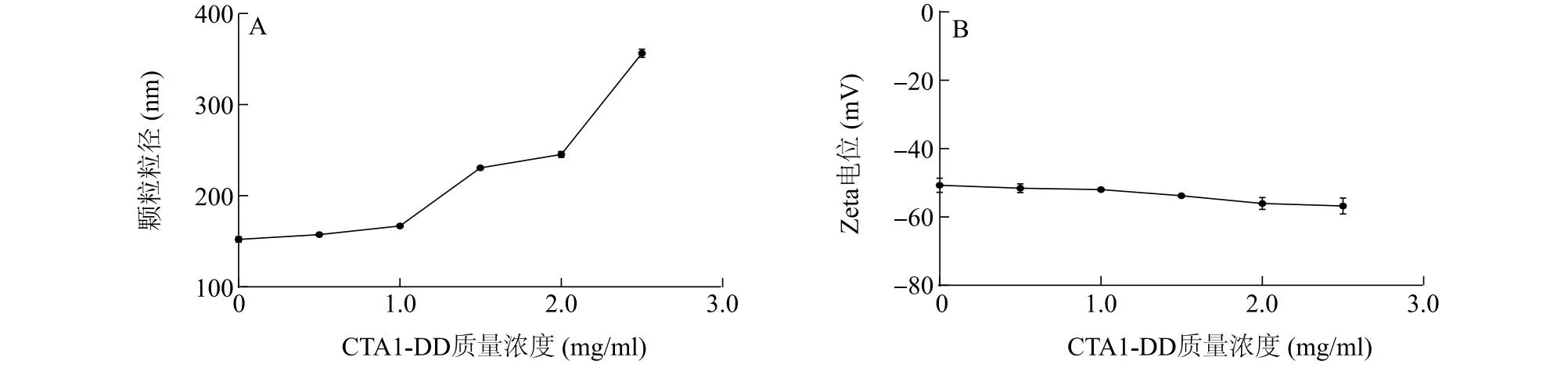
图1 投入不同质量浓度CTA1-DD蛋白的OCS-DS纳米颗粒表征
包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的微观外观如图2所示,颗粒呈球体,稳定性良好,粒径为50~150 nm,较之水溶液中测试的粒径值要小,这是由于OCS-DS纳米颗粒在水溶液中的水合半径较大,而电镜观察到的是干燥的本体颗粒。

A:扫描电子显微镜结果;B:透射电子显微镜结果。
2.3 包裹有CTA1-DD蛋白的纳米颗粒的载药率和包封率
图3显示了投入的CTA1-DD蛋白质量浓度分别为0.5 mg/ml、1.0 mg/ml、1.5 mg/ml、2.0 mg/ml、2.5 mg/ml时,制备得到的包裹有CTA1-DD蛋白的OCS-DS纳米颗粒有效包封蛋白的能力。由于OCS和DS在发生离子交联的凝胶化反应时,具有一定负电性的CTA1-DD蛋白也会通过离子作用或随机碰撞效应嵌入其中。由图3可知,当CTA1-DD的质量浓度从0.5 mg/ml提高到2.0 mg/ml时,其在OCS-DS纳米颗粒上的载药率也逐渐增加。但是随着CTA1-DD蛋白质量浓度的增加,则会在纳米颗粒形成过程中影响其结合的紧密程度,致使粒径增大,载药率反而下降。从包封率来看,CTA1-DD蛋白投入质量浓度为0.5~1.0 mg/ml时,CTA1-DD蛋白的包封率均在80%以上。CTA1-DD蛋白质量浓度进一步增加,载药率仅小幅提升,但包封率显著下降。表明大部分CTA1-DD蛋白在溶液中过剩,因此包封率显著下降。
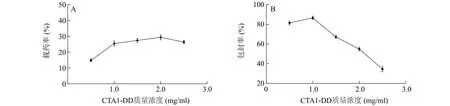
图3 投入不同质量浓度CTA1-DD蛋白的OCS-DS纳米颗粒蛋白包封能力
2.4 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的CTA1-DD蛋白体外释放特性
依据试验结果,本研究优选质量浓度1.0 mg/ml的CTA1-DD蛋白投入制备包裹有CTA1-DD蛋白的OCS-DS纳米颗粒,进行CTA1-DD蛋白体外释放特性的评价。制备过程中其他固定参数条件不变。包裹有CTA1-DD蛋白的OCS-DS纳米颗粒在生理pH下的体外释放过程如图4所示。纳米颗粒在1 d以内有突然释放效应,释放约一半的CTA1-DD蛋白。然后在1 d以后释放速率逐渐变缓即为缓释过程。第7 d时,预计纳米颗粒已基本被水溶液渗透崩解,CTA1-DD蛋白完全释放。
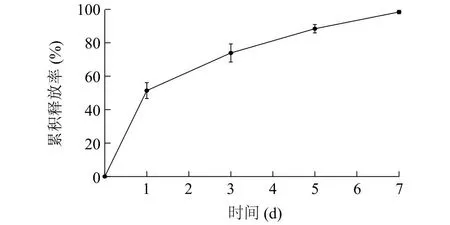
图4 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的CTA1-DD蛋白体外释放曲线
2.5 包裹有CTA1-DD蛋白的OCS-DS纳米颗粒的佐剂活性
为了验证CTA1-DD蛋白被OCS-DS纳米颗粒包裹后的佐剂活性,将包裹有CTA1-DD蛋白的OCS-DS纳米颗粒与PRV灭活抗原混合后,滴入小鼠鼻腔,并分别设PBS阴性对照、PRV抗原对照及CTA1-DD蛋白对照。首次免疫后42 d,收集血清和肺泡灌洗液,分别检测代表体液免疫的IgG抗体水平和黏膜免疫的IgA抗体水平。ELISA检测结果如图5所示,包裹有CTA1-DD蛋白的OCS-DS纳米颗粒能够同时诱导更高的血清IgG抗体和黏膜IgA抗体表达。
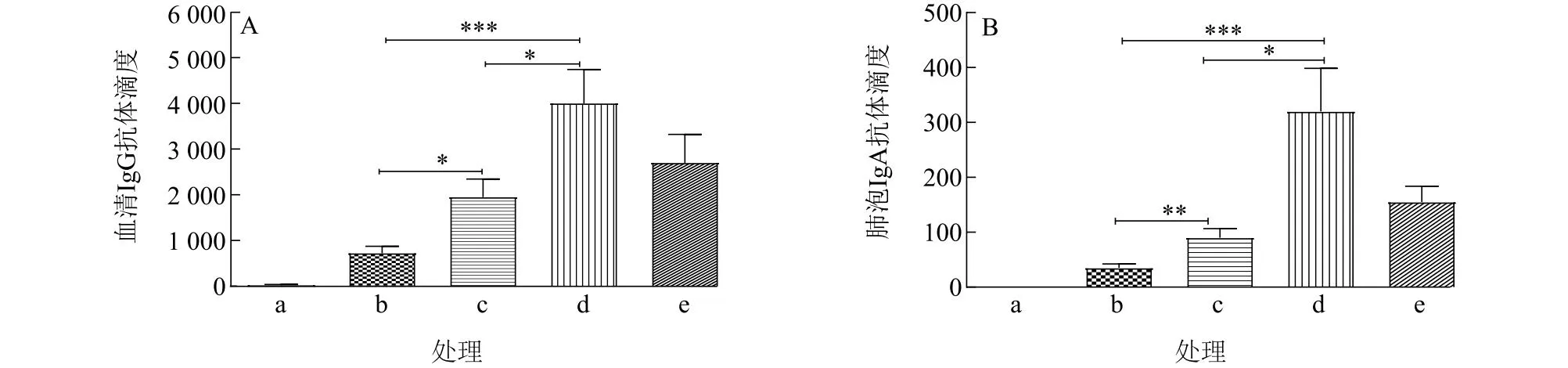
a:PBS;b:PRV;c:PRV+CTA1-DD蛋白(5 μg);d:PRV+包裹有CTA1-DD蛋白(5 μg)的OCS-DS纳米颗粒;e:PRV+包裹有CTA1-DD蛋白(1 μg)的OCS-DS纳米颗粒。*表示差异显著(P<0.05);**表示差异极显著(P<0.01);***表示差异极显著(P<0.001)。
3 讨 论
霍乱毒素和与其密切相关的大肠杆菌不耐热毒素是目前发现的最强大、研究最充分的黏膜佐剂,但由于其具有神经毒性,开发和利用受到限制[23]。经由霍乱毒素A1亚基重组开发的CTA1-DD蛋白规避了神经毒性,并且具有与完整霍乱毒素分子相当的全身和黏膜佐剂功能。但是,在前期的应用中发现,CTA1-DD蛋白在复杂的生理环境中容易被酶或者酸降解,生物利用率不高。为了能够更好利用CTA1-DD蛋白,让其在体内能够尽量多的进入免疫细胞,最大程度发挥其佐剂效应,本研究采取了将其制备成纳米颗粒这一策略。
基于CTA1-DD蛋白独特的黏膜佐剂潜在优势,本研究选择了同样具有黏膜佐剂效应的壳聚糖衍生物为载体材料之一。研究结果表明,无论是壳聚糖分子亦或壳聚糖纳米颗粒都在黏膜途径的疫苗给药后发挥了显著的免疫增强作用[12-13,18-19]。然而,壳聚糖仅在强酸性条件下可溶,制备成纳米颗粒后一般pH值也偏酸性,预计将限制其在部分抗原上的应用。本研究将壳聚糖6位亚甲基上的羟基选择性羧甲基化,制得了在广泛pH下水溶性良好的O-羧甲基壳聚糖,并保留了正电性的伯氨基未被羧甲基化,维持了其阳离子多糖的性能[24]。硫酸葡聚糖是本研究选择的另一载体材料。葡聚糖通过激活巨噬细胞表面Dectin-1和Toll样受体,也具备一定的免疫调节功能。而葡聚糖的硫酸化,不但解决了其高分子结构水溶性差的问题,也赋予了葡聚糖表面强烈的负电性。本研究通过正电性的O-羧甲基壳聚糖与负电性的硫酸葡聚糖相互吸引,瞬间交联形成纳米颗粒,制备方法简单,反应时间短,避免了活性物质因反应时间长或反应条件苛刻而导致的失活。而且制备过程中是在水溶液中进行,除了盐离子外,没有添加其他试剂,无毒无害。
本研究筛选了OCS-DS纳米颗粒的制备条件,发现以DS为过量底物时,OCS滴加到DS溶液中可以形成比较稳定(Zeta电位绝对值>30)的纳米颗粒。随后又通过细化条件的试验,确定了包裹CTA1-DD蛋白的制备条件。由于CTA1-DD为弱负电性,所以在制备时与DS溶解在同一水相中,在高剪切力作用下,随着OCS的滴入,CTA1-DD蛋白随机嵌入在OCS与DS交联形成的紧密凝胶三维结构中,理论上应当部分被完全包裹在凝胶内部,部分位于凝胶表面共同维持其结构稳定。
由于CTA1-DD蛋白的二聚体(DD)部分具有一定的B细胞靶向性,而B细胞的激活程度与体液免疫水平直接相关,如果蛋白质完全被包裹在纳米颗粒中,则将丧失其靶向作用。本研究将CTA1-DD蛋白纳米颗粒与PRV抗原混合制备疫苗,通过鼻腔黏膜途径免疫小鼠。结果表明,无论是表征全身性体液免疫的IgG抗体还是体现黏膜免疫的IgA抗体,包裹有CTA1-DD蛋白的OCS-DS纳米颗粒在相同剂量下都能诱导显著高于CTA1-DD蛋白诱导的抗体水平,直接说明纳米颗粒化的CTA1-DD蛋白生物利用率更高,佐剂效应更强,同时也间接表明蛋白质的DD部分应该部分展示在纳米颗粒表面,仍具有一定的B细胞靶向性。
与传统免疫途径相比,黏膜免疫具有免针、降低交叉污染风险等诸多优势,适当配方的黏膜疫苗可以激活包括分泌性IgA、血清IgG中和抗体及细胞介导的免疫应答在内的任何类型的免疫反应,对易引起黏膜感染或通过黏膜侵入的病原体尤有吸引力[25]。因此,黏膜佐剂的研究对于非活性黏膜疫苗的开发具有重要意义[26]。本研究制备的包裹有CTA1-DD蛋白的OCS-DS纳米颗粒在初步的小鼠免疫试验中展现出了高效黏膜佐剂的潜力,后续将进一步明确CTA1-DD蛋白在纳米颗粒内部的分布规律,探究CTA1-DD蛋白与纳米颗粒互作下的免疫增强内在机制。
