结球甘蓝CBF家族特征分析及低温诱导基因BoCBF1、BoCBF2a和BoCBF3表达分析
2024-03-20余方伟李建斌王神云
张 伟, 余方伟, 李建斌, 于 利, 王神云
(江苏省农业科学院蔬菜研究所/江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
结球甘蓝(Brassicaoleraceavar.capitataL.),是十字花科芸薹属蔬菜,可形成叶球,含有丰富的维生素C和矿物质,营养极为丰富。甘蓝常被烹食或者生食,是追求健康饮食人群喜爱的食物之一;由于其具有较强的适应性和抗逆性,全国各地均有种植,年种植面积约9×105hm2[1],是中国重要的保障供应蔬菜之一。
低温是影响作物产量和营养品质的一种非生物胁迫[2]。结球甘蓝喜温和冷凉气候,种子发芽适宜温度为20~25 ℃,结球期适宜温度为15~20 ℃。结球甘蓝的适应能力较强,但过低的温度仍然会减缓其生长速度,降低营养品质;特别是在1~4 ℃低温条件下,植株很容易通过春化作用发生“先期抽薹”[3];0 ℃以下的冻害温度会导致幼苗或叶球冻伤或是直接冻死,严重影响产量[4-5]。结球甘蓝植株不同生长时期的耐寒性也不同,具有6~8片叶的幼苗其耐寒性比较强,能忍耐-5~-2 ℃的低温冻害;经过低温驯化的幼苗,能忍耐短期-12~-8 ℃的低温严寒;成熟期的叶球耐寒性虽不如幼苗时期,但早熟品种的叶球能忍耐短期-5~-3 ℃的低温,中、晚熟品种的叶球能忍耐短期-8~-5 ℃的低温[6]。
低温信号途径是依赖于CBF(C-repeat binding factor)转录因子的ICE1-CBF-COR信号转导途径。在低温胁迫下,ICE1转录因子可直接与3个低温响应基因(CBF1、CBF2、CBF3)基因启动子区域结合[7],被激活的CBF转录因子与冷诱导基因(COR)启动子区域CRT/DRE元件结合,诱导COR基因的转录,使其迅速响应低温胁迫,从而提高植株的耐冷性[8]。AtCBF1、AtCBF2和AtCBF3基因在拟南芥4号染色体上串联排列,不依赖ABA信号转导,受低温胁迫诱导表达,在响应低温胁迫的基因调控中发挥重要作用[9-10]。而AtCBF4与AtCBF1、AtCBF2、AtCBF3成员的基因功能不同,依赖ABA信号转导,不受低温胁迫诱导表达,但在抗旱过程中发挥一定的作用[11]。有研究结果表明过量表达AtCBF1、AtCBF2和AtCBF3基因能大幅提高拟南芥植株的抗冻性,其下游大量的COR基因被诱导表达[9-10]。与野生型拟南芥相比,cbf1/cbf2/cbf3 3突变体在冷驯化后表现出强烈的冻敏感表型,且AtCBF基因的突变影响了拟南芥全转录组中10%~20%的COR基因表达[12-13]。此外,在油菜、番茄、大麦、玉米及水稻等作物中也发现CBF基因具有冷诱导表达特征[14-18]。单子叶植物和双子叶植物的CBF基因均与低温胁迫响应密切相关,说明植物中CBF基因在低温信号途径中发挥的作用相对保守。
本研究为了探索与拟南芥同为十字花科的结球甘蓝作物中CBF基因是否也存在冷诱导特性,对结球甘蓝全基因组中CBF家族成员进行鉴定,并分析其编码的蛋白特征、基因结构、系统发育、不同器官/组织表达量以及2 ℃低温胁迫下的基因表达模式等,挑选出候选低温诱导基因,为进一步开展BoCBF基因响应低温胁迫的研究提供参考。
1 材料与方法
1.1 结球甘蓝CBF家族成员鉴定
拟南芥AtCBF蛋白氨基酸序列(AtCBF1-AT4G25490、AtCBF2-AT4G25470、AtCBF3-AT4G25480、AtCBF4-AT5G51990)从NCBI数据库获取。结球甘蓝和大白菜全基因组序列分别参考结球甘蓝923[19]和大白菜Chiifu-401-42 V3.0[20]基因组。将AtCBF蛋白氨基酸序列用BLASTP分别搜索结球甘蓝和大白菜全基因组序列,获取候选结球甘蓝BoCBF和大白菜BrCBF蛋白氨基酸序列。利用Pfam 35.0和SMART数据库分析候选BoCBF和BrCBF蛋白的保守结构域,剔除不含AP2(PF00847)结构域的候选蛋白质,确定BoCBF和BrCBF家族成员。
1.2 BoCBF蛋白理化特征及系统发育分析
采用ProtParam工具分析BoCBF蛋白的理化特征,包括氨基酸序列长度、相对分子质量、理论等电点、不稳定指数、脂肪族氨基酸指数和总平均亲水性等特征。采用MEGA v7.0.26软件对BoCBF、BrCBF和AtCBF蛋白氨基酸序列进行聚类分析,选择最大似然法(Bootstrap值设定为1 000)绘制系统发育树。
1.3 BoCBF基因结构、物理位置及亚细胞定位预测分析
在结球甘蓝923全基因组数据库中分别获取BoCBF基因的gDNA和CDS序列,利用在线工具GSDS 2.0(http://gsds.gao-lab.org/)绘制外显子-内含子结构图。根据BoCBF基因的物理位置,使用MapChart v2.3软件绘制BoCBF基因染色体位置图。采用在线软件BaCelLo和Plant-mPLoc[21-22]对BoCBF蛋白的亚细胞定位进行预测。
1.4 CBF基因进化约束值分析和基因组加倍事件发生时间估计
通过DnaSP v6软件[23]计算结球甘蓝和拟南芥CBF基因之间的进化约束值(非同义替换率Ka/同义替换率Ks)。非同义替换率计算公式为非同义替换的SNP数/非同义替换位点数,同义替换率计算公式为同义替换的SNP数/同义替换位点数。利用同义替换率来估算结球甘蓝和拟南芥之间全基因组加倍事件发生的时间。估算公式为加倍事件发生时间(T)=Ks/2λ[拟南芥每年每个同义替换位点发生替换的速率(λ)为1.5×10-8][24]。
1.5 不同器官/组织及低温胁迫下BoCBF基因表达量分析
选取耐寒结球甘蓝923和不耐寒结球甘蓝D9为试验材料,将其种子播种在32孔穴盘中,放进人工气候室中正常管理,环境条件设置:白天温度为25 ℃,光照时间14 h,夜晚温度为18 ℃。待结球甘蓝长至五叶一心,转移至春化室进行2 ℃低温胁迫,处理不同时间(0 h、3 h、6 h、12 h、24 h)后进行取样,将叶片放入锡箔纸并立即于液氮中冷冻,在-80 ℃冰箱中保存备用。选择低温胁迫处理0 h、6 h、24 h的叶片样品送广州基奥迪生物科技有限公司进行转录组测序。此外,从NCBI的GEO数据库下载了结球甘蓝02-12正常生长条件下7个不同器官/组织(芽、愈伤组织、花、叶、根、角果和茎)的转录组数据(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE42891,GSE42891数据集)用于BoCBF基因不同器官/组织的表达量分析。以结球甘蓝923基因组作为转录组分析的参考基因组,以FPKM值来表示结球甘蓝BoCBF基因在不同器官/组织及低温胁迫下的表达量,利用Excel软件计算平均值和标准差,绘制柱形图。
1.6 BoCBF1、BoCBF2a和BoCBF3基因相对表达水平分析
将上述保存的低温处理0 h、3 h、6 h、12 h、24 h的叶片样品分别提取植物总RNA,并合成第一链cDNA。参照结球甘蓝923基因组[19]序列,利用Beacon Designer 7.7软件分别设计BoCBF1、BoCBF2a、BoCBF3基因和内参基因BoActin2的特异引物序列(表1)。利用SYBR Green染料法在罗氏荧光定量PCR仪器上进行PCR反应,试验采取3次技术重复,通过2-△△Ct计算方法计算基因的相对表达水平和标准差[25]。

表1 实时荧光定量PCR引物
2 结果与分析
2.1 结球甘蓝CBF家族成员鉴定、理化特征及系统发育分析
通过对结球甘蓝和大白菜全基因组数据库BLASTP搜索以及AP2保守结构域的在线验证,分别鉴定到7个BoCBF蛋白和6个BrCBF蛋白(表2)。BoCBF蛋白的氨基酸序列长度为203~283 aa,相对分子质量为2.25×104~3.11×104。BoCBF1、BoCBF2a、BoCBF2c、BoCBF3、BoCBF4a、BoCBF4b理论等电点为4.58~6.14,为弱酸性蛋白质;BoCBF2b理论等电点为7.63,为弱碱性蛋白质。蛋白质的不稳定指数为45.78~68.32,均超过临界值40。此外,BoCBF蛋白的脂肪族氨基酸指数为56.78~73.20,总平均亲水性指数为-0.598~-0.314,均为亲水性蛋白质。
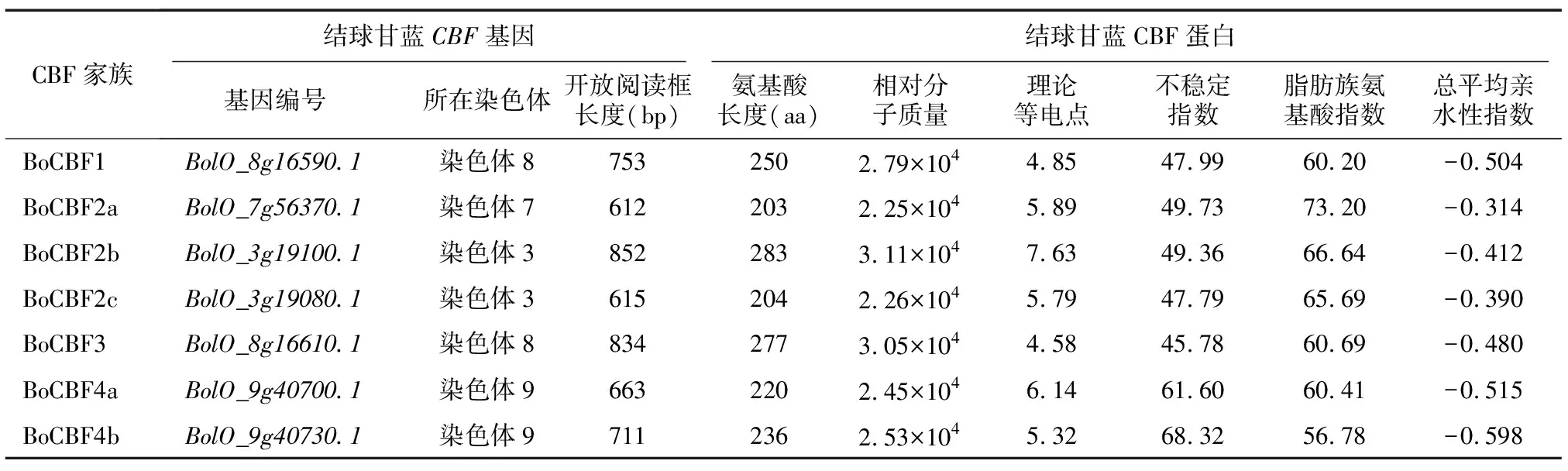
表2 结球甘蓝CBF家族成员理化特征
采用MEGA v7.0.26软件对结球甘蓝、大白菜和拟南芥17个CBF蛋白氨基酸序列构建系统发育树(图1)。CBF蛋白被分成2个亚组,亚组Ⅰ包含12个CBF蛋白,亚组Ⅱ包含5个CBF蛋白。其中亚组Ⅰ包括5个结球甘蓝CBF蛋白(BoCBF1、BoCBF2a、BoCBF2b、BoCBF2c和BoCBF3),4个大白菜CBF蛋白和3个拟南芥CBF蛋白。亚组Ⅱ包括2个结球甘蓝CBF蛋白(BoCBF4a和BoCBF4b),2个大白菜CBF蛋白和1个拟南芥CBF蛋白。相比拟南芥CBF家族成员,结球甘蓝和大白菜CBF家族成员之间的亲缘关系更近。
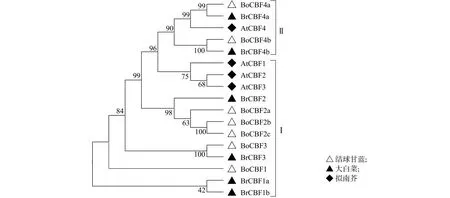
图1 结球甘蓝、大白菜和拟南芥CBF蛋白系统发育分析
2.2 BoCBF基因结构、物理位置及其编码蛋白质的亚细胞定位预测分析
BoCBF2b基因包含3个外显子和2个内含子,BoCBF2c基因包含2个外显子和1个内含子,BoCBF1、BoCBF2a、BoCBF3、BoCBF4a和BoCBF4b均只有1个外显子,没有内含子(图2)。此外,本研究还分析了7个BoCBF基因在结球甘蓝染色体上的物理位置分布,其中BoCBF2b和BoCBF2c串联分布在3号染色体上,BoCBF2a位于7号染色体上,BoCBF1和BoCBF3串联分布在8号染色体上,BoCBF4a和BoCBF4b串联分布在9号染色体上(图3)。
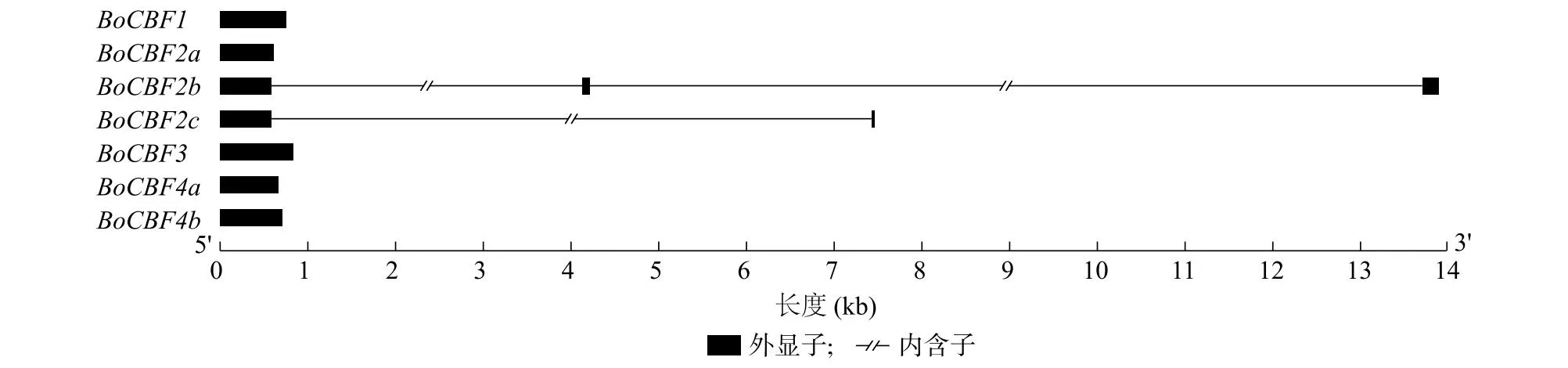
图2 BoCBF基因外显子-内含子结构图

图3 BoCBF基因在染色体上的物理位置分布
为了预测BoCBF蛋白亚细胞定位信息,分别利用BaCelLo和Plant-mPLoc工具在线进行预测(表3)。结果表明,结球甘蓝BoCBF1、BoCBF2a、BoCBF2b、BoCBF2c、BoCBF3和BoCBF4a蛋白均被预测定位于细胞核中,BoCBF4b被预测可能定位在细胞质或细胞核中。
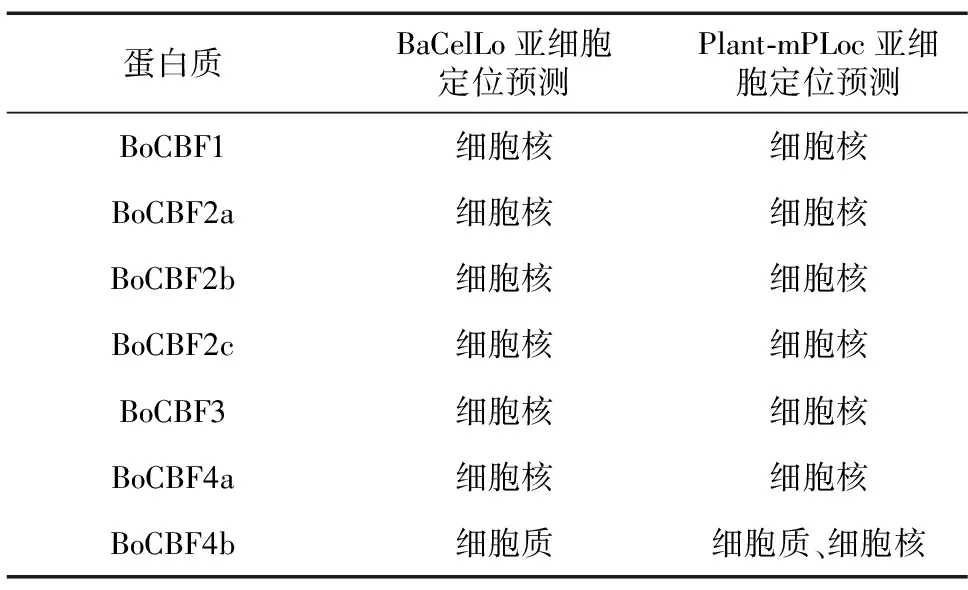
表3 BoCBF蛋白亚细胞定位预测
2.3 CBF基因进化约束值分析和基因组加倍事件发生时间估计
除AtCBF4与BoCBF4b同源基因对外,其余6个CBF直系同源基因对的进化约束值(Ka/Ks)均远小于1(0.156~0.294),表明进化中CBF基因以纯化选择作用为主(表4)。在结球甘蓝和拟南芥的直系同源基因对中,同义替换率为0.490~0.815。以拟南芥每年每个同义替换位点发生替换的速率(λ)为参考,利用结球甘蓝和拟南芥的直系同源基因对的同义替换率(Ks)估算,结球甘蓝和拟南芥之间全基因组加倍事件发生的时间大致发生在1.63×107~2.72×107年前。由表4可知,相比同源基因AtCBF2,BoCBF2a、BoCBF2b、BoCBF2c基因可能发生了全基因组三倍化事件(WGT),且它们的发生时间为1.63×107~1.97×107年前,这与芸薹族物种与拟南芥进行分化后经历了一次额外的全基因组三倍化事件的时间(1.30×107~1.70×107年前)相符合[26]。
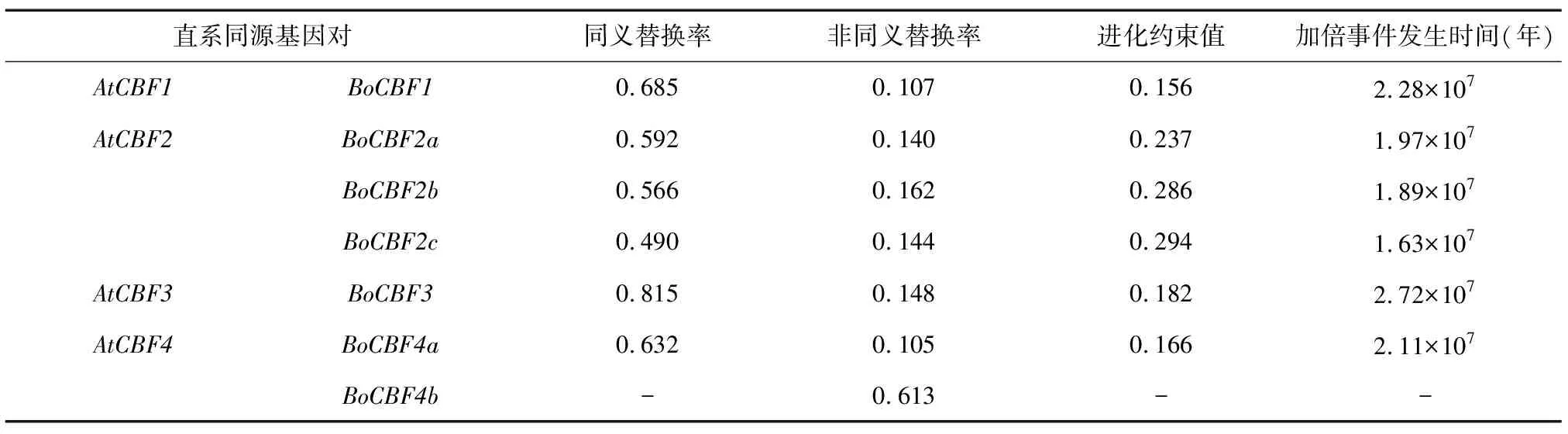
表4 结球甘蓝和拟南芥CBF基因进化约束值及基因组加倍事件发生时间预测
2.4 结球甘蓝不同器官/组织及低温胁迫下BoCBF基因表达量分析
本研究分析了5个BoCBF基因在结球甘蓝7个不同器官/组织中的表达量(图4)。其中BoCBF1、BoCBF2a和BoCBF3基因在甘蓝多个器官/组织中基本不表达(FPKM<1),仅在愈伤组织、根和茎中有较低的表达量。BoCBF4a基因仅在愈伤组织、根和茎中有中等表达量,BoCBF4b基因在茎中表达量中等,在根中表达量较高。

图4 转录组测序分析结球甘蓝02-12不同器官/组织中BoCBF基因表达量
本研究还分析了5个BoCBF基因在低温胁迫下的表达模式(图5),耐寒结球甘蓝923和不耐寒结球甘蓝D9中BoCBF2b和BoCBF2c基因的表达量均为0。在未进行低温处理时(0 h),BoCBF1、BoCBF2a和BoCBF3基因在耐寒结球甘蓝923和不耐寒结球甘蓝D9中的表达量几乎为0,BoCBF4a和BoCBF4b基因表达量较低。低温胁迫处理0~6 h,BoCBF1和BoCBF2a基因迅速响应,表达量上升,其中不耐寒结球甘蓝D9中BoCBF2a基因表达量急剧升高;低温胁迫6 h后至24 h,耐寒结球甘蓝923和不耐寒结球甘蓝D9中BoCBF1和BoCBF2a基因的表达量急剧下降。此外,低温胁迫0~24 h,耐寒结球甘蓝923中BoCBF4a和BoCBF4b基因表达量基本没有变化,说明BoCBF4a和BoCBF4b基因不受低温诱导表达。不耐寒结球甘蓝D9中BoCBF4a和BoCBF4b基因表达量在低温胁迫0~6 h下降,在低温胁迫6 h后至24 h表达量急剧上升。
根据前期拟南芥响应低温信号途径的研究结果[27],可知拟南芥中响应低温胁迫的AtCBF基因家族成员主要为AtCBF1、AtCBF2和AtCBF3,且基因快速响应的时间为低温胁迫0~3 h。结合图5的分析结果,本研究选取BoCBF1、BoCBF2a和BoCBF3基因,通过实时荧光定量PCR分析两个不同耐寒性结球甘蓝品种在低温胁迫0 h、3 h、6 h、12 h和24 h后这3个基因的相对表达量。如图6所示,不耐寒结球甘蓝D9中BoCBF1、BoCBF2a和BoCBF3基因的相对表达量在低温胁迫3 h达到最大值;耐寒结球甘蓝923中BoCBF2a和BoCBF3基因的相对表达量在低温胁迫3 h达到最大值,BoCBF1基因相对表达量在低温胁迫6 h达到最大。BoCBF1、BoCBF2和BoCBF3基因的相对表达量达到峰值后急剧下降,在24 h降至最低。
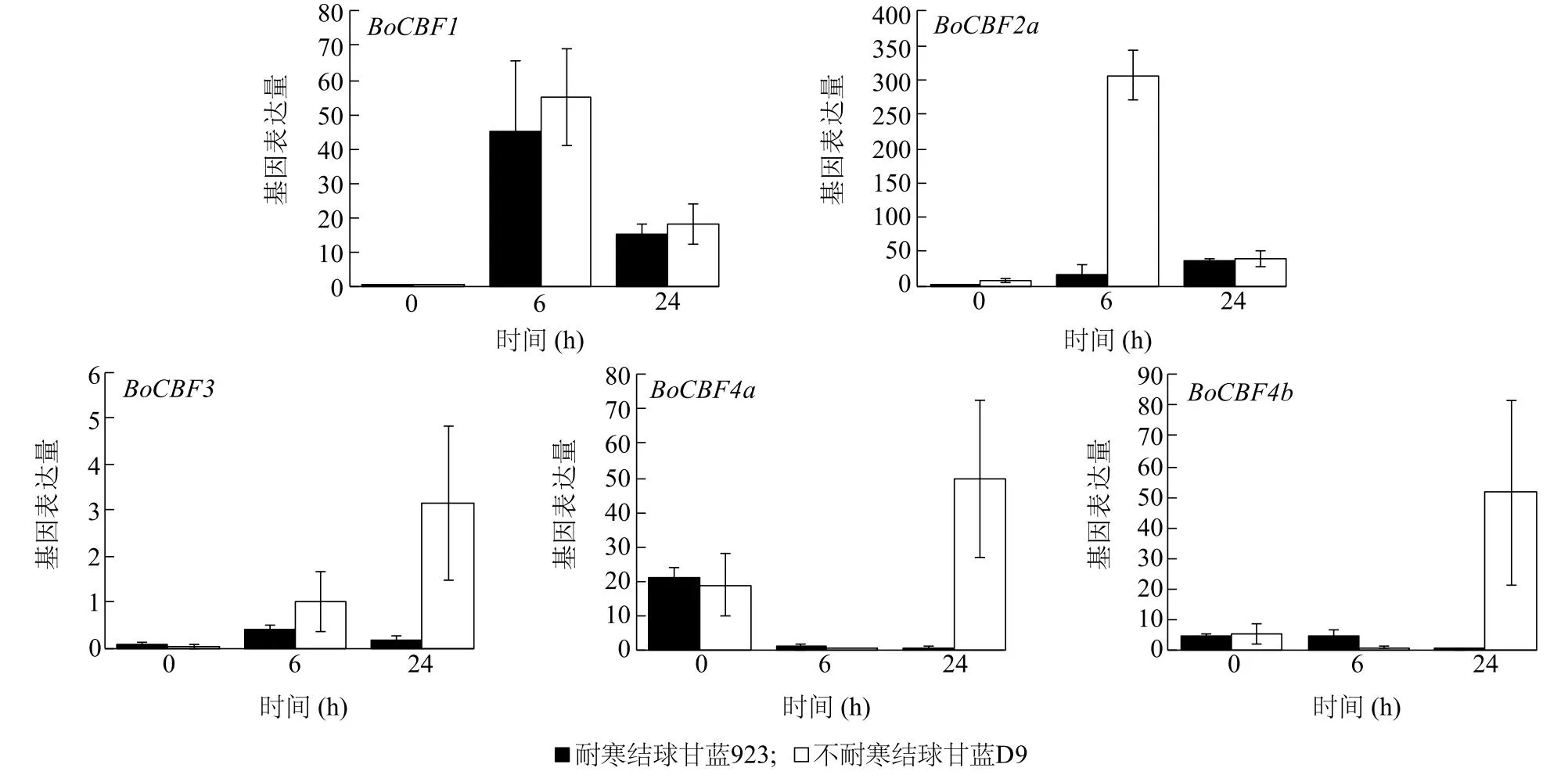
图5 转录组测序分析BoCBF基因在2 ℃低温胁迫下的表达量
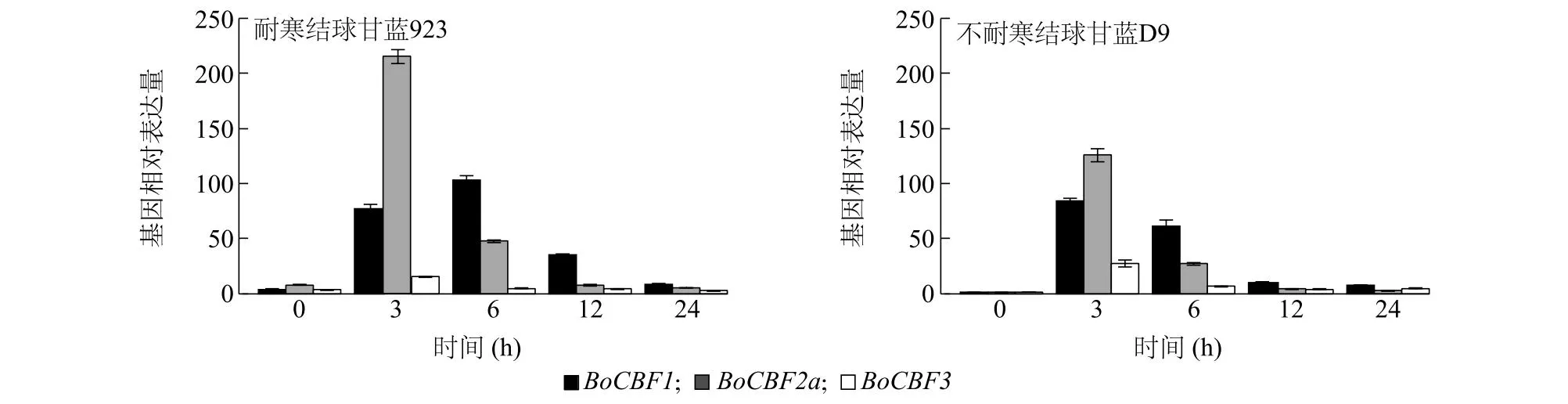
图6 实时荧光定量PCR分析2 ℃低温胁迫下BoCBF1、BoCBF2a和BoCBF3基因相对表达水平
3 讨 论
低温对结球甘蓝栽培有较大影响,产量及品质均受到严重影响。依赖于CBF(C-repeat binding factor)转录因子的ICE1-CBF-COR信号转导途径是植物响应低温胁迫信号的重要途径之一[7-8]。此外,拟南芥、大麦、玉米、水稻、小麦、葡萄和番茄等作物CBF基因的功能已经被广泛研究[10,16-18,28-30]。本研究探究了与拟南芥同属十字花科的结球甘蓝BoCBF基因的低温诱导特性,对进一步解析BoCBF基因响应低温胁迫具有重要的意义。
AtCBF1、AtCBF2和AtCBF3基因串联排列在拟南芥4号染色体上。在结球甘蓝中,仅BoCBF1和BoCBF3串联排列在8号染色体上,BoCBF2a位于7号染色体,BoCBF2b和BoCBF2c串联分布在3号染色体上。推测结球甘蓝中与拟南芥AtCBF2同源的BoCBF2基因发生了基因复制或丢失现象,导致加倍后的BoCBF2a、BoCBF2b、BoCBF2c基因与BoCBF1和BoCBF3不在同一条染色体上。此外,研究发现除BoCBF2b和BoCBF2c含有内含子序列外,其他BoCBF基因与拟南芥AtCBF基因结构一致,均无内含子结构,表明CBF基因在植物进化过程中具有较高的保守性。与BoCBF2a基因结构相比,发生全基因组三倍化事件后形成的BoCBF2b和BoCBF2c基因结构在进化过程中发生了变异,出现了较长的内含子序列,导致其基因功能也随之发生了变化。
拟南芥中AtCBF1、AtCBF2和AtCBF3基因不依赖ABA信号转导,受低温胁迫诱导表达,是低温诱导的关键基因[7-8]。本研究发现结球甘蓝923和D9中BoCBF1、BoCBF2a、BoCBF3、BoCBF4a和BoCBF4b基因受低温胁迫诱导表达,而结球甘蓝923和D9中BoCBF2b、BoCBF2c被发现不受低温胁迫诱导表达。其中,结球甘蓝D9中BoCBF4a和BoCBF4b基因在低温处理6 h后至24 h时表达量上升,可能是由于受到节律调节或者光调控的影响。结合转录组测序和实时荧光定量PCR分析发现,耐寒结球甘蓝923和不耐寒结球甘蓝D9中BoCBF2a基因响应低温胁迫诱导最为迅速,其次是BoCBF1和BoCBF3。本研究还发现在耐寒结球甘蓝923和不耐寒结球甘蓝D9中BoCBF1、BoCBF2a和BoCBF3基因受低温胁迫诱导后基因相对表达量变化趋势均为先上升后下降,仅表达水平出现高低的差异。综上所述,本研究结果为后续开展BoCBF1、BoCBF2a和BoCBF3基因调控结球甘蓝响应低温胁迫机理研究奠定了基础。
