BSA联合转录组分析发掘西瓜叶片黄化候选基因
2024-03-20张朝阳徐兵划黄大跃孙玉东
张朝阳, 程 瑞, 徐兵划, 顾 妍, 黄大跃, 孙玉东
(江苏徐淮地区淮阴农业科学研究所/淮安市设施蔬菜重点实验室,江苏 淮安 223001)
叶片是植物进行光合作用最主要的器官,对植物的生存具有重要意义,叶片颜色在很大程度上决定了植物的光合效率[1]。植物叶色突变不仅是研究叶绿素相关基因功能及植物发育的重要材料[2],也是优良的形态标记性状,在实际生产中常被用来进行品种纯度鉴定[3]。关于水稻、大麦、小麦、玉米、棉花、大豆、蚕豆、番茄、拟南芥等多种植物叶色突变的研究已有报道[4],叶色突变类型丰富多样,包括白化、黄化、黄绿化等[5-6]。植株叶色的形成不仅受到叶绿体生物合成途径、叶绿素降解途径、血红素代谢途径、类胡萝卜素代谢途径等与光合色素代谢途径相关基因的影响,受到与叶绿体发育相关基因的调控,还与光、温度、植物激素、矿物元素和金属离子等外界环境因素息息相关[6-9]。目前,关于水稻、玉米、拟南芥等模式植物中叶色的研究较为深入,水稻、玉米中已报道的叶色突变体均超200个[10-13],对拟南芥的研究发现,叶色突变以隐性遗传为主,目前已经发现27个编码15种叶绿素生物合成酶的核基因,它们的任何异常突变都会导致叶绿素缺乏,从而产生黄色突变[14]。近年来,随着高通量测序技术的应用,关于辣椒、甜瓜和黄瓜等一些重要经济作物的叶色突变研究也逐渐展开[15-19]。
西瓜是全球十大水果之一,中国西瓜栽培面积和消费量均居世界首位。随着杂交育种的发展,西瓜育种已基本实现杂种一代化,对制种纯度提出了更大挑战,叶形、叶色虽是重要的形态标记性状,但尚未应用于育种中。西瓜的遗传基础狭窄,自然突变率低,目前有关西瓜叶色突变的报道有斑驳突变类型[20]、白化突变类型[21-22]、不完全显性黄叶突变类型[22]、后绿突变类型[23]、黄化突变类型[24-25]等,但研究主要集中于遗传规律、生理特性[21-25]。西瓜基因组的公布和测序技术的快速发展为西瓜重要性状定位、关键基因功能研究奠定了重要生物学基础[26-29]。Kidanemariam[30]发现,西瓜后绿突变体Houlv中的ClCG03G010030基因存在1个单核苷酸多态性(SNP)变异,导致该基因编码的FtsH胞外蛋白酶序列中精氨酸突变为赖氨酸,FtsH蛋白主要参与叶绿体早期发育,进而影响西瓜叶片颜色。Zhu等[25]对叶片黄化突变西瓜材料w-yl进行精细定位,认为基因Cla97C02G036040、Cla97C02G036050和Cla97C02G036060可能是导致西瓜叶片黄化的主要基因。探索叶片颜色变异机制可为遗传改良提供理论依据,满足人们在生产、选种和育种等方面的需求;开发叶色形态标记,能够有效缩短育种周期,提高育种效率与制种纯度。本研究拟以全生育期叶片黄化西瓜材料ly104和绿叶西瓜材料w3为试验材料,通过混合分组分析(BSA)测序初步定位叶片黄化基因在染色体中的位置,进一步利用简化基因组(RAD)测序开发全基因组SNP分子标记,利用F2代群体构建高密度遗传图谱进行西瓜叶片黄化基因定位,结合转录组测序及基因功能注释锁定关键候选基因。本研究结果可为进一步全面解析西瓜叶片黄化基因及其生物学功能奠定重要基础。
1 材料与方法
1.1 试验材料
2014年,利用甲基磺酸乙酯(EMS)诱变获得的稳定遗传的叶片黄化西瓜材料,经5代连续自交获得相对纯合的叶片黄化突变材料ly104。本研究以ly104为母本(P1),以正常绿叶西瓜材料w3为父本(P2)构建F1代、F2代、BC1代群体,群体的构建与表型调查试验均于淮安市农业科学研究院科研创新基地进行,群体配制过程严格自交、杂交,整个生育期采取商品化管理。
1.2 形态观察与遗传规律分析
以第1张完全展开的真叶进行表型统计与分析,采用人工观察和便携式色差仪RM200QC(爱色丽X-Rite,美国)对叶片颜色指数进行测定,测定指标为亮度值(L*)、红绿值(a*)和黄蓝值(b*)3个颜色参数。对F1代、F2代、BC1代群体分离表型进行统计,分析西瓜叶片黄化遗传规律,并进行卡方检验。
1.3 通过BSA测序进行叶片黄化初定位
BSA测序即混合分组分析法,是一种简单快速的目标性状定位方法,已被广泛应用于多种园艺作物重要性状的基因定位[31]。本研究从F2代西瓜群体中选取黄叶、绿叶极端表型植株各20株,采用十六烷基三甲基溴化铵(CTAB)法[32]提取植株幼叶基因组DNA并检测其浓度,通过等量混匀构建2个极端混池,利用亲本DNA构建亲本池进行测序分析,送至上海凌恩生物科技有限公司,利用Illunima HiSeq 4000进行测序,亲本测序深度为10×,混池测序深度为20×,测序读长为150 bp。对原始序列(Read)进行过滤,去除接头,过滤掉包含未确定碱基(N)>15%和低质量的read(质量值≤20的碱基数占整个Read的10%以上),将获得的干净序列(Clean read)用于后续分析。使用BWA软件[33]将高质量的Clean read映射到西瓜基因组97103v2(http://cucurbitgenomics.org/organism/21)上。然后用GATK[34]、SnpEff[35]软件对突变位点进行检测和注释,用SNP-index算法进行关联分析,阈值为0.5。
1.4 西瓜高密度遗传图谱的构建
为了更精确地定位获得西瓜叶片黄化突变位点,本研究根据F2代群体中黄叶、绿叶分离比选取共100份单株,分别提取基因组DNA,采用RAD建库方式构建长度范围在300~500 bp的双端文库。将产物送至上海凌恩生物科技有限公司,利用Illunima HiSeq进行测序,测序读长为150 bp。对原始Read采用以下标准进行质控:(1)去除Read中的接头序列;(2)修剪测序质量较低的Read末端(测序质量值小于Q20);(3)去除含N比例达到10%的Read;(4)舍弃接头及质量修剪后长度小于100 bp的小片段。用BWA软件将Clean read比对至参考基因组97103v2,并对映射结果进行统计分析。用GATK软件进行变异位点检测获得SNP。对获得的SNP按以下标准进行过滤:(1)去除比对Read质量值小于20的位点,同时过滤掉缺失率大于50%的SNP;(2)删除无义SNP位点;(3)用joinmap 4.0软件[36]对过滤后的SNP进行卡方测验,先后过滤掉P<0.01和缺失率30%以上的标记,对于最终获得的SNP,采用joinmap 4.0软件进行西瓜遗传图谱构建,选用Kosamb’s参数。
1.5 转录组分析
从亲本及其F2代群体中取ly04和w3单株各3份,当第1张真叶完全展开后取样进行转录组分析。用Plant RNA Purification Reagent试剂盒(购自上海凌恩生物科技有限公司)提取植物总RNA,并构建转录组测序文库。送至上海凌恩生物科技有限公司采用Illumina HiSeq进行测序,Read长度为150 bp。测序数据经质控过滤获得Clean read,用Hisat2软件[37]将其映射到西瓜基因组97103v2上。用每个基因在一个样本中所对应的基因转录本数(FPKM)计算基因表达水平。基于KEGG (http://www.genome.jp/kegg/)和GO(http://www.geneontology.org/)数据库进行基因注释和功能分析。差异表达基因以差异倍数(Foldchange)≥1.5、P≤0.005为标准。
1.6 候选区域功能注释与候选基因筛选
结合遗传规律分析及BSA,利用RAD测序开发全基因组SNP标记,加入叶色表型标记进行西瓜2号染色体图谱的构建,对西瓜叶片黄化基因进行定位。以97103v2为参考基因组对定位区间基因进行注释,通过基因序列分析及转录组测序差异表达情况分析进一步筛选并确定候选基因。
2 结果与分析
2.1 西瓜叶片黄化特性及遗传规律分析
经EMS诱变获得叶片黄化的西瓜材料,经5代连续自交后,获得遗传稳定的叶片黄化材料ly104,该材料从子叶期至果实收获时的叶片均保持黄化状态(图1A)。通过对ly104、w3的叶片颜色指标进行测定,发现叶片黄化西瓜材料与绿叶西瓜材料在叶片颜色指标上存在极显著差异(图1B)。
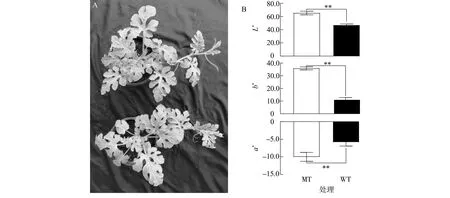
A:表型;B:颜色指数。L*:亮度(阈值0~100);a*:红绿色范围(阈值-128~+127);b*:黄蓝色范围(阈值-128~+127);MT:突变体叶片黄化材料;WT:野生型材料。**表示不同材料间差异极显著(P<0.01)。

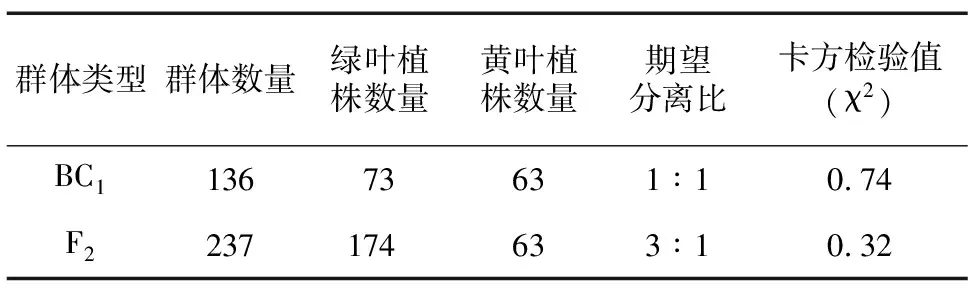
表1 F2代和BC群体中叶片黄化突变型与野生型的分离比
2.2 西瓜叶片黄化基因的BSA初定位
原始Read经质控过滤,2个混池共获得12.4 Gb高质量Clean read,Q30在93.0%以上,与参考基因组97103v2的平均比对率在98.0%以上。使用GATK软件进行变异检测,共获得523 303个SNP,经过滤后用SNP-Index算法对性状相关侯选区域进行选择,作图窗口大小为1 Mb,作图步移为10 kb,阈值为0.5,结果表明,西瓜叶色黄化基因定位于2号染色体8 490 001~26 410 000 bp(大小约为17.92 Mb)(图2A)。
2.3 高密度西瓜遗传图谱的构建与叶片黄化基因的定位
根据分离比,从F2代群体中选取76株绿叶、24株黄叶西瓜单株进行RAD测序,共获得69.17 Gb高质量Clean read,Q30在91.3%以上,与参考基因组的平均比对率在97.6%以上。使用GATK软件进行变异检测,共获得229 704个SNP,经过滤筛选,最终确定4 273个SNP用于西瓜高密度遗传图谱的构建。西瓜遗传图谱总长度为1 602.44 cM,平均遗传距离为0.39 cM,最大间隔为7.38 cM(表2)。
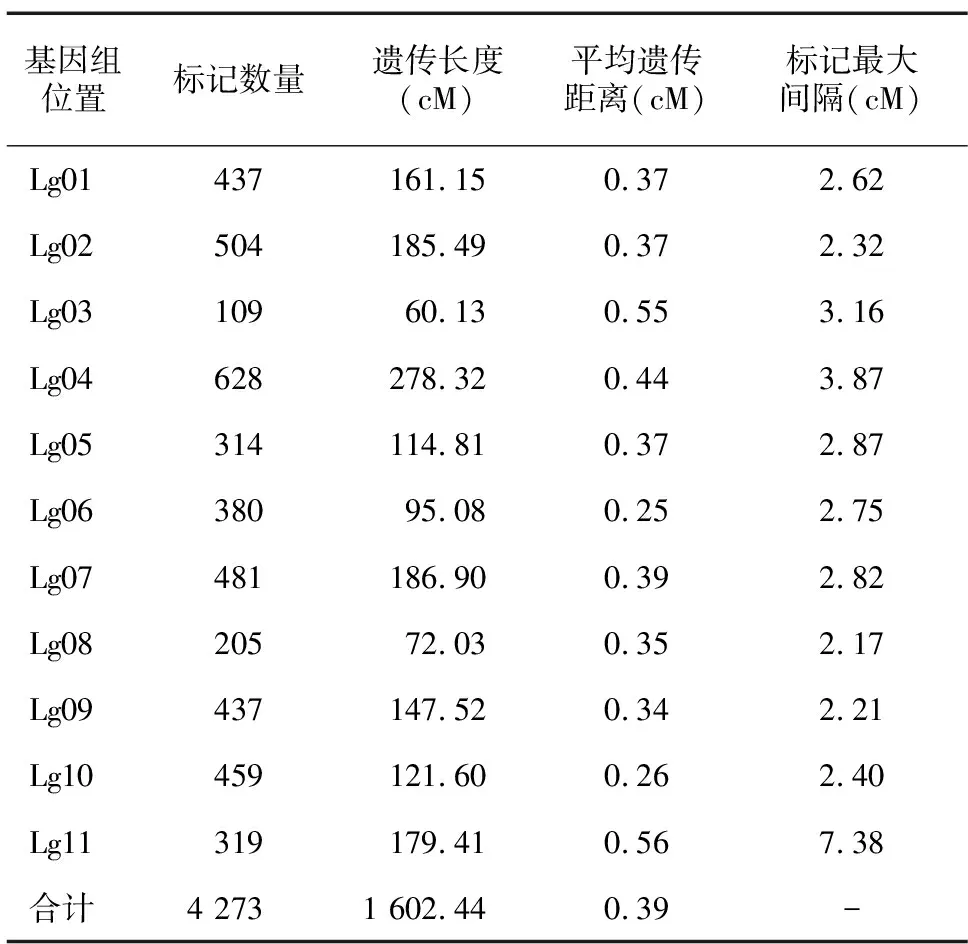
表2 西瓜高密度遗传图谱构建结果
为了进一步精确定位西瓜叶片黄化基因,用RAD测序结果对西瓜2号染色体上的SNP标记进行过滤筛选,剔除检测率低于40%的样品单株和标记,最终用91份单株(68份绿叶,23份黄叶)、286个SNP标记进行叶片黄化基因定位,叶片颜色标记(Leafcolor)用绿叶(D)、黄叶(B)表示,用joinmap4进行西瓜叶片黄化基因的定位。结果显示,Leafcolor定位于Clas97Chr02-13950306与Clas97Chr02-15517591标记之间(大小约为1.567 Mb)(图2B),以西瓜97103v2为参考基因组,该区间包含24个注释基因(图2C、表3)。
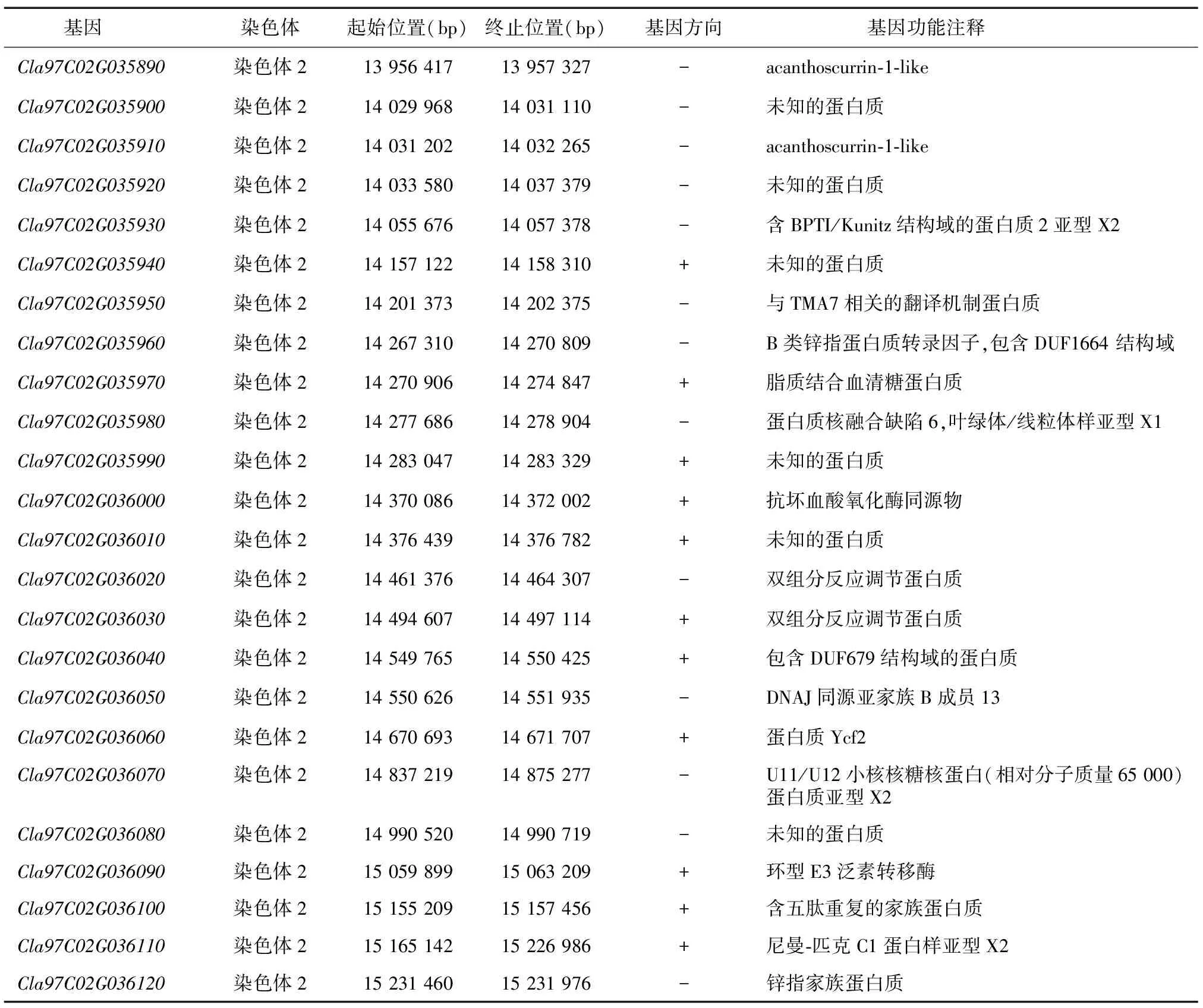
表3 候选区间注释基因
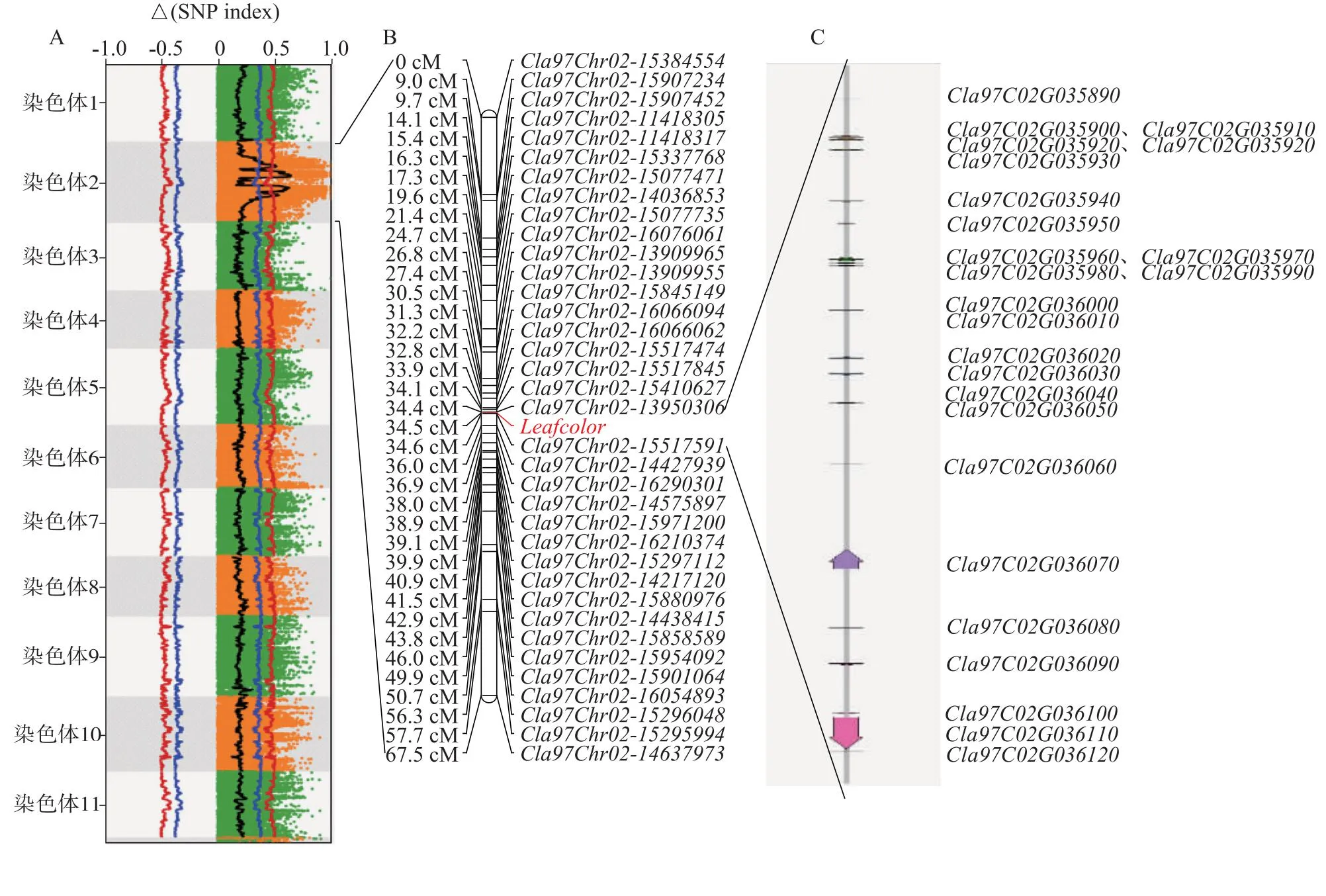
A:BSA定位结果。B:西瓜2号染色体遗传图谱及叶色黄化标记定位。C:根据西瓜参考基因组97103v2注释候选区域的基因。SNP index:单核苷酸多态性指数。
2.4 西瓜黄化叶片转录组分析及候选基因的筛选
RNA-seq共检测12个样本,其中P1、P2分别选取3个样本,F2代群体中叶片黄化类型、绿叶类型分别选取3个样本,每个样本平均获得6.4 Gb高质量Clean read数据,Q30在92.0%以上,平均基因组比对率为91.4%。分别以P2G(亲本绿叶)与P1Y(亲本黄叶)和F2G(F2代绿叶)与F2Y(F2代黄叶)为对比组进行独立分析,其中P2G与P1Y对比组中共检测到1 356个差异表达基因,其中上调表达的基因529个,下调表达的基因827个;F2G与F2Y对比组中共检测到4 180个差异表达基因,其中上调表达的基因1 378个,下调表达的基因2 802个(图3A,图3B)。P2G与P1Y对比组和F2G与F2Y对比组中均显著下调表达的基因共有327个、均显著上调表达的基因共有132个(图3A)。以上结果表明,亲本中黄叶和绿叶差异表达基因数量显著小于F2代群体,说明P1和P2已相对纯合;GO和KEGG富集分析结果表明,差异表达基因富集通路多与光合、应激反应等有关,说明黄叶和绿叶西瓜植株在光合作用等方面存在较大差异。
对西瓜2号染色体13 950 306~15 517 591 bp(大小约为1.56 Mb)内的24个注释基因进行功能分析和转录组表达差异分析,结果显示,24个注释基因中有17个在植株叶片中表达,仅有基因Cla97C02G036060、Cla97C02G035950、Cla97C02G036010、Cla97C02G036020在叶片黄化植株与绿叶植株中的表达存在显著差异,Cla97C02G036060在P2G和F2G中均显著上调表达(图3C),其注释功能为Ycf2蛋白编码基因,该编码基因为被子植物中最重要的质体基因,与植物光合作用有关。
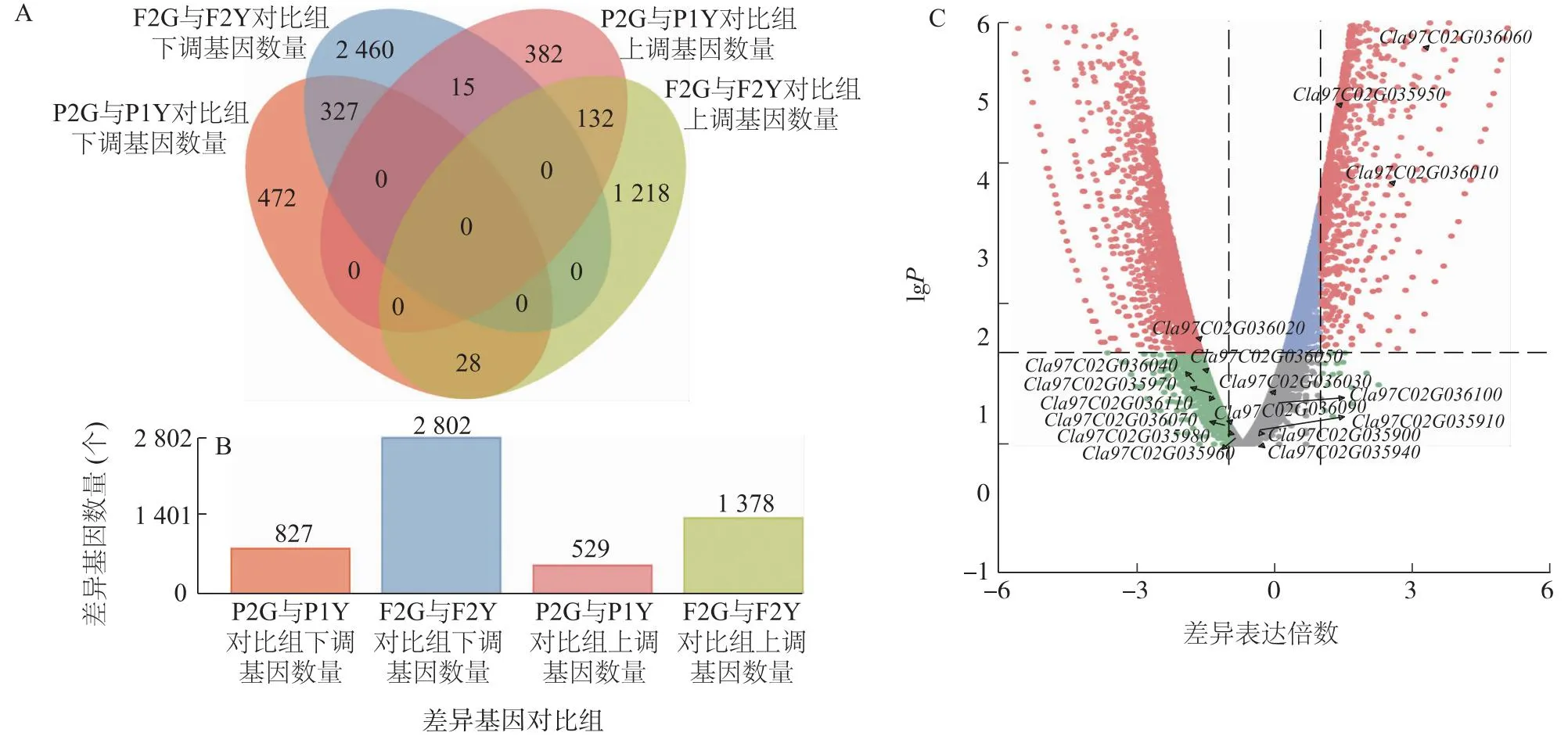
A:P2G与P1Y对比组及F2G与F2Y对比组上调和下调基因数量Venn图;B:P2G与P1Y对比组及F2G与F2Y对比组上调和下调基因数量柱形图;C:F2G与F2Y对比组差异基因火山图,标注基因为候选区间基因。P1Y:亲本黄叶;P2G:亲本绿叶;F2G:F2代绿叶;F2Y:F2代黄叶。
3 讨论与结论
化学EMS诱变是人工创造突变体最常用的处理方式之一,叶片黄化是最常见的诱变表型[22]。笔者所在课题组前期通过EMS诱变西瓜种子,获得稳定遗传的西瓜叶片黄化材料,其整个生育期均可保持黄化状态。植物叶片黄化突变,又称叶绿素缺乏突变,通常是由叶绿素合成或降解途径被破坏所致[38]。目前,研究者已经在水稻[39]、番茄[40]、黄瓜[19]、拟南芥[41]等植物中发现了黄化突变体。有研究发现,不同类型的叶色突变的遗传规律差异较大,有些叶色突变可能是核遗传,也可能是细胞质遗传,水稻[42]、玉米[43]、小麦[44]、黄瓜[45]、番茄[46]等都由1对或2对隐性核基因控制。Zhang等[21]研究证实,西瓜叶片白化突变是由1对隐性等位基因(jaja)控制的。Provvidenti[20]发现,西瓜叶色斑驳突变由1对隐性基因(slv)控制。Kidanemariam等[30,47]发现,西瓜叶色后绿突变是由1个隐性基因(dgdg)控制的。Zhu等[25]研究发现,西瓜黄化突变体w-yl由1对隐性核基因控制,与本研究结果一致。
西瓜作为重要的园艺经济作物[48-51],在中国的栽培面积和产量均居世界首位。经长期人工选择,栽培西瓜遗传背景狭窄,多态性分子标记开发受限,致使西瓜分子标记辅助育种及品种改良进展缓慢。高密度遗传图谱的构建不仅是开发西瓜重要农艺性状遗传基因/QTL紧密连锁分子标记的重要手段,亦是深入挖掘和解析西瓜重要农艺性状基因的基础,通过遗传图谱构建进行基因/QTL定位研究已经在西瓜多种性状研究中得到成熟应用[52-53]。本研究基于BSA定位,将西瓜叶片黄化基因定位于2号染色上,为了进一步获得可靠定位基因,本研究开发了SNP标记,用于构建高密度西瓜遗传图谱,并将西瓜叶片黄化基因定位到2号染色体13 950 306~15 517 591 bp(大小约为1.56 Mb),比对西瓜参考基因组97103v2发现,在候选区段内包含24个注释基因,17个基因在叶片中表达,4个基因在黄叶与绿叶转录组分析中存在显著差异表达,其中基因Cla97C02G036060是Ycf2蛋白的编码基因,Ycf2/FtsH调控的烟酰胺腺嘌呤二核苷酸-苹果酸脱氢酶是叶绿体或非光合质体在黑暗中产生腺嘌呤核苷三磷酸的关键酶[54],是光合生长必需的酶[55]。目前,Ycf2基因已被证实是被子植物中最重要的质体基因[56],它在高等植物中发挥着重要功能[57]。在本研究中,由于双亲重测序深度不高,候选区间注释基因编码区中未发现可靠突变,但转录组结果显示,Ycf2在叶片黄化西瓜材料中的表达量显著下调,说明叶片黄化西瓜材料的光合作用系统可能与正常绿叶植株光合系统存在显著差异,相关机制需要进一步研究。本研究结果可为进一步挖掘叶片黄化植株光合作用机制奠定一定科学基础。
