盐碱地旱生芦苇根际解磷菌株筛选及促生特性
2024-03-20王继莲王冬玲李明源
王继莲, 王冬玲, 周 茜, 张 甜, 李明源
(1.喀什大学生命与地理科学学院,新疆 喀什 844006; 2.新疆帕米尔高原生物资源与生态自治区重点实验室,新疆 喀什 844006)
磷是植物必不可少的矿质元素,对其代谢、生长和繁殖有重要影响[1-2]。中国超过70%的耕地土壤缺乏能被植物直接吸收利用的速效磷,主要原因是磷素易被土壤固定,与Ca2+、Al3+、Fe3+等反应形成不溶性化合物沉积在土壤中,导致植物生长缓慢或停滞[3]。为提高农业生产效率,大量施加外源无机磷肥是增加土壤有效磷供应,维持作物高产的主要手段。然而植物对磷肥的利用率极低(<25%),长期大量施肥不仅造成磷素盈余,引起土壤性质恶化,部分土壤磷还会随水体渗流迁移,造成地下水污染,导致更严重的生态问题[4-5]。因此,如何提升土壤磷的供给,又不给生态环境造成额外负担,成为人们关注的新焦点,微生物肥料应运而生。
微生物在元素循环中扮演着重要角色,一些类群能够将难溶性磷转化为可溶性磷来改善植物磷素供应,称为解磷微生物(Phosphate solubilizing microorganisms, PSM)。研究结果表明,PSM主要依赖其代谢产生的多种有机酸来酸化难溶性磷酸盐[6],还有部分解磷菌可在生长过程中分泌植酸酶、核酸酶、磷脂酶等多种水解酶,通过裂解有机磷化合物的磷脂键使其转化成速效磷[7-8]。刘玲利等[9]将解磷菌施入土壤,有效活化了复垦土壤磷素,同时土壤碱性磷酸酶活性增加,促进了油菜生长。巨大芽胞杆菌BacillusmegateriumHZP1和肠杆菌Enterobactersp.PSB-1发酵后,培养基中可溶性磷含量相比对照显著提高,接种大豆和紫云英后,植株地上部分生物量、根瘤鲜质量和根瘤数明显增加[10]。庄馥璐等[11]从苹果根际分离的解磷菌株Enterobactersp.PsbM4可有效矿化植酸钙产生无机磷,促进拟南芥生长。
特定的有效菌种是微生物菌肥的核心。迄今微生物菌肥已取得了快速发展,但基于土壤类型、地域和气候的不同,不同宿主植物的根际解磷菌群存在明显差异。因此,生物菌肥产品难以具有普适性,从不同生境植物针对性遴选高效解磷菌株仍然是开发有区域特效的微生物肥料的有效手段。旱生芦苇(Phragmitesaustralis)是新疆盐碱地广泛分布的典型盐生植物,适应性广、抗逆性强,其对盐碱的适应能力与根际菌群密切相关[12-13]。本研究拟从新疆克孜勒苏柯尔克孜自治州盐碱地旱生芦苇根际筛选解磷菌,分析其促生特性和分类地位,并通过接种试验观察其对盐碱条件下作物生长的影响,为研制盐碱地专用微生物肥料提供优良菌种资源。
1 材料与方法
1.1 样品采集
样品采自新疆克孜勒苏柯尔克孜自治州盐碱地(39°40′N,76°41′E)。该地区全年干旱少雨,土壤pH值8.0~8.5,全盐含量12.1 g/kg。植被以盐节木(Halocnemumstrobilaceum)、盐穗木(Halostachyscaspica)、旱生芦苇(Phragmitescommunis)等耐盐碱植物为主。2021年10月,采用多点采样法沿S型线路随机挑取长势良好的旱生芦苇,挖去表面浮土,沿根系生长方向小心挖取根系及周围的土壤。
盆栽供试土壤采集自新疆喀什郊区未耕种的盐碱地,去除表层浮土后挖取10~30 cm土层的土壤。土壤pH值8.57,可溶性盐含量0.36%,碱解氮、速效钾和有效磷含量分别为28.64 mg/kg、99.57 mg/kg、18.92 mg/kg,有机质含量为17.36 g/kg。
1.2 培养基
采用NBRIP培养基分离解无机磷菌株[14],采用Mongina培养基筛选解有机磷菌株[15],采用LB培养基加40%甘油保存菌种。
1.3 解磷菌的筛选
称取10 g根际土壤样品加入到含有玻璃珠的无菌水中,充分振荡30 min使颗粒分散。取上清液依次10倍梯度稀释后,分别吸取不同浓度梯度的上清液涂布于NBRIP和Mongina平板上,每个稀释梯度重复3次,28 ℃恒温培养3~5 d。挑取溶磷圈较大、形态不同的菌落在LB平板上多次划线纯化,获得纯菌落。
1.4 溶磷能力测定
用钼锑抗比色法[16]测定磷含量,分别吸取5 mg/L的磷标准溶液0 ml、1 ml、2 ml、3 ml、4 ml、5 ml、6 ml于50 ml容量瓶中,然后加入碳酸氢钠溶液(0.5 mol/L,pH值8.5)10 ml,再加入钼锑抗试剂5 ml,用去离子水定容。以磷浓度为横坐标,OD700值为纵坐标绘制标准曲线。将解磷菌以2%接种量分别接种至50 ml的NBRIP和Mongina液体培养基中,每株菌株3次重复,以不接菌的培养基作为对照,28 ℃,180 r/min培养7 d后测定发酵液pH值。同时将发酵液10 000 r/min离心15 min,取一定量上清液测定磷含量,并分析磷含量与发酵液pH值的相关性。
1.5 16S rDNA扩增及系统发育分析
用无菌牙签轻轻挑取单菌落,置于50 μl 裂解Buffer (TaKaRa公司产品)中,80 ℃热变性15 min,然后低速离心5 min。取1~3 μl上清液用通用引物27F(5′-AGAGTTTGATC-CTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对分离物进行扩增。PCR产物用限制性内切酶MspⅠ和HaeⅢ酶切,并进行图谱分析,相同图谱选取1~2株代表性菌株由生工生物工程(上海)股份有限公司测序,测序结果提交EZBioCloud数据库比对,通过MEGA 6.0软件,用邻接法(Neighbor-joining)构建解磷菌株的系统发育树。
1.6 促生试验
1.6.1 种子催芽及接菌处理 拟南芥种子为哥伦比亚野生型,消毒后用无菌牙签点播于花卉基质(不含盐碱土壤)育苗盘,覆保鲜膜,待种子发芽至两片嫩叶进行接种处理。分别选取解磷能力较强的前5株菌株,接种于LB液体培养基,培养温度28 ℃,180 r/min振荡培养36 h,统一调整菌液OD600为0.8(活菌数1×109CFU/ml),分别接种菌株培养液、灭活的菌株培养液。每8 d灌根1次,每次灌根菌液用量为5 ml,对照用等量无菌LB培养基灌根。每个处理5次重复。光照培养室参数设置为25 ℃,光照14 h/黑暗10 h,定期补水并调换育苗盘位置,以保证受光一致,统一管理32 d后取样。测量相关指标,分析解磷菌株对非盐碱胁迫下植株生长的影响。
将供试盐碱土壤与花卉基质按质量比7∶3混匀,高温灭菌后备用。供试小麦品种新冬60号系喀什地区主推小麦品种。将健康饱满的种子用1%的次氯酸钠浸泡5 min,经无菌水冲洗5次以上后平铺于湿润的滤纸上,28 ℃催芽48 h。挑选圆润饱满且芽长一致的种子,每盆播种9粒种子,同上述方法进行菌液灌根处理,研究解磷菌株对盐碱土种植小麦的促生效应。
1.6.2 指标测定 随机抽取不同处理的拟南芥幼苗和小麦幼苗,用卷尺测量株高,游标卡尺测量茎粗;将植株地上部分与地下部分分开,用分析天平精确测量地上部分和地下部分鲜质量。植株经105 ℃高温杀青30 min后烘至恒质量,用分析天平测量地上部分干质量和地下部分干质量,对拟南芥根系发育情况进行显微观察。采用SPSS 21.0和Origin 8.5软件对数据进行统计分析及绘图。
2 结果与分析
2.1 解磷菌株的筛选及解磷能力测定
从旱生芦苇根际土壤中共筛选到47株解磷菌株,其中32株能溶解无机磷,溶磷量为55.8~722.3 mg/L,以菌株PM-9的解磷能力最强(图1A)。有37株菌可溶解有机磷,溶磷量为11.8~34.4 mg/L,以菌株PM-20的解磷能力最强(图1B)。可溶解无机磷菌株的发酵液pH值为4.24~7.46,发酵液pH值与发酵液中可溶性磷含量呈显著负相关(R2=0.830,P<0.05),说明菌株溶解无机磷能力越强所产生的发酵液pH值越低。可溶解有机磷菌株的发酵液pH值为6.04~6.89,菌株溶解有机磷能力与发酵液pH值无明显相关关系。
2.2 25株代表菌株16S rDNA序列分析及系统进化树构建
基于限制性酶切片段长度多态性的分析结果,共选取了25株代表菌株进行16S rDNA测序,系统发育树如图2所示。所有菌株隶属于7个属,以肠杆菌属(Enterobacter)为绝对优势属,占总数的60%。假单胞菌属(Pseudomonas)有3株,占总数的12%。类芽孢杆菌属(Paenibacillus)和不动杆菌属(Acinetobacter)各2株,各占总数的8%。芽孢杆菌属(Bacillus)、Mammaliicoccus和Paeniglutamicibacter各1株,各占总数的4%。
2.3 促生效果
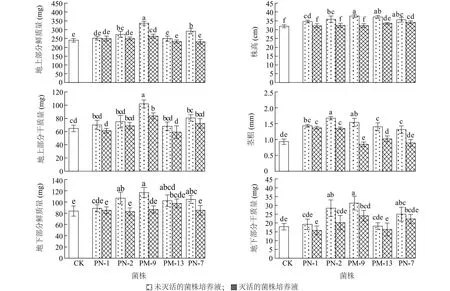
2.3.1 溶解无机磷菌株对拟南芥的促生效果 相较于对照,灭活的菌株培养液对拟南芥株高均无显著影响(P>0.05),未灭活的菌株培养液使拟南芥株高显著提高11.8%~28.1%(P<0.05)(图3)。接种未灭活的Bacillussp.PN-2、未灭活的Enterobactersp.PM-9、未灭活的Enterobactersp.PM-13、未灭活的Enterobactersp.PN-7以及灭活的Enterobactersp.PM-13培养液的拟南芥地上部分鲜质量显著高于对照(P<0.05)。其中接种未灭活的Bacillussp.PN-2培养液的拟南芥地上部分鲜质量最大,相较于对照显著提高62.4%(P<0.05)。
接种未灭活的Pseudomonassp.PN-1、未灭活的Bacillussp.PN-2、未灭活的Enterobactersp.PM-9、未灭活的Enterobactersp.PN-7、灭活的Pseudomonassp.PN-1以及灭活的Enterobactersp.PN-7培养液的拟南芥地上部分干质量显著高于对照(P<0.05)。在所有处理中,接种未灭活的Bacillussp.PN-2培养液的拟南芥地上部分干质量最大,相较于对照显著提高52.2%。接种未灭活的Pseudomonassp.PN-1、未灭活的Bacillussp.PN-2、未灭活的Enterobactersp.PM-13培养液的拟南芥地下部分干质量显著高于对照(P<0.05)。在所有处理中,接种未灭活的Bacillussp.PN-2培养液的拟南芥地下部分干质量最大,相较于对照显著提高36.0%(P<0.05)。相比对照,接种未灭活的Bacillussp.PN-2培养液的拟南芥主根更发达,侧根数量明显增多(图4)。总体而言,溶解无机磷菌株中未灭活的Bacillussp.PN-2培养液对拟南芥的促生效果更明显。
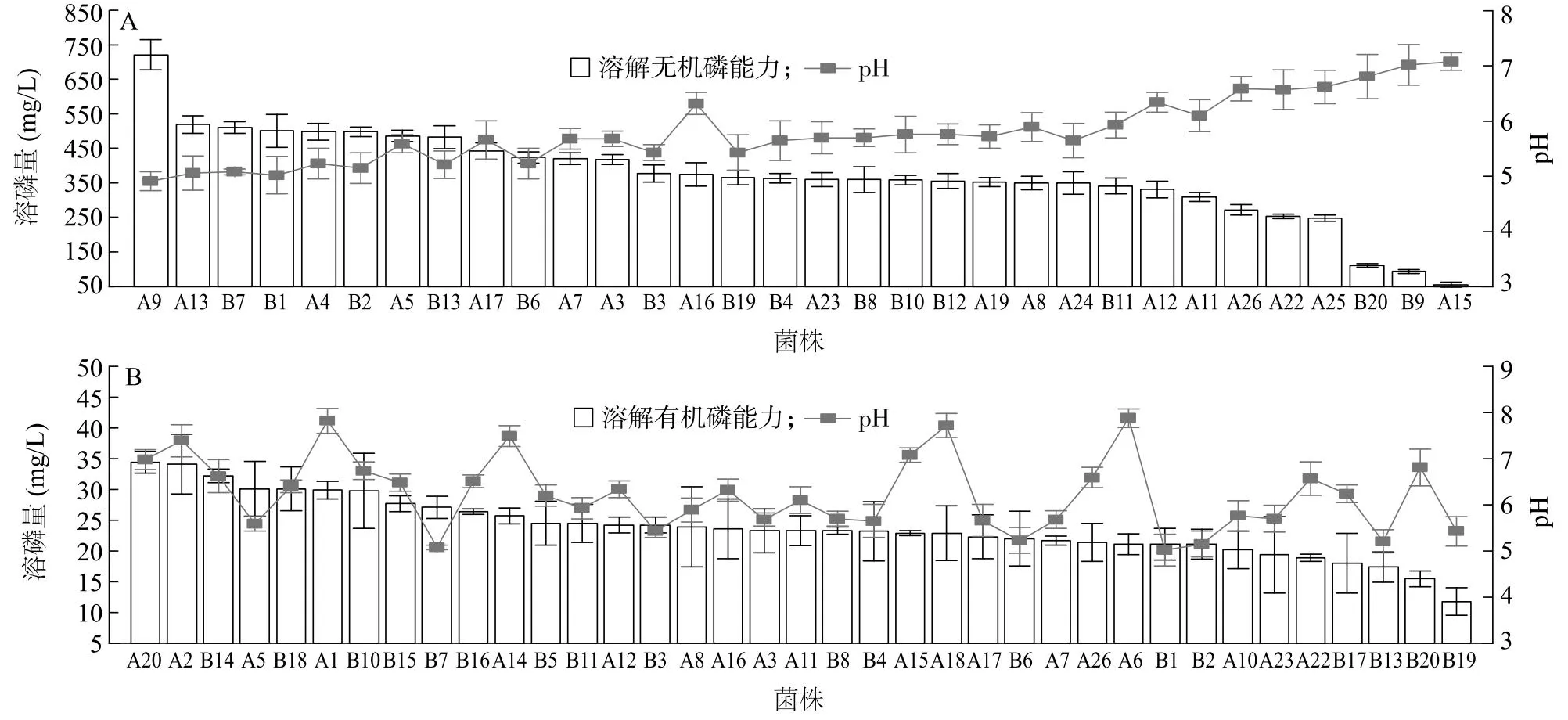
A9:菌株PM-9;A13:菌株PM-13;B7:菌株PN-7;B1:菌株PN-1;A4:菌株PM-4;B2:菌株PN-4;A5:菌株PM-5;B13:菌株PN-13;A17:菌株PM-17;B6:菌株PN-6;A7:菌株PM-7;A3:菌株PM-9;B3:菌株PN-3;A16:菌株PM-16;B19:菌株PN-19; B4:菌株PN-4;A23:菌株PM-23;B8:菌株PN-8;B10:菌株PN-10;B12:菌株PN-12;A19:菌株PM-19;A8:菌株PM-8;A24:菌株PM-24;B11:菌株PN-11;A12:菌株PM-12;A11:菌株PM-11;A26:菌株PM-26;A22:菌株PM-22;A25:菌株PM-25;B20:菌株PN-20;B9:菌株PN-9;A15:菌株PM-15;A20:菌株PM-20;A2:菌株PM-2;B14:菌株PN-14; B18:菌株PN-18;A1:菌株PM-1;B15:菌株PN-15;B16:菌株PN-16;A14:菌株PM-14;B5:菌株PN-5;A18:菌株PM-18;A6:菌株PM-6;A10:菌株PM-10;B17:菌株PN-17。
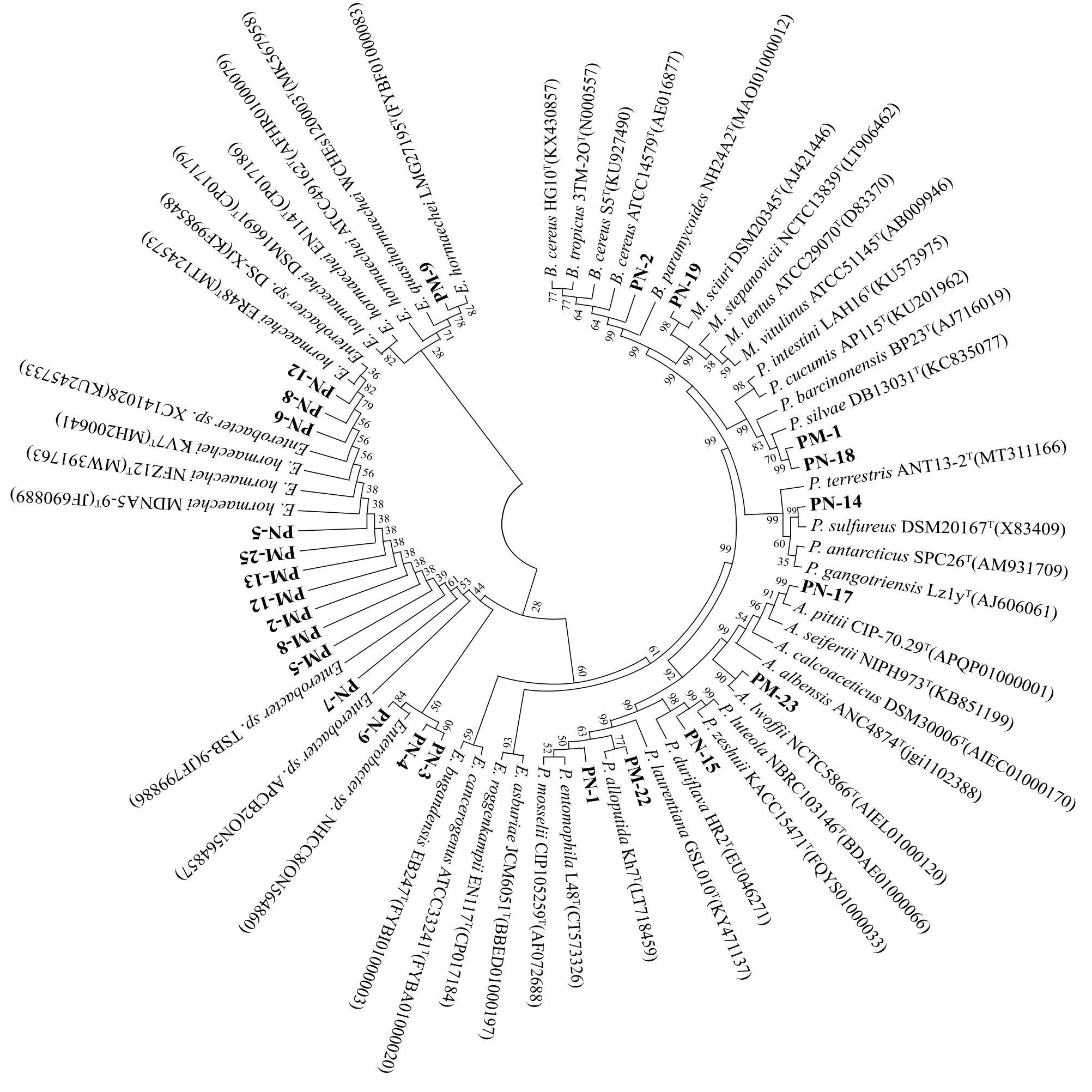
PN-2:Bacillus sp.PN-2;PN-19:Mammaliicoccus sp.PN-19;PM-1:Paenibacillus sp.PM-1;PN-18:Paenibacillus sp.PN-18; PN-14:Paeniglutamicibacter sp.PN-14;PN-17:Acinetobacter sp.PN-17;PM-23:Acinetobacter sp.PM-23;PN-15:Pseudomonas sp.PN-15;PM-22:Pseudomonas sp.PM-22;PN-1:Pseudomonas sp.PN-1;PN-3:Enterobacter sp.PN-3;PN-4:Enterobacter sp.PN-4;PN-9:Enterobacter sp.PN-9;PN-7:Enterobacter sp.PN-7;PM-5:Enterobacter sp.PM-5;PM-8:Enterobacter sp.PM-8;PM-2:Enterobacter sp.PM-2;PM-12:Enterobacter sp.PM-12;PM-13:Enterobacter sp.PM-13;PM-25:Enterobacter sp.PM-25;PN-5:Enterobacter sp.PN-5;PN-6:Enterobacter sp.PN-6;PN-8:Enterobacter sp.PN-8;PN-12:Enterobacter sp.PN-12;PM-9:Enterobacter sp.PM-9。
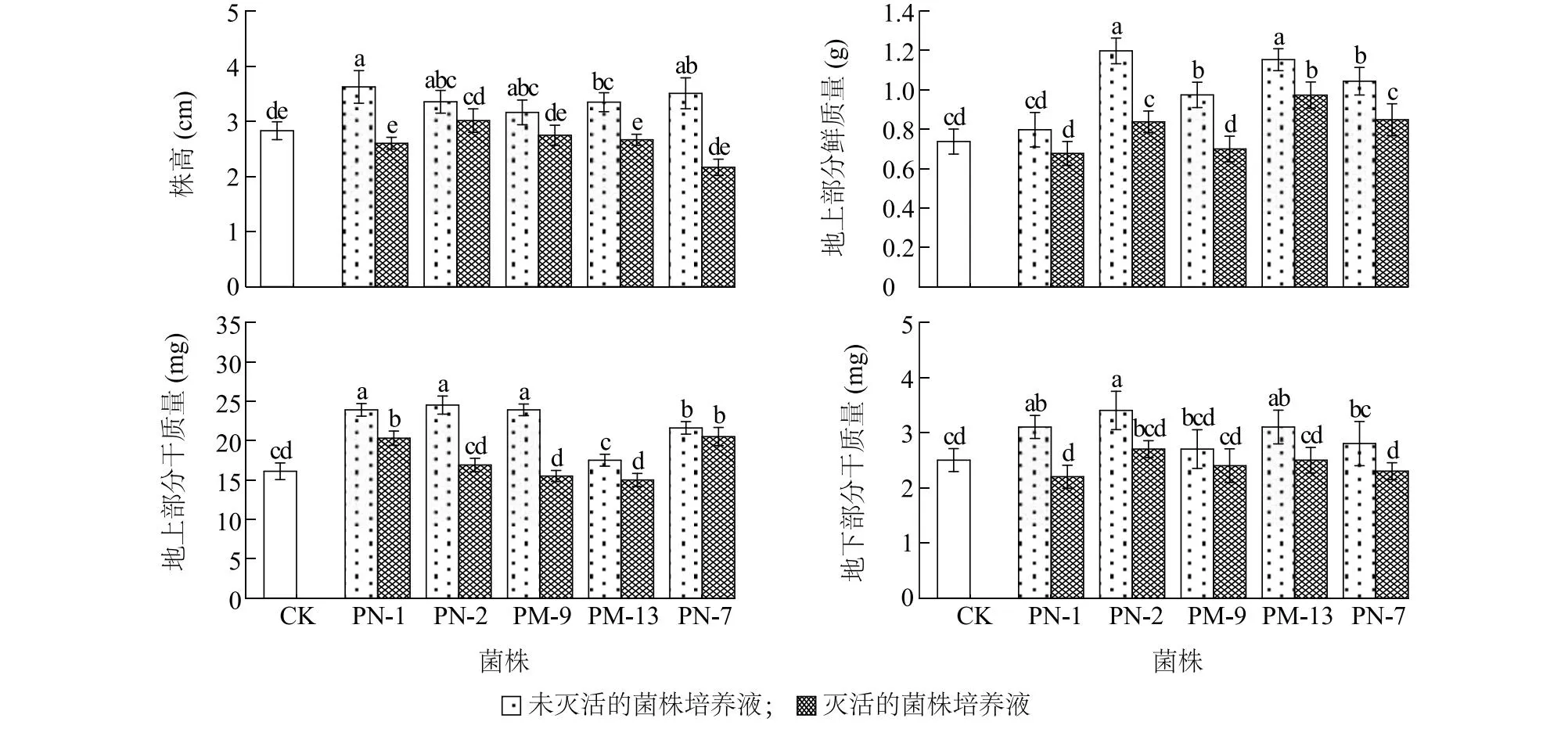
CK:对照,无菌LB培养基;PN-1、PN-2、PM-9、PM-13、PN-7见图2注。不同柱上标有不同小写字母表示差异显著(P<0.05)。

A:接种LB培养基的拟南芥根系显微图;B:接种灭活的Bacillus sp.PN-2培养液的拟南芥根系显微图;C:接种未灭活的Bacillus sp.PN-2培养液的拟南芥根系显微图;D:从左到右分别为接种LB培养基、接种灭活的Bacillus sp.PN-2培养液、接种未灭活的Bacillus sp.PN-2培养液的拟南芥植株。
2.3.2 溶解有机磷菌株对拟南芥的促生效果 接种灭活的Enterobactersp.PM-2和Enterobactersp.PM-20培养液的拟南芥株高与对照相比无显著差异(P>0.05),其他处理拟南芥株高均较对照显著提高,所有处理中接种未灭活的Pseudomonassp.PM-1培养液的拟南芥株高最高,相较于对照显著提高46.7%(P<0.05)(图5)。接种未灭活的Pseudomonassp.PM-1、未灭活的Enterobactersp.PM-2、未灭活的Enterobactersp.PM-5培养液的拟南芥地上部分鲜质量显著高于对照(P<0.05),其他处理拟南芥地上部分鲜质量和对照相比无显著差异(P>0.05)。所有处理中接种未灭活的Pseudomonassp.PM-1培养液的拟南芥地上部分鲜质量最大,相较于对照显著提高58.2%(P<0.05)。接种未灭活的Pseudomonassp.PM-1、未灭活的Enterobactersp.PM-2、未灭活的Enterobactersp.PM-5培养液的拟南芥地上部分干质量显著高于对照(P<0.05),其他处理拟南芥地上部分干质量和对照相比无显著差异(P>0.05)。所有处理中接种未灭活的Pseudomonassp.PM-1培养液的拟南芥地上部分干质量最大,相较于对照显著提高79.9%(P<0.05)。
接种未灭活的Pseudomonassp.PM-1、未灭活的Enterobactersp.PM-2、未灭活的Pseudomonassp.PN-14、未灭活的Enterobactersp.PM-5和灭活的Pseudomonassp.PM-1培养液的拟南芥地下部分干质量显著高于对照(P<0.05),其他处理拟南芥地下部分干质量和对照相比无显著差异(P>0.05)。所有处理中接种未灭活的Pseudomonassp.PM-1培养液的拟南芥地下部分干质量最大,相较于对照显著提高59.3%(P<0.05)。总体而言,溶解有机磷菌株中未灭活的Pseudomonassp.PM-1对拟南芥的促生作用最明显,具有较大开发潜力。
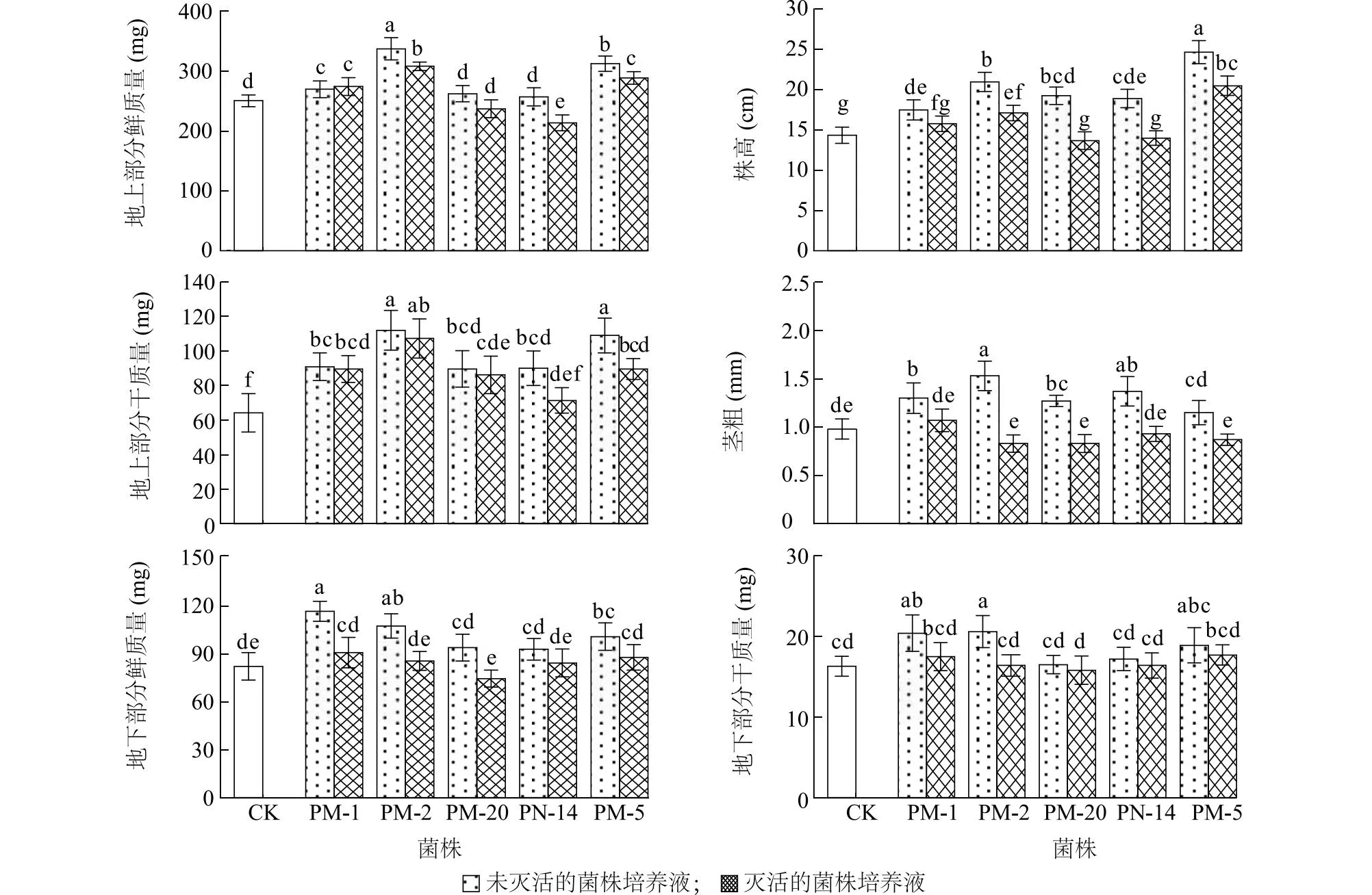
2.3.3 溶解无机磷菌株对盐碱胁迫下小麦的促生效果 所有处理中,接种未灭活的Enterobactersp.PM-9培养液的小麦地上部分鲜质量、株高、地上部分干质量、地下部分鲜质量、地下部分干质量最大(图6、图7)。接种未灭活的Enterobactersp.PM-9培养液的小麦地上部分鲜质量较对照显著提高40.3%(P<0.05),株高较对照显著提高18.1%(P<0.05),地上部分干质量较对照显著提高57.5%(P<0.05),地下部分鲜质量较对照显著提高39.0%(P<0.05),地下部分干质量较对照显著提高74.9%(P<0.05)。接种未灭活的Bacillussp.PN-2培养液的小麦茎粗最大,较对照显著提高18.1%。总体而言,溶解无机磷菌株中Enterobactersp.PM-9对盐碱胁迫下小麦的促生效果最佳。
2.3.4 溶解有机磷菌株对盐碱胁迫下小麦的促生效果 所有处理中,接种未灭活的Enterobactersp.PM-2培养液的小麦地上部分鲜质量、地上部分干质量、茎粗、地下部分干质量最大(图8)。接种未灭活的Enterobactersp.PM-2培养液的小麦地上部分鲜质量较对照显著提高34.7%(P<0.05),地上部分干质量较对照显著提高74.4(P<0.05),茎粗较对照显著提高56.1%(P<0.05),地下部分干质量较对照显著提高26.4%(P<0.05)。接种未灭活的Pseudomonassp.PM-1培养液的小麦地下部分鲜质量最大,较对照显著提高41.9%。接种未灭活的Enterobactersp.PM-5培养液的小麦株高最大,较对照显著提高71.9%。总体而言,溶解有机磷菌株中未灭活的Enterobactersp.PM-2的促生效果更突出。
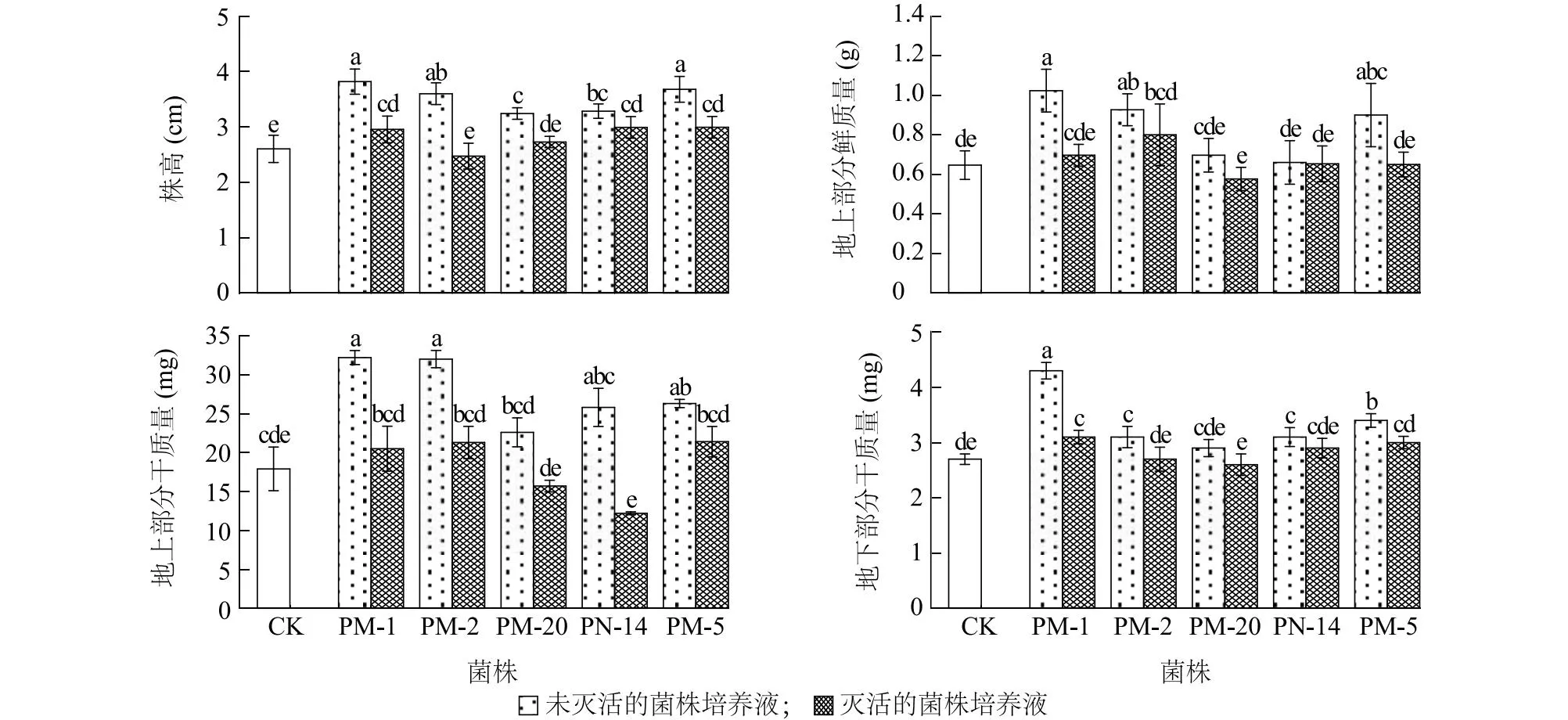
CK:对照,无菌LB培养基;PM-1、PM-2、PM-20、PN-14、PM-5见图2注。不同柱上标有不同小写字母表示差异显著(P<0.05)。
CK:对照,无菌LB培养基;PN-1、PN-2、PM-9、PM-13、PN-7见图2注。不同柱上标有不同小写字母表示差异显著(P<0.05)。

A图中从左到右为接种LB培养基、灭活的Bacillus sp.PN-2培养液、未灭活的Bacillus sp.PN-2培养液的小麦;B图中从左到右为接种LB培养基、灭活的Enterobacter sp.PM-9培养液、未灭活的Enterobacter sp.PM-9培养液的小麦。
3 讨 论
解磷菌的解磷活性对土壤磷素转化有重要意义,但不同植物因根系分泌物、地理生境等的差异,其根际微生物群落组成有较大差别,这势必会影响解磷菌的遗传多样性。孟建宇等[17]从内蒙古荒漠灌木根际土壤中分离的解磷菌分属6纲21属,以Bacillus为优势菌属;庄馥璐等[11]从苹果根际土壤中分离的解磷促生菌主要属于Pseudomonas和Enterobacter;杜慧慧等[18]从不同生境滇重楼根际土壤中筛选的解磷菌均属于Bacillus。本研究从旱生芦苇根际土壤中分离出的解磷菌包括肠杆菌属、假单胞菌属、不动杆菌属和芽孢杆菌属等7个属,以肠杆菌属占绝对数量优势,反映出不同生境的植物根际蕴藏的解磷菌种群有较大差异。相似的土壤质地、气候条件等环境因素趋于塑造相近的微生物群落。许芳芳[19]从内蒙古荒漠植物根际土壤中获得的耐盐碱解磷菌优势属,主要包括肠杆菌属、芽孢杆菌属和假单胞菌属;柳鑫鹏等[20]从松嫩平原盐碱土植物根际土壤中筛选的促生菌主要为不动杆菌属、假单胞菌属和肠杆菌属,与本研究结果有相似之处。说明肠杆菌属、不动杆菌属、芽孢杆菌属和假单胞菌属等作为重要的解磷菌资源,在荒漠盐碱土中广泛分布。
土壤速效磷含量是评价土壤供磷水平、确定磷肥用量、评估农田磷环境风险的重要指标,但不同细菌种类溶解无机磷和矿化有机磷的能力差异较大。陈岩岩等[21]分离自板栗根际土壤中的菌株BurkholderiacepaciaP6能够溶解无机磷、有机磷的量分别为75.98 mg/L、40.30 mg/L。骆韵涵等[22]从红树林根际土壤中筛选出2株溶解无机磷菌Bacilluscepacia NBRC14074和BacilluspumilusATCC7061,溶磷量分别为409.9 mg/L和90.79 mg/L。王艳霞等[23]从田菁根际土壤中分离的肠杆菌Enterobactersp.N102能够溶解无机磷和有机磷的量分别为36.29 mg/L和1.23 mg/L。而本研究中有机磷溶磷量超过30 mg/L的菌株有5株,无机磷溶磷量超过400 mg/L的有12株,与上述报道相比具有更高的解磷能力。此外,本研究结果表明,菌株培养液pH值与菌株溶解无机磷能力呈显著负相关,与骆韵涵等[22]的研究结果一致。有研究结果表明,溶解无机磷菌株在培养过程中会产生多种有机酸,导致培养液的pH值下降[24]。因此推测本研究中解磷菌的溶磷过程中伴随有机酸的积累,菌株通过酸化作用释放磷酸三钙中的磷元素。而盐碱土壤中,解磷菌富集的有机酸能较好地降低盐碱土的pH值,缓解高盐碱环境的胁迫。Al-enazy等[25]发现,耐盐碱解磷菌菌剂配施磷石膏,提高了碱化土壤质量,土壤酶活和理化性质得到显著改善。而有机磷的矿化主要依靠菌株分泌胞外磷酸酶,把有机磷水解为简单的无机磷酸盐来增加土壤中有效磷含量,对土壤pH值影响相对较小。不足的是,本研究目前仅通过盆栽试验评价了解磷微生物的生物学效应,后期会进一步考察其对土壤中磷素形态转化及植株磷素吸收的影响,为解磷菌改良盐碱土壤提供更多理论支持。
一般的解磷微生物虽具有促生特性,但耐盐碱能力有限,在高盐碱土壤中的存活力较低,严重影响了其促生能力的发挥。Bacillussp.PN-2、Paenibacillussp.PM-1等对拟南芥表现出促生效应,进一步发现其对盐碱土种植的小麦也有促生作用,但能否最终实际应用到大田有待后续验证。由于本试验的供试土壤为事先灭菌的,最大程度排除了土壤中土著菌群、原生动物、线虫等因素的干扰,更能客观反映菌株对作物的促生作用。但是在野外田间条件下,扰动微生物在根际定殖的因素错综复杂,涉及根系分泌物的种类和数量、植物生长状况、细菌营养型、趋化性及自我调节机制等。如马铃薯根系分泌物和酚酸能吸引萎缩芽孢杆菌QHZ3在根际定殖[26],稗草根系分泌物对根际微生物的定殖有选择性[27],植物根系构型的改变可诱导不同种群的定殖[28],根系生长速率影响假单胞菌的积累[29]。此外,微生物的定殖与土壤温度、质地、含水量、含氧量等非生物因素也有密切关系[30]。鉴于实验室与田间自然生境的巨大差异,考虑到后期的实际应用,追踪、比较解磷菌在控制条件及野外的定殖动态有重要意义。
CK:对照,无菌LB培养基;PM-1、PM-2、PM-20、PN-14、PM-5见图2注。不同柱上标有不同小写字母表示差异显著(P<0.05)。
盐碱化问题是制约新疆,乃至中国西北地区土地资源深度利用的重要限制因素[31-32]。但在这类生境中却生长着抗逆性极强的植物种质,其以强悍的耐盐碱特性成为不同盐碱化地区的优势植被。其根际促生菌可释放多种信号分子来改变植物生理状态,增加对恶劣环境的抵抗力[33-35]。因此,对盐碱地土著植物根际土壤中解磷菌进行筛选,有助于发掘新的功能菌株资源,具有重要的经济和生态效益。此外有研究结果表明[36],根际促生菌能介导根际环境中整个微生物群落结构,使其与植物形成良性互作关系,以此促进植物生长[37]。芦苇的抗逆性强,在传统淡水作物无法生长的盐碱地上仍生长良好,具有短期成型、快速成景、生物量高的优点,其广泛的适应性和强悍的抗逆性与根际促生菌的互作机制有待进一步探究。
4 结 论
本试验从新疆克孜勒苏柯尔克孜自治州盐碱地旱生芦苇根际土壤中筛选出47株解磷细菌,其中溶解无机磷菌株32株,溶磷量为55.8~722.3 mg/L,溶磷量与发酵液pH值呈显著负相关;溶解有机磷菌株37株,溶磷量为11.8~34.4 mg/L。所有菌株隶属于7个属,以肠杆菌属(Enterobacter)占绝对优势。盆栽试验结果表明,解磷菌株对非盐碱胁迫下生长的拟南芥及盐碱胁迫下生长的小麦幼苗有促生作用,解磷菌株有效促进了拟南芥植株的生长和根系发育,以芽孢杆菌Bacillussp.PN-2和类芽孢杆菌Paenibacillussp.PM-1对非盐碱胁迫下拟南芥植株的促生作用最突出,以Enterobactersp.PM-9和Enterobactersp.PM-2对盐碱胁迫下小麦的促生作用最突出。本研究筛选出的解磷菌株在盐碱地植物促生方面具有一定应用潜力。
