基于网络药理学及分子对接技术探讨黄芪-丹参治疗缺血性脑卒中的作用机制
2024-03-20黄丽娜蒋希成
杨 毅,黄丽娜,王 博,李 斌,蒋希成
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
缺血性脑卒中(ischemic stroke,IS)是因脑内动脉闭塞,脑组织血液与氧气供应障碍而出现猝然昏仆、半身不遂、言语謇涩、偏身麻木等病理症状的疾病[1],其发病率、复发率、病死率和致残率近年来持续处于较高水平,已成为我国成年人致残、致死的首位病因[2],给社会与家庭造成了沉重负担。目前西药治疗IS的主要机制是改善病变处血液循环,调控血压、血脂等[3],但服药时间较长,可能会出现耐药性及肝肾损伤、横纹肌溶解等不良反应,具有潜在的治疗风险。利用中医药治疗IS可发挥其安全、有效、稳定的优势。中医药对IS的研究历史悠久,根据其证候演变规律总结病变核心是“气虚血瘀”,其中“气虚”为发病之本,“血瘀”是发展之要[4]。黄芪和丹参是中医临床益气活血使用频率较高的重要药对,黄芪益气补虚,为“补气之最”,丹参“补新血,调经脉”,为调血首药[5]。临床研究证实黄芪-丹参合用治疗急性脑梗死患者能够恢复神经功能且改善预后[6]。然而黄芪-丹参治疗IS的分子机制尚未明确。本研究以中医药整合药理学平台(TCMIP)v 2.0和GEO数据库为靶点信息挖掘对象,建立黄芪-丹参治疗IS靶点蛋白互作网络(PPI)、成分-靶点网络,拓扑数据分析获得关键成分及核心靶点,并通过计算二者的结合能以验证预测结果,从而阐释黄芪-丹参治疗IS的分子机制,为中医药的治疗作用提供证据支持。
1 材料与方法
1.1活性成分及靶标的筛选 TCMIP v2.0(http:www.tcmip.cn/TCMIP/index.php/Home/Login/login.html)平台是以定量评估类药性(quantitative estimate of drug-likeness,QED)值评估各药物成分的相似性,将Tanimoto系数下的相似度算法与FDA上市药物的相似性评分赋值于成分靶点。平台以0.49≤QED≤1即强与中等类药性成分作为药物的活性成分,以0.8≤相似性评分≤1作为活性成分的潜在作用靶点。在平台中分别输入“黄芪”和“丹参”,检索并收集二者的活性成分及药物靶点信息。
1.2IS芯片选取及差异基因筛选 以“ischemic stroke”为关键词在GEO数据库(http://www.ncbi.nlm.nih.gov/gds)中检索,选取到以“Homo sapiens”为物种、以“DataSet”为条目类型的基因表达谱GSE22255。通过GEO2R进行数据分析,以P.Value<0.05且|lgFC|≥0.5为筛选标准,选取IS的显著性差异表达基因。
1.3关键靶点筛选与PPI网络构建 将黄芪-丹参的药物靶点和IS的疾病靶点取交集后录入STRING(https://cn.string-db.org)网站在线分析,物种选项设置为“Homo sapiens”,互作阈值(confidence score)≥0.4,构建PPI网络。
1.4网络构建与核心成分、靶点筛选 PPI及成分-靶点-通路网络通过Cytoscape(version 3.9.0)软件进行可视化展示,并通过Network Analyzer功能分析网络性质,筛选黄芪-丹参的关键成分。MCODE和cytoHubba插件筛选核心靶点,在MCODE插件中设置degree cutoff=2,node score cutoff=0.2,k-score=2,max.depth=100,以score值最高模块的seed靶点定义为潜在核心靶点。在Cytohubba插件中分别以MCC、MNC、Radaility、EPC、Degree、Closeness为算法分别得到与IS发生相关的TOP 10靶点,取6种算法的交集为潜在核心靶点。2种插件得到的结果取并集为作为核心靶点。
1.5分子对接 在PubChem(http://pubchem.ncbi.nlm.gov)和RCSB PDB(http://www.rcsb.org)数据库中下载关键成分和核心靶点的结构文件,并分别转换为sdf和pdb格式。应用AutoDock4.2软件计算关键成分与核心靶点的对节能值,验证二者之间的对接情况。
1.6GO与KEGG富集分析 使用R语言程序和Bioconductor数据库中的“org. Hs. eg. db”人类数据库和“clusterProfiler”“DOSE”“stringi”“enrichplot”“ggplot2”等包对黄芪-丹参治疗IS的关键靶点进行基因本体论(GO)和京都基因和基因组百科全书(KEGG)富集分析。
2 结 果
2.1活性成分及靶点筛选 在TCMIP数据库中共检索到111种黄芪和丹参的有效成分,基于以上成分共得到靶点374个。
2.2差异基因筛选 在GSE22255基因谱中共筛选差异基因1 210个,其中表达上调基因934个,表达下调基因276个。前40位IS相关差异基因的聚类热图和火山图见图1。

图1 前40位缺血性脑卒中相关差异基因表达分析图
2.3PPI网络分析及靶点筛选 黄芪-丹参的药物靶点和IS的疾病靶点中共有26个交集靶点。基于STRING网站对黄芪-丹参治疗IS的26个交集靶点构建PPI网络,含有20个节点和92条边,平均连接度为4.60,见图2。通过MCODE及cytoHubba插件筛选出SYK、IL1B、CASP3、ACOX1、HMGCR、TNF、ACTB共7个核心靶点,见图3及图4。
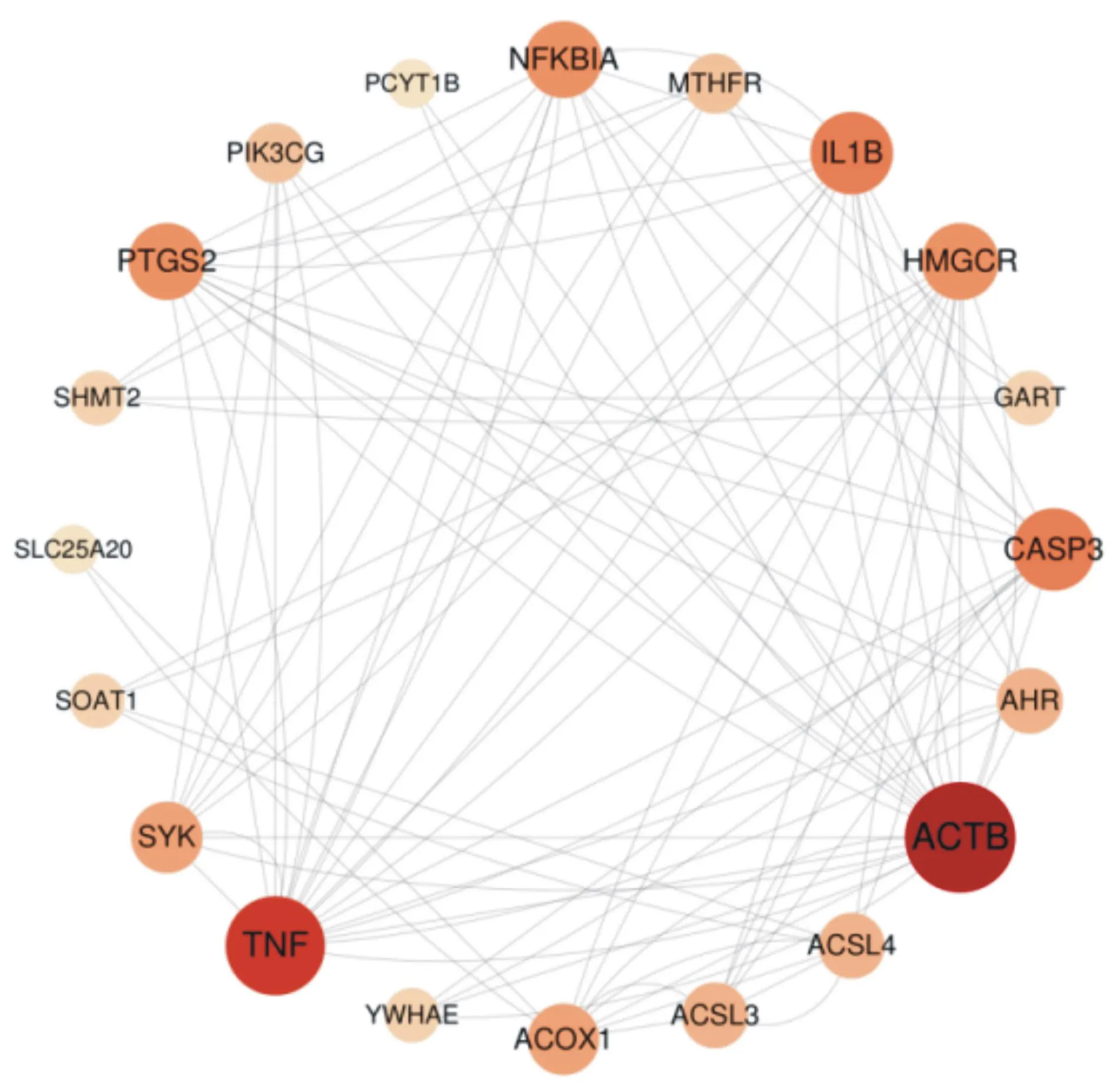
图2 黄芪-丹参治疗缺血性脑卒中的PPI网络
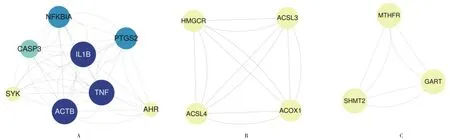
A. score=6.571,seed=TNF;B. Score=4.000,seed=HMCGR;C. Score=3.000,Seed=MTHFR
2.4成分-靶点网络的构建 黄芪-丹参治疗IS的成分-靶点网络图见图5,其中含49个结点,69条边,结点中含中药结点2个,成分结点21个,靶点结点26个,平均连接度2.816。根据拓扑学性质筛选到6个关键成分,见表1。关键成分包括黄芩苷、棕榈酸、华良姜素、黄芪甲苷、4-羟基香豆素、胡萝卜苷。
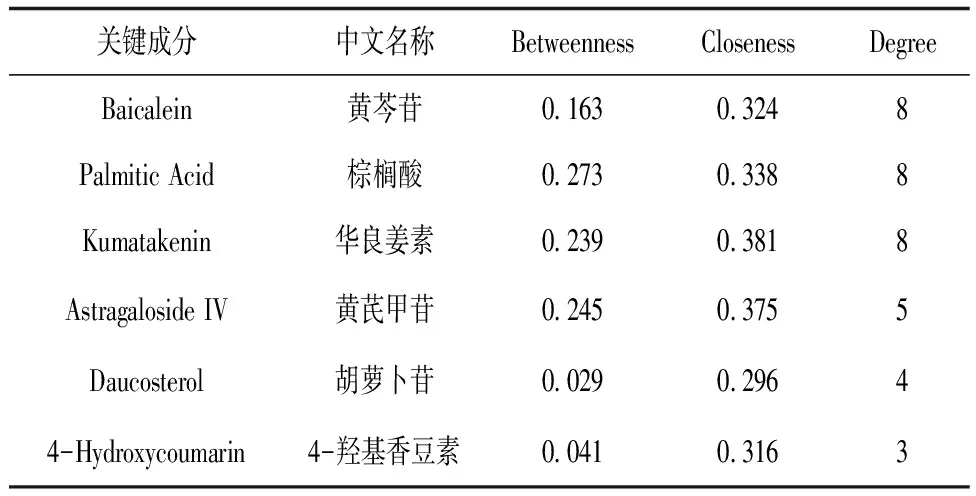
表1 黄芪-丹参治疗缺血性脑卒中关键成分
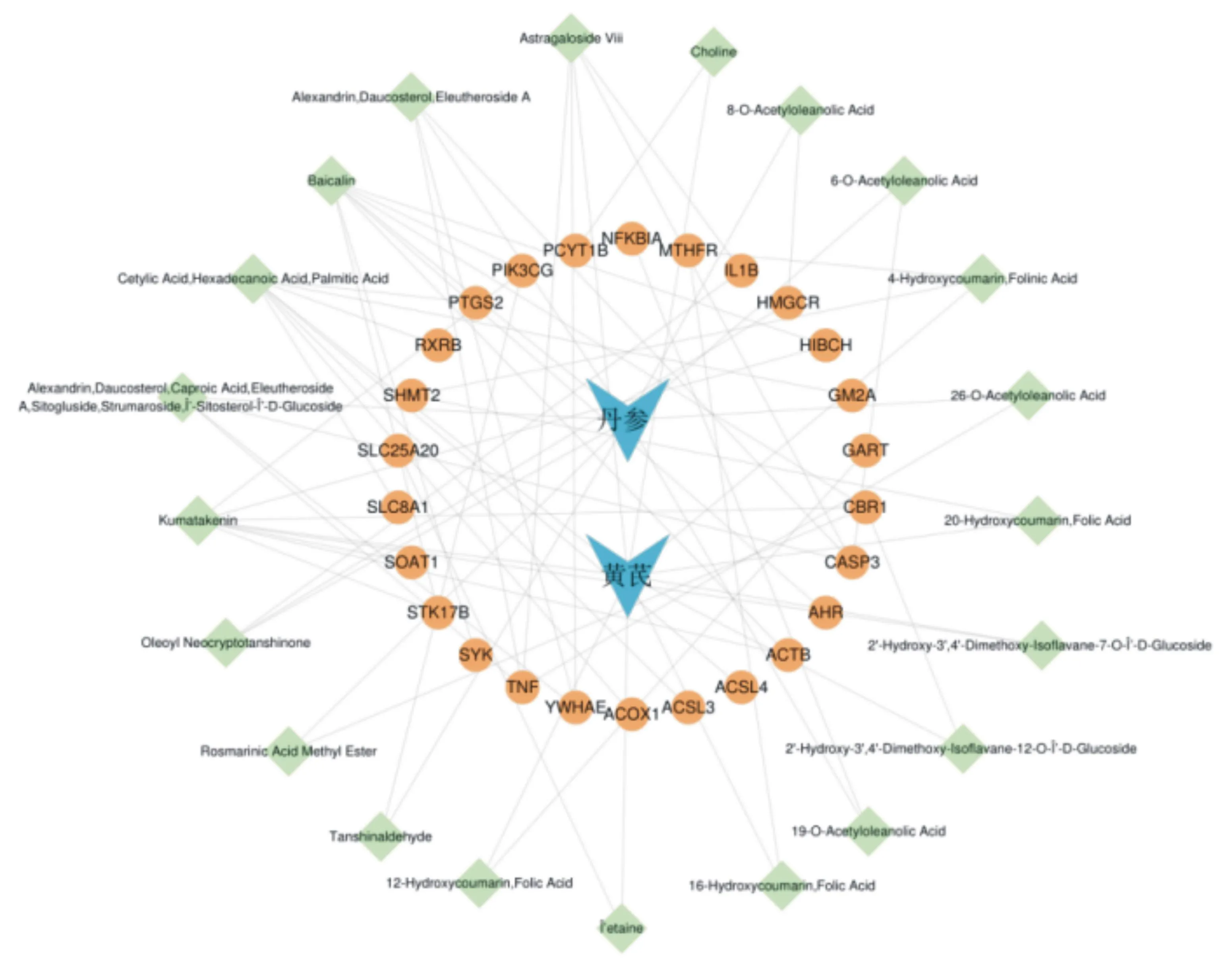
图5 黄芪-丹参治疗缺血性脑卒中成分-靶点网络
2.5分子对接结果 将黄芩苷、胡萝卜苷、华良姜素、棕榈酸、黄芪甲苷、4羟基香豆素6个关键成分和7个核心靶点蛋白SYK、IL1B、CASP3、AXOX1、HMGCR、TNF、ACTB进行分子对接。以结合能(binding energy)<0 kcal/mol认为分子蛋白质自发结合并相互作用,当结合能越低时表明分子构象越稳定,图6展示了结合能值热图。选取结合能≤-5 kcal/mol为黄芪-丹参治疗IS的关键成分筛选依据,并通过PyMOL软件将关键成分与核心靶点的结合进行3D展示,见图7。
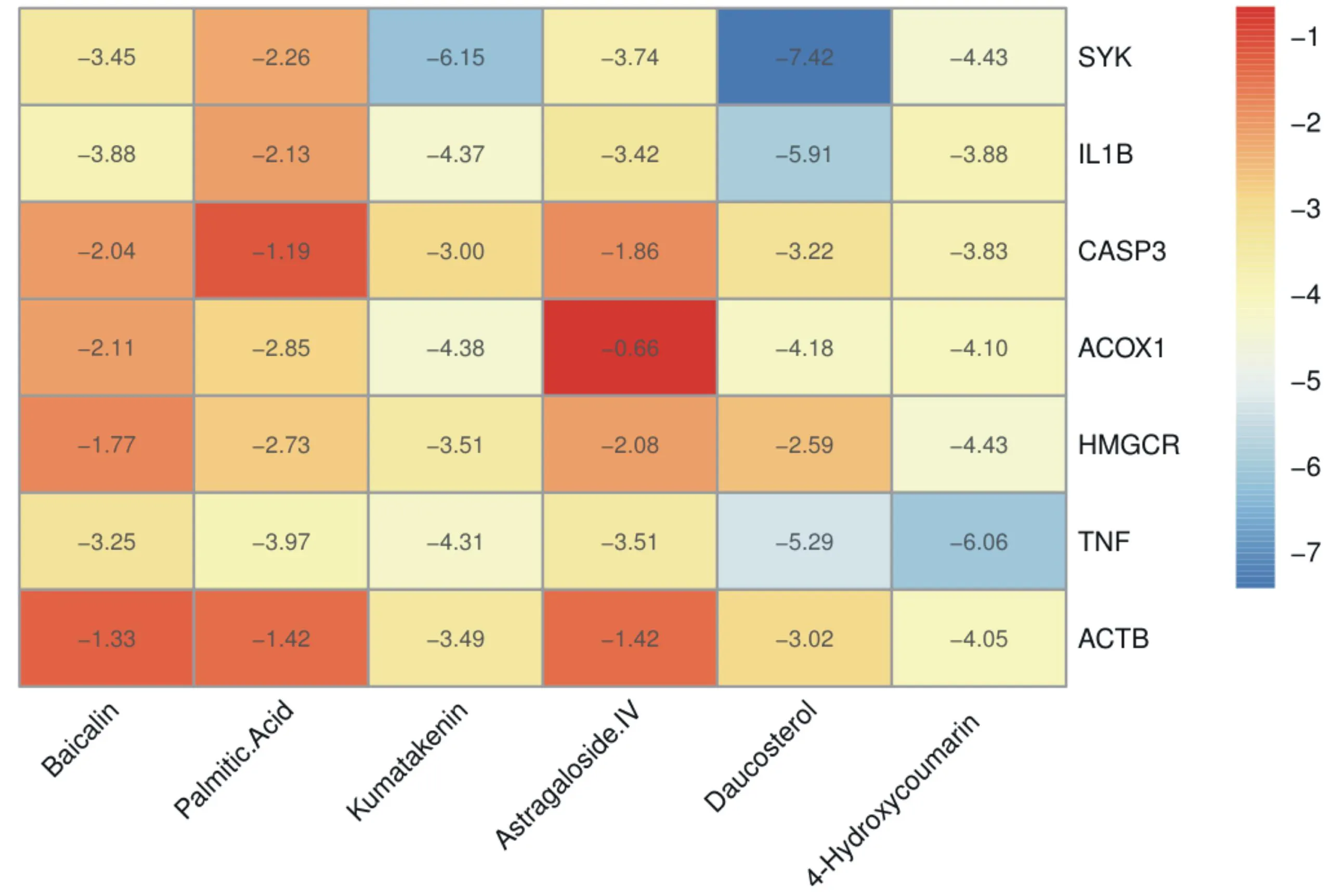
图6 分子对接结合能力热图
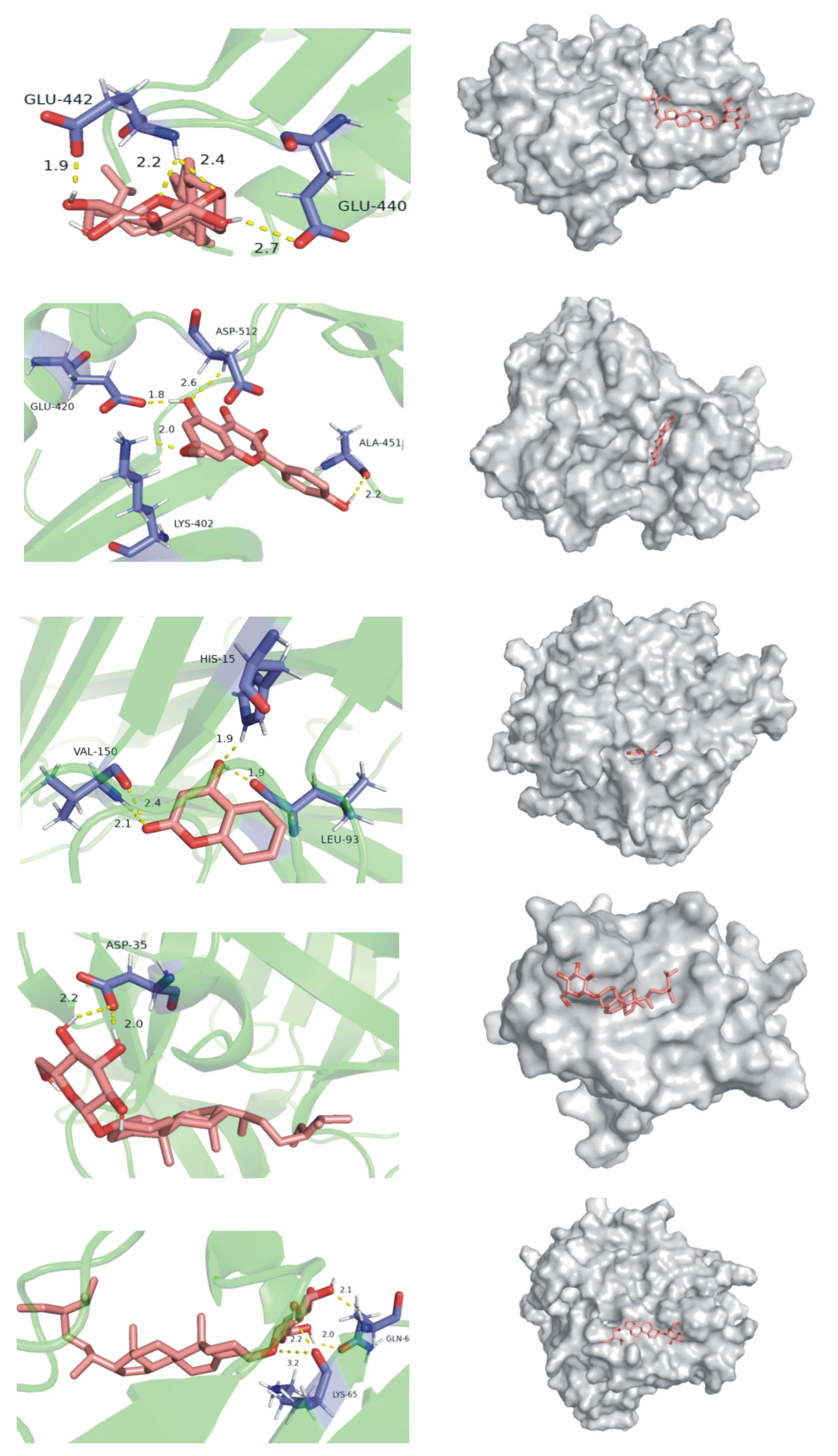
SYK-Daucosterol(binding energy=-7.42 kcal/mol);SYK-Kumatakenin(binding energy=-6.15 kcal/mol);TNF-4-Hydroxycoumarin(binding energy=-6.06 kcal/mol);IL1B-Daucosterol(binding energy=-5.91 kcal/mol);TNF-Daucosterol(binding energy=-5.29 kcal/mol)
2.6GO和KEGG富集分析结果 以2.3结果中的26个交集靶点为分析对象,以p.value<0.05为筛选标准进行GO富集分析,见图8。黄芪-丹参药对治疗IS的生物过程(BP)条目的主要涉及脂质定位、蛋白质丝氨酸/苏氨酸激酶活性调节、脂质转运、急性炎症反应正向调控、脂肪酸转运等。分子功能(MF)条目主要涉及花生酮辅酶A连接酶活性、长链脂肪酸辅酶A连接酶活性、磷脂酶激活剂活性、脂肪酶激活剂活性等。细胞组成(CC)主要有过氧化物酶体膜、微体膜、过氧化物酶体、微体。为核心靶点参与的相关信号通路,以p.value<0.05为筛选标准进行KEGG通路分析,见图9。筛选出的通路主要包括:抗叶酸剂、一碳单位池、脂肪细胞因子信号通路、PPAR信号通路等。
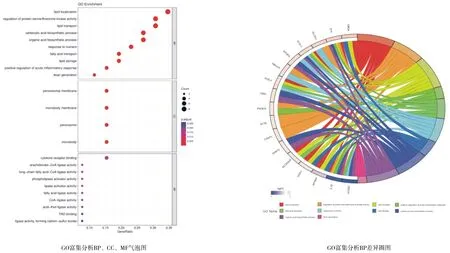
图8 核心靶点的GO功能富集分析

图9 核心靶点KEGG通路富集分析
3 讨 论
黄芪-丹参是临床常用的中药材,是以其补气活血之功治疗气虚血瘀证的典型药对。本研究通过中医药整合药理学平台(TCMIP v2.0)、GEO数据库及分子对接技术建立中药、疾病与作用通路的网络模型,探讨黄芪-丹参治疗IS的潜在分子机制。
通过黄芪-丹参治疗IS的PPI网络拓扑参数分析,得到SYK、IL1B、CASP3、ACOX1、HMGCR、TNF、ACTB共7个重要靶点蛋白。SYK信号通路参与ROS的产生[7],导致促炎基因TNF-α、COX-2和iNOS的表达[8]。研究发现SYK在IS后的病变组织及氧糖剥夺/复氧小胶质细胞中表达升高[9],而经过SYK抑制剂治疗后,IS模型鼠的神经功能评分和病灶面积均有改善[10],细胞中的炎性因子TNF-α和氧化应激因子iNOS表达显著下降[9]。IL-1β能够损伤神经细胞的完整性,其机制是诱导巨噬细胞或单核细胞浸润受损的神经元细胞,并提高自由基水平进而发生氧化应激障碍[11]。在脑缺血状态下Caspase-3可放大蛋白酶级联反应,Caspase蛋白的激活与过表达可直接诱导凋亡过程[12-13]。TNF-α是主要由巨噬细胞产生的早期促炎因子[14]。TNF-α通过激活免疫系统,使IS病灶组织中的白细胞数量增多,进而导致局部炎症加重,内皮细胞凋亡以及脑梗死体积增加[15]。ACTB编码神经细胞骨架蛋白,对神经细胞的发育及功能发挥重要作用[16]。此外,ACTB影响血管发育及血栓形成,其基因的多态性参与IS的发病过程[17]。ACOX1能够调节脂肪酸-β氧化过程,促进脂肪酸代谢[18],而脂质对于神经元的发育、突触的可塑性和功能至关重要[19],是维持神经胶质细胞和轴突正常生理功能的必需成分[20],缺失后会导致神经系统功能快速衰退[21]。胆固醇代谢障碍导致的动脉粥样硬化是IS发病最常见诱因[22],由于胆固醇在人体内的合成速率受HMGCR的调控,故HMGCR也影响IS的发生。
黄芪-丹参治疗IS的关键成分包括黄芩苷、胡萝卜苷、华良姜素、棕榈酸、黄芪甲苷、4羟基香豆素。黄芩苷属于黄酮苷类化合物,侧重保护IS的神经元细胞,发挥抗凋亡、抗炎、抗氧化应激等作用[23]。动物实验证实黄芩苷可改善脑缺血再灌注损伤模型大鼠脑水肿程度,可能与通过抑制星形胶质细胞肿胀并抑制TRPV4和AQP4的通道开放有关[24]。棕榈酸是人体重要的饱和脂肪酸,可诱导炎症基因表达引起内皮细胞胰岛素抵抗及eNOS脱偶联,降低NO合成和释放[25],促使动脉粥样硬化,是内皮细胞功能紊乱的重要因素[26],也是诱发IS的潜在病因。黄芪甲苷是治疗IS的重要活性成分[27],它不但可以促进血管生成从而改善脑血流量,又能作用于病变组织以抑制细胞凋亡与炎症反应等功能改善神经功能损伤[28]。胡萝卜苷是在植物中广泛存在的甾醇糖苷[29],具有抗炎[30]、抗氧化作用[31],为IS患者的神经保护提供了保障。同时,胡萝卜苷的降血糖作用也间接降低了IS的发生[32]。
核心基因GO功能富集分析的生物学过程条目中,P-value最小值为脂质定位。脂质的种类繁多,功能多样,能够储存能量、传递细胞信号及构成生物膜骨架等。过多的脂肪堆积于内脏可改变体内脂肪因子谱,提高血浆黏度,进而导致血液流变学异常,血管钙化,促进动脉粥样硬化形成[33]。过多的内脏脂肪也能够破坏人体信号系统,使其错误传递,导致糖脂代谢紊乱,增加了动脉粥样硬化的发生概率[34]。脂质参与大脑对生命活动的精准调控[34],如三磷酸肌醇[35]、二酰基甘油[36]等第二信使分子均参与了信号通路传导,并参与能量供应,对中枢神经系统具有重要调节作用。脑卒中发生后,脑组织迅速从细胞膜上大量释放PUFAs,产生多种脂质介质,如二十烷类化合物等。这些介质对中风后的脑组织具有神经保护作用,因此对于中风的预后及康复具有重要作用。脂质与脑的病理变化也关系密切,如急性脑损伤及其继发的炎症反应通常伴随氧化磷脂与氧化游离脂肪酸的升高[37]。脂质在大脑内所涵盖的种类多样、比例各异,并广泛参与IS的病理进程[38],对IS的发生及发展具有重要意义。
核心靶点KEGG通路富集分析结果显示,P-value最小值为叶酸拮抗剂抵抗。叶酸在体内经酶作用转化为5-甲基四氢叶酸(5-MTHF),后经脱甲基形成四氢叶酸(THF),THF与多种一碳单位结合参与人体代谢。若一碳单位减少则致使5-MTHF和同型半胱氨酸(Hcy)再次甲基化的减少,最终导致Hcy在体内堆积[39]。血浆高浓度Hcy是IS发生的重要诱因[40],机制是血浆中的Hcy经自氧化反应后生成同型半胱氨酸二硫化物、硫化脂及大量氧自由基,损伤血管内皮细胞,影响血管内皮功能,进而发生脑血管疾病[41]。同时,血管内皮细胞在长时间接触高浓度Hcy后其自身功能发生失调,血栓调控因子生成受阻,凝血因子大量生成导致血栓[42],是诱发IS的潜在因素。
分子对接能值表明黄芪-丹参的关键成分黄芩苷、胡萝卜苷、华良姜素、棕榈酸、黄芪甲苷、4羟基香豆素和核心靶点蛋白SYK、IL1B、CASP3、AXOX1、HMGCR、TNF、ACTB均能自发结合,其中胡萝卜苷与SYK、IL1B、TNF,华良姜素与SYK、4羟基香豆素与TNF具有较好的结合活性。基于上述研究构建黄芪-丹参治疗IS的中药-成分-靶点-通路网络,通过网络药理分析及分子对接验证,从分子层面阐述了黄芪-丹参对IS的治疗机制。
本研究利用网络药理学方法探讨黄芪-丹参治疗IS的作用机制,通过构建靶点、成分和通路的关系网络,证实黄芪-丹参中多种活性成分包含的多个靶点蛋白,能够调控叶酸代谢、脂肪代谢、炎症反应等信号通路,即以多成分、多靶点、多通路、多机制发挥对IS的治疗作用。
利益冲突:所有作者均声明不存在利益冲突。
