参附注射液对脓毒症大鼠血管内皮损伤的影响及机制
2024-03-20刘丰进郑鑫寅
郭 倩,刘丰进,康 海,郑鑫寅
(1. 青岛大学医学部,山东 青岛 266300;2. 青岛大学附属烟台毓璜顶医院,山东 烟台 264000)
脓毒症时全身炎症反应可导致多器官损害,其中作为维持正常血管通透性和凝血功能的血管内皮屏障完整性被破坏,导致血管通透性增加, 引起血管渗漏、循环血容量减少、凝血功能障碍、微血栓形成等。因此, 维持血管内皮的完整性, 抑制凝血功能的异常是脓毒症治疗的重要环节[1-3]。参附注射液源于经典名方参附汤,具有抗炎、抗氧化以及改善能量代谢等作用,被《中国严重脓毒症/脓毒性休克指南》推荐用于治疗脓毒症[4]。既往研究证实,参附注射液可以改善休克患者血流动力学与内皮功能,降低血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6) 、C反应蛋白(CRP)水平,减轻炎症反应[5];还可保护冠心病合并心力衰竭患者血管内皮细胞,抑制血小板活化,抗血管炎症反应[6]。本研究探讨了参附注射液对盲肠结扎穿孔制备的脓毒症大鼠血管内皮的保护作用及其可能机制,为脓毒症的治疗提供新的干预手段。
1 实验材料与方法
1.1动物 48只SPF级7~8周龄成年雄性SD大鼠,购自济南朋悦有限公司,许可证号:SCXY(鲁)2022 0006。所有动物饲养在21~23 ℃,30%~40%湿度和12 h明暗循环环境中,饲养期间大鼠可随意获取食物和水。本研究经青岛大学第四临床医学院烟台毓璜顶医院医学伦理委员会批准[烟毓医伦审(2023-255)号] ,所有操作符合国家颁布的有关实验动物福利与伦理的相关要求。
1.2主要试剂及仪器 兔抗大鼠核因子κB抑制蛋白α(IKBα)抗体、p-IKBα抗体、核因子-κB(NF-κB)抗体、p-NF-κB p65抗体(Cell Signaling Technology公司),TNF-α、白细胞介素-10(IL-10)、组织因子(TF)、血栓调节蛋白(TM)、血管性血友病因子(vWF)、纤溶酶原激活物抑制剂-1(PAI-1)ELISA检测试剂盒(北京索莱宝科技有限公司);正置显微镜(LEICA DMLB2),OD450酶标仪(Multiskau FC),高速冷冻离心机(ST16R),超低温冰箱,冰冻切片机(LEICA CM3050S),组织研磨仪(ZHFB-CL-48),化学发光成像分析系统(ChemiScope6200Touch)。
1.3实验方法 将预饲养7 d的48只大鼠按随机数字法分为假手术组、脓毒症组和参附注射液组,每组16只。脓毒症组和参附注射液组大鼠均行盲肠结扎穿孔术[7]:术前禁食12 h,自由饮水,戊巴比妥钠腹腔注射麻醉大鼠后腹部备皮,沿腹中线做长2 cm的切口暴露盲肠,用3-0丝线高位结扎盲肠(盲肠的35%),并用18G针头从盲肠系膜缘向对侧贯穿,挤出少量肠内容物后还纳盲肠,缝合开腹部位。假手术组仅开腹翻动盲肠,不进行结扎、穿孔。每组操作结束后均予以皮下注射预热生理盐水(37 ℃,50 mL/kg)复苏大鼠。术后将各组大鼠放回笼中,自由获取食物和水。术后1 h开始,参附注射液组给予参附注射液[华润三九(雅安)药业有限公司、国药准字Z51020664]6 mL/kg腹腔注射(考虑操作难度及给药剂量,故选择药物吸收与静脉给药相似、生物利用度稍差于静脉给药,但操作更简便的腹腔注射),假手术组和脓毒症组在相同时间点给予等体积的生理盐水腹腔注射,大鼠给药剂量通过人与动物等效剂量换算确定,大鼠给药时间均每隔12 h 1次。
1.4观察指标及方法
1.4.1大鼠行为学表现及存活率 从大鼠术后清醒开始,实时观察大鼠的精神状态、饮食、排便、对刺激的反应、活动等行为学表现,记录各组大鼠存活时间,计算各组大鼠术后48 h存活率。
1.4.2肠管肉眼所见及主动脉组织病理形态 术后48 h,处死每组存活大鼠,开腹观察肠管情况;开胸取部分主动脉组织,用OCT胶包埋,进行冰冻切片(切片厚度10 μm)。按HE试剂盒操作流程进行固定、染色、分化、脱水、透明、封片操作后,光镜下观察。
1.4.3血清炎症因子及血管损伤、凝血系统相关指标水平 取术后48 h各组存活大鼠心室血,置于离心管中室温静置30 min后,用低温高速台式低温离心机(4 ℃、3 000 r/min)离心10 min,取上清液保存于-80 ℃冰箱中,按TNF-α、IL-10、TF、TM、vWF、PAI-1试剂盒操作流程进行稀释、加样、洗板,加入工作液后再次洗板,室温暗处反应后加入终止液,经酶标仪测吸光度值。
1.4.4主动脉组织中NF-κB信号通路相关蛋白表达情况 采用Western blot法检测:取术后48 h各组存活大鼠主动脉组织,加入高效RIPA裂解液,于组织研磨仪中匀浆2 min,冰上放30 min,然后4 ℃下10 000 r/min离心10 min,将上清移至另一预冷的EP管中,沉淀弃之,BCA 法测定蛋白含量后,将剩余蛋白样品加入5×上样缓冲液,沸水中煮5 min,而后进行SDS-PAGE电泳,转膜,封闭,蛋白样品中分别滴加兔抗大鼠p- NF-κB p65(1∶1 000)、NF-κBp65(1∶1000)、p-IKBα(1∶1000)、IKBα(1∶1 000)和GAPDH(1∶5 000)一抗4 ℃孵育过夜;第2天加入对应的羊抗兔二抗,摇床室温孵育1 h。ECL发光显色,扫描。用Image J软件计算目的蛋白的相对表达量,其中p- NF-κB p65、p-IKBα以和总蛋白的比值表示。
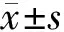
2 结 果
2.1大鼠行为学表现及存活率 假手术组大鼠毛发均匀有光泽,反应敏捷,精神、食欲、大小便均正常。脓毒症组大鼠毛发束立,身体蜷缩,对外界反应迟钝,部分大鼠扎堆取暖,不活动,不进食、进水,腹泻,鼻及眼部可见渗血。与脓毒症组比较,参附注射液组大鼠精神状态、毛发状态、活动度、腹泻、鼻及眼部渗血等多种情况均有明显好转。造模12 h后开始出现死亡大鼠,参附注射液组干预后死亡大鼠减少,术后48 h假手术组大鼠均存活,脓毒症组存活6只(37.5%),参附注射液组存活10只(62.5%),参附注射液组大鼠存活率明显高于脓毒症组(P<0.05)。见图1。
图1 假手术组和脓毒症各组大鼠48 h存活率
2.2大鼠肠管肉眼所见及主动脉组织病理形态假手术组剖开腹腔可见肠管结构正常,无粘连水肿,颜色正常;光镜下显示主动脉内膜光滑,内膜下细胞排列整齐,内弹力层和中层平滑肌层次分明。脓毒症组肠道黏膜充血水肿、坏死,肠管与周围器官包裹粘连,不易剥离,有恶臭味;光镜下显示主动脉组织染色不均,内皮细胞增生、肿胀、脱落,内弹力膜断裂,平滑肌排列紊乱,炎症细胞浸润。参附注射液组肠道水肿、坏死情况及光镜下主动脉病理改变较脓毒症组减轻。见图2。

图2 假手术组和脓毒症各组大鼠术后48 h主动脉组织病理形态(HE染色,×400)
2.3大鼠血清炎性因子水平 脓毒症组和参附注射液组大鼠外周血中TNF-α、IL-10水平均明显高于假手术组(P均<0.05),参附注射液组外周血中TNF-α、IL-10水平均明显低于脓毒症组(P均<0.05)。见图3。
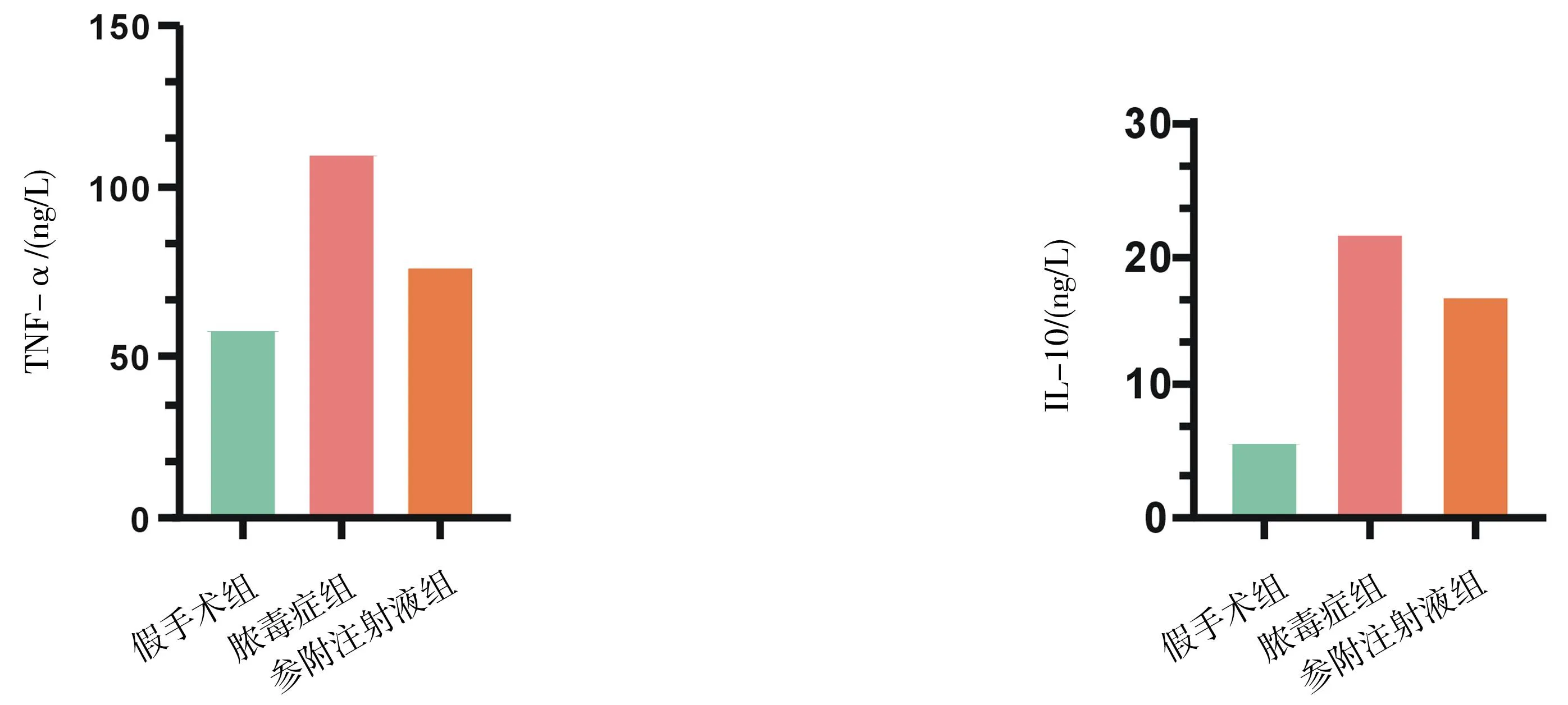
图3 假手术组和脓毒症各组大鼠术后48 h外周血中TNF-α、IL-10水平
2.4大鼠血清血管内皮损伤及凝血指标水平 脓毒症组和参附注射液组大鼠外周血中TF、TM、vWF、PAI-1水平均明显高于假手术组(P均<0.05),参附注射液组外周血中TF、TM、vWF、PAI-1水平均明显低于脓毒症组(P均<0.05)。见图4。

图4 假手术组和脓毒症各组大鼠术后48 h外周血中TF、TM、vWF、PAI-1水平
2.5大鼠主动脉组织中IKBα、NF-κB p65及其磷
酸化蛋白表达情况 脓毒症组和参附注射液组大鼠主动脉组织中p-IKBα、p-NF-κB p65蛋白相对表达量均明显高于假手术组(P均<0.05),参附注射液组主动脉组织中p-IKBα、p-NF-κB p65蛋白相对表达量均明显低于脓毒症组(P均<0.05)。见图5。

图5 假手术组和脓毒症各组大鼠术后48 h主动脉组织中IKBα、NF-κB p65及其磷酸化蛋白表达情况
3 讨 论
脓毒症时机体炎症反应被激活,细胞释放出大量炎性介质,对组织和器官造成损伤,其中血管内皮是脓毒症病原体及其毒素破坏的关键宿主靶点之一[8]。大量的炎性介质附着于血管壁内皮细胞,使内皮细胞结构被破坏,进而释放TF、vWF等凝血系统相关物质,影响凝血功能[3]。既往研究显示,约20%脓毒症患者的死亡原因与血管内皮功能紊乱相关[9]。参附注射液在近年来的研究中越来越多地被证实具有抗氧自由基、减轻钙超载、抑制中性粒细胞激活和炎症介质释放的作用,可以改善脓毒症及脓毒性休克患者血流动力学,缓解炎症反应,可能具有保护血管内皮以改善微循环障碍等功效[10];体外实验研究发现其可能通过抑制HMGB1/NF-κB信号通路的活化,从而减少炎症因子的分泌[11]。本研究旨在通过动物实验进一步明确参附注射液是否具有血管保护作用及其可能机制。
NF-κB的上游因子通过识别多种内源性配体及细胞外基质的某些成分,活化NF-κB信号通路,NF-κB进入细胞核,调节促炎基因等相关基因的转录,促进TNF-α、IL-6、IL-1、IL-8等多种炎性因子的活化和表达,介导炎症损伤。TNF-α作为机体受到有害刺激后最初分泌的重要炎性因子,在炎症级联反应中最先被激活,可启动NF-κB信号通路活化后炎症级联反应,进一步促进IL-6、IL-10等多种炎性因子表达,引发炎症风暴,且TNF-α具有强促凝血的作用[12]。脓毒症发生后,大量促炎因子产生,使得抑炎因子IL-10开始生成、释放, 减轻炎症反应, 从而引起免疫抑制和延长低炎症反应时间,IL-10在机体抑炎及免疫应答中发挥重要作用[13]。尽管IL-10是一种抗炎因子,但其过度升高也可加重炎症反应,并预示预后不良[14]。本研究中脓毒症组和参附注射液组大鼠外周血中TNF-α、IL-10水平和主动脉组织中p-IKBα、p-NF-κB p65蛋白相对表达量均明显高于假手术组,可能与脓毒症发生后,血管内皮损伤,炎症因子释放失控,TNF-α、IL-10水平急剧升高,启动NF-κB信号通路活化后的炎症级联反应,进一步促进多种炎性因子表达,引发炎症风暴,促炎与抗炎介质失衡有关;参附注射液组上述各指标均明显低于脓毒症组,提示参附注射液干预可明显降低炎症因子水平,抑制NF-κB信号通路活化。
脓毒症患者血管内皮损伤后导致的凝血功能障碍是脓毒症高病死率的重要原因之一,其主要病理生理机制包括凝血激活、生理性抗凝和纤溶受损[15]。生理条件下,血液vWF表达水平很低,但在血管内皮细胞受刺激或损伤后,vWF可被大量释放入血,因而vWF是一种可以反映内皮细胞受损和功能障碍的生物标志物[16],是脓毒症诊断、严重程度分层的重要指标,亦与不良预后密切相关[17]。本研究显示脓毒症血管内皮损伤后vWF明显升高,而参附注射液干预可有效降低其水平,证实参附注射液对脓毒症血管内皮损伤具有一定的保护作用。血管内皮细胞被炎症介质刺激也可产生TF,TF作为体内凝血过程的主要启动剂,由TF和VIIa因子组成的复合物催化非活性X因子转化为活性形式,从而激活凝血[18]。TM可与凝血酶结合形成复合物促进蛋白C活化发挥抗凝作用,在血管内皮细胞损伤时,TM能够被血管内皮细胞释放出来,导致血液中TM水平增高,同时血管壁细胞膜上TM减少,细胞结构受损,又削弱了自身的抗凝作用。PAI-1的表达主要局限于内皮细胞,其通过抑制纤溶酶原活化维持纤溶平衡,脓毒症时机体内纤维蛋白溶解停止并阻止纤维蛋白的清除,进一步加剧微血管血栓形成。PAI-1和凝血酶激活纤维蛋白溶解抑制剂(TAFI)水平的升高与严重脓毒症患者的器官衰竭和不良预后相关[19]。近年来研究表明,TM被视为一种反映内皮损伤的敏感标志物,但是不能作为单一的预测因子[20]。本实验中脓毒症组大鼠外周血中vWF、TF、TM、PAI-1水平均明显高于假手术组,进一步证明了脓毒症期间内皮细胞的激活以及纤溶受损;参附注射液组vWF、TF、TM、PAI-1水平均明显低于脓毒症组,说明参附注射液可改善脓毒症诱发的凝血功能障碍,保护血管内皮细胞。
综上所述,参附注射液可通过抑制IKBα/NF-κB通路活化,减轻脓毒症造成的炎症反应,对血管内皮及凝血功能起到一定的保护作用,为临床治疗脓毒症患者凝血功能障碍提供了一个新的方向。
利益冲突:所有作者均声明不存在利益冲突。
