桃金娘花药愈伤组织诱导研究
2024-03-19郭佳慧向星星干雨露韩维栋
郭佳慧,丰 锋,向星星,干雨露,韩维栋
(广东海洋大学 滨海农业学院,广东 湛江 524088)
桃金娘[Rhodomyrtus tomentosa(Ait.) Hassk.],桃金娘科(Myrtaceae)桃金娘属[Rhodomyrtus(DC.) Rchb.]植物,为多年生落叶小灌木,又名山稔子、岗稔、多莲等,多生长于我国两广的红壤丘陵地带,是酸土指示植物[1]。桃金娘是分布于我国的桃金娘属的唯一种[2],其花色绚丽多彩,可应用于园林景观和土壤生态修复[3],果实营养价值高,含丰富的多糖和花色素苷,具极高抗氧化活性[4],有一定药用保健价值。目前,关于桃金娘的研究主要集中在药用价值分析、加工利用、生态特性等方面[4]。
桃金娘的繁殖一般采用实生繁殖和扦插繁殖[5]。实生繁殖难以保持优良种性,扦插繁殖生根率较低,推测原因是桃金娘本身单宁含量较高[6]。
花药培养技术可使小孢子产生单倍体[7-8],能快速获得某一性状纯合体,丰富亲本种质资源,加快育种进程,提高育种效率,缩短育种年限[9-10],在一些作物和果树上已有成功应用[11-12]。花药培养在植物育种方面至关重要,研究诱导桃金娘花药胚性愈伤组织的培养条件,建立桃金娘花药愈伤组织培养体系,为桃金娘组培快繁体系的建立提供理论基础。本研究以桃金娘花药为材料,探究不同小孢子发育时期、花蕾大小、不同生长调节剂组合和不同时间低温预处理对于花药愈伤组织诱导的影响,筛选出适合桃金娘花药愈伤组织诱导的花药发育时期、培养基以及低温预处理最佳时间。
1 材料与方法
1.1 材料
以广东海洋大学园林基地长势强壮、无病虫害的桃金娘外植体为实验材料,于晴朗天气上午(8:00 ~ 10:00)用镊子采集健壮植株的不同大小花蕾放入自封口塑料袋内,用冰盒带回实验室备用。每一个发育时期取花蕾20个,重复3次。
1.2 方法
1.2.1 花蕾形态特征观察与测量
用游标卡尺测量桃金娘花蕾纵径、横径,观察花蕾外部形态并描绘特征,用镊子剥离萼片与花瓣,观察花药颜色与气味。
1.2.2 小孢子发育细胞学观察
用卡诺式固定液固定大小不一的花蕾24 h,转入70%酒精中,于4℃冰箱保存。用镊子取出保存液中的花蕾,剥去花萼与花瓣,取出花药均匀涂抹于载玻片,用镊子轻碾花药,以便花粉细胞流出,醋酸洋红染色后在400× 光学显微镜(瑞显光学RXBH200M)下观察各个发育时期的小孢子结构并拍摄小孢子不同发育时期照片[10]。
1.2.3 低温预处理
将在晴朗早晨(8:00 ~ 10:00)采集的处于单核期且发育良好的花蕾带回实验室,用保鲜袋保存于4℃冰箱,低温预处理0、12、24、48、72 h,备用。
1.2.4 花药愈伤组织诱导
培养基为MS,添加蔗糖30 g/L,pH 5.8,采用L9(33)正交试验设计,研究2,4-D(1.0、2.0、3.0 mg/L)、6-BA(0.5、1.0、1.5 mg/L)、NAA(0.1、0.2、0.3 mg/L)组合对花药愈伤组织诱导的影响。每瓶接种20 枚花药,每处理共接种30 瓶,重复3 次。在25 ± 1℃下暗培养14 d 后,光照强度2 000 Lx,12 h/d 下培养。3 d 观察一次,35 d 后统计愈伤组织诱导情况,计算愈伤组织诱导率。
1.3 数据统计与分析
试验数据先用Excel 2017 进行基本统计与分析,再用SPSS 26.0 通过Duncan 分析法对各指标进行差异显著性分析。
2 结果与分析
2.1 桃金娘小孢子发育时期与花蕾形态特征的关系
观察桃金娘不同大小花蕾(图1)小孢子发育时期发现,桃金娘花粉母细胞通过减数分裂产生四分小孢子,进入四分体时期。不同发育时期的小孢子在形态上有较大差异,在光学显微镜下观察同一平面一般只能看到3 个小孢子(图2-A)。随后四分孢子分开,进入单核期(图2-B),直到细胞质中出现液泡,将细胞核从中心挤压到靠近细胞壁,此时细胞处于单核靠边期(图2-C)。随后花粉细胞进行第一次有丝分裂,此时细胞进入双核期(图2-D)。
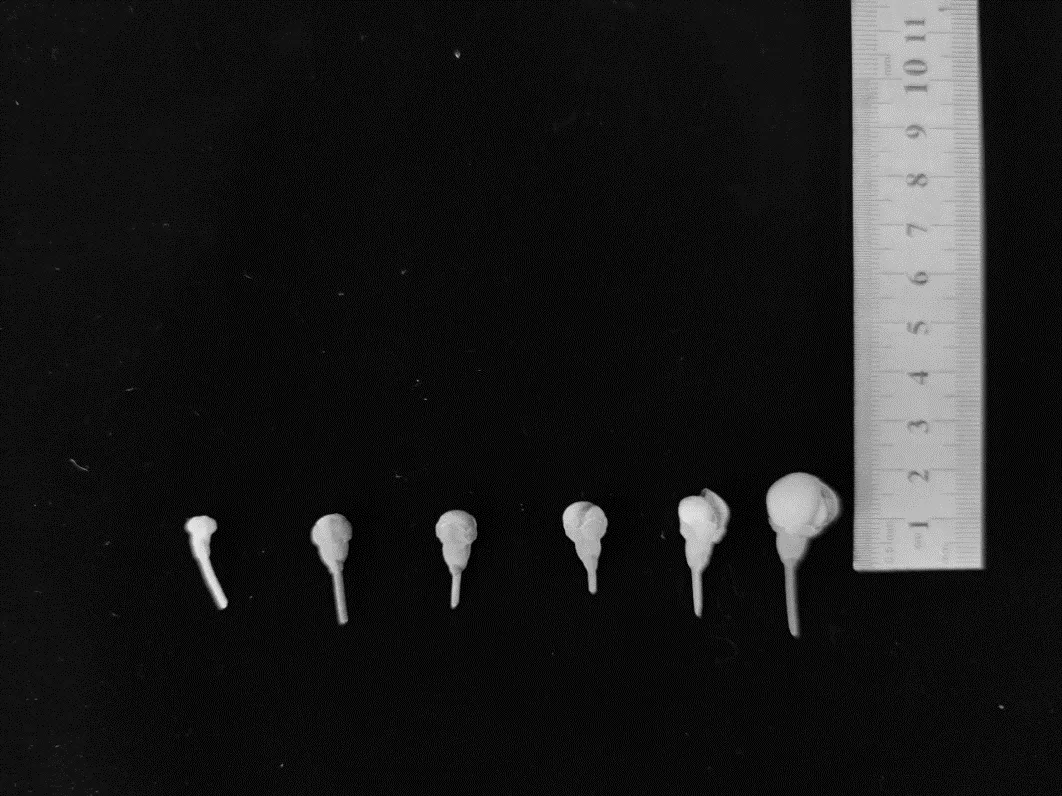
图1 处于不同发育时期的桃金娘花蕾Fig. 1 Buds in R. tomentosa at different development periods
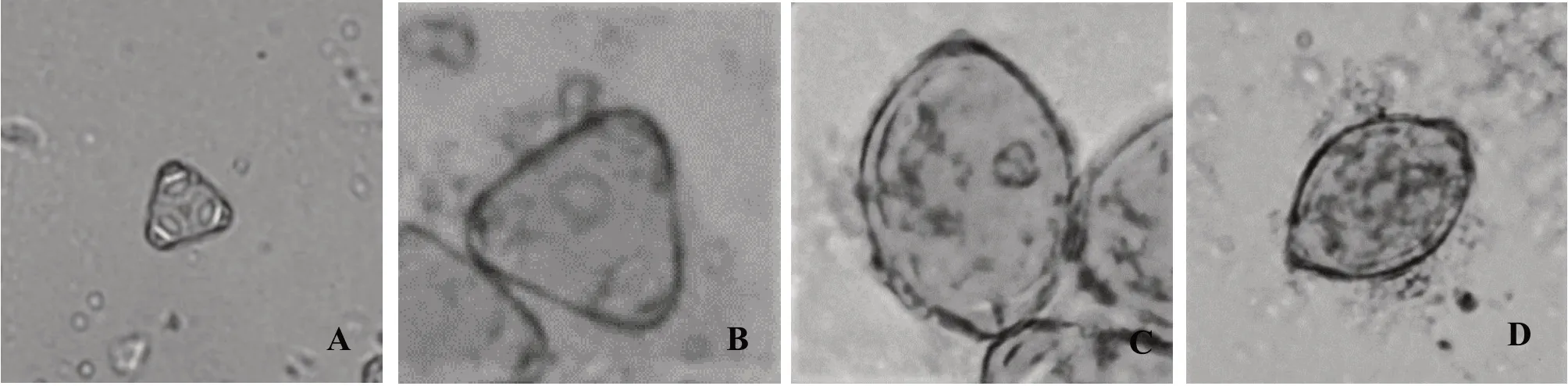
图2 桃金娘不同发育时期的小孢子Fig. 2 Microspores of R. tomentosa at different developmental stages
由表1 可知,桃金娘小孢子不同发育时期与花蕾横纵径大小密切相关。桃金娘小孢子从四分体时期向双核期的发育过程中,其花蕾的横径、纵径呈增长趋势,花蕾横纵径比值也基本呈上升趋势。花蕾横径、纵径大小在桃金娘的不同发育阶段都有显著差异,并与小孢子发育时期呈正相关。桃金娘小孢子处于单核靠边期时,花蕾横径为7.877 ±0.374 mm,纵径为7.167 ± 0.340 mm,花瓣比花萼稍长。桃金娘小孢子不同发育时期花蕾大小不同,且外部形态不甚相似,说明桃金娘小孢子发育时期与花蕾外部形态密切相关。从四分体时期到双核期,花蕾逐渐膨大,花瓣逐渐露出花萼,花药颜色由淡黄色转变为黄色,直至最后成熟花粉粒时花药颜色为深黄色并伴随浓烈芳香气味。故花蕾横纵径大小和花药颜色可以作为判断小孢子发育时期的指标。小孢子处于单核靠边期时,花药颜色为黄色,此时期的花药适宜用于愈伤组织诱导。

表1 桃金娘小孢子发育时期花蕾形态特征Tab. 1 Morphological characteristics of flower buds during microspore development in R.tomentosa
2.2 4℃低温预处理时间对花药愈伤组织诱导的影响
由表2可知,4℃条件下低温预处理不同时间对桃金娘花药愈伤组织诱导率有显著影响,桃金娘花药经过4℃低温分别预处理0、12、24、48、72 h 后,花药均能形成愈伤组织。预处理24 h 的效果最好,极显著高于未经低温处理(对照)下的7.11%,35 d 后愈伤组织诱导率达23.78%。

表2 低温预处理对花药愈伤组织诱导的影响Tab. 2 Effects of different pretreatments time on callus induction
2.3 生长调节剂对花药愈伤组织诱导的影响
接种28 d,桃金娘花药开始膨大,35 d时可见纯白色或米黄色团状愈伤组织,第4 次继代至分化培养基中可见绿色胚状体(图3)。极差分析见表3,不同水平2,4-D 之间的极差最大,是影响桃金娘愈伤组织诱导的主导因子,6-BA 和NAA 是次要因子,2,4-D 2.0 mg/L处理下愈伤组织诱导率极显著高于其他处理。方差分析表明,2,4-D 处理组间差异有统计学意义(P< 0.01),6-BA和NAA处理组间差异有统计学意义(P< 0.05)(F2,4-D= 27.513,F6-BA=4.286, FNAA= 4.435),不同处理组合之间愈伤组织诱导率Duncan 多重比较的结果(表3)表明,组合MS +2.0 mg/L 2,4-D + 1.5 mg/L 6-BA + 0.1 mg/L NAA的诱导率最高(30.82%)。

表3 植物生长调节剂组合对桃金娘花药愈伤组织诱导的影响Tab. 3 Effects of plant growth regulator combinations on R. tomentosa callus induction
表4 植物生长调节剂组合对桃金娘花药愈伤组织诱导影响的多重差异比较Tab. 4 Comparison of multiple differences in the effects of plant growth regulator combinations on the induction of R. tomentosa callus tissue
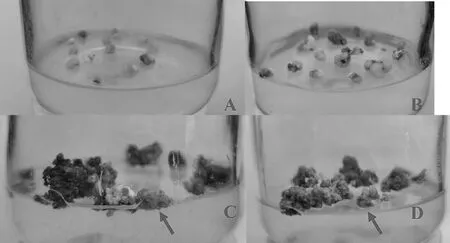
图3 桃金娘花药愈伤组织生长过程Fig. 3 R. tomentosa callus growth process
3 讨论与结论
McCormick[13]研究认为,植物小孢子发育从母细胞开始到成熟花粉结束,分为母细胞、四分体、单核花粉、成熟花粉4 个时期。其中,在四分体时期,一些植物的4 个细胞核并不一定处于同一平面,而是以三维立体的形式出现。在百合科(Liliaceae)植物开口箭[Rohdea chinensis(Baker) N. Tanaka]、山麦冬[Liriope spicata(Thunb.) Lour.]中发现其四分体全部为左右对称型[14-15];而东方百合(Lilium OrientalHybrids)四分体则是左右对称型和四面体型同时存在[16]。本试验结果表明,桃金娘2 种类型的四分体都存在,其中四面体型占多数,偶见左右对称型。
四分体时期是减数分裂的一个阶段,此时花药发育时期过早,小孢子尚未形成,几乎不能成胚[17];当小孢子发育成成熟花粉粒时的发育时期过晚,小孢子不具备脱分化能力[18]。因此,花药培养需要合适的小孢子发育时期,选择适宜的花粉发育时期对花药诱导形成愈伤组织进行组培至关重要。不同植物的小孢子最适培养时期不同。谢淼等[19]对黄瓜(Cucumis sativusL.)花器形态发生、小孢子发育与花药培养进行研究的结果表明,孢子发育时期与花蕾形态特征、花药颜色具有相关性,黄瓜花药培养中小孢子最佳培养时期为单核中后期。詹艳等[20]以10 个不同基因型黄瓜为试材进行游离小孢子培养,对成胚条件的系统研究结果表明基因型和小孢子发育时期是限制黄瓜游离小孢子成胚的关键因子,其中单核靠边期是进行黄瓜游离小孢子培养的最佳时期。Takahata和Keller[21]研究认为,甘蓝(Brassica oleraceavar.capitataLinnaeus)小孢子培养的最佳时期是单核靠边期至双核期。杨廷红等[22]研究认为,单核靠边期是进行湖北海棠[Malus hupehensis(Pamp.) Rehd.]游离小孢子培养的最佳时期。一般认为,单核靠边期的小孢子离体培养成功率最高[23-25],试验结果与前人研究结果一致。
在小孢子或花药培养时,常采用镜检方式确定发育时期,但该方式导致培养效率较低、过程繁琐。在对金莲花[26](Trollius chinensisBunge)和黄花苜蓿[27](Medicago falcataL.)等多种植物的研究中均发现,小孢子发育时期和花蕾外部形态密切相关;但对于不同的植物,处于相同发育时期的小孢子对应的花蕾及花药外部形态指标值不同,在菜心[11](Brassica rapa syn. Campestris ssp. Chinensisvar.UtilisTsen et LEE.)中单核靠边期小孢子对应的花蕾纵径为3.03 ~ 3.39 mm;而本研究通过对桃金娘花粉细胞染色,观察发现桃金娘小孢子发育时期经历四分体时期、单核中期、单核靠边期及双核期,最终发育成成熟花粉粒,且小孢子发育时期与花蕾外部形态、花药颜色密切相关。桃金娘小孢子处于单核靠边期时,花蕾横径为7.877 ± 0.374 mm,纵径为7.167 ± 0.340 mm,玫红色花瓣露出花萼,花药黄色。因此,取材时可根据桃金娘花蕾形态、花药颜色等外形指标来判断小孢子发育时期,快速找到需要的时期,无需镜检,有利于提高小孢子培养效率。
小孢子培养受小孢子发育时期、基因型、处理方式、培养基成分等多种因素的影响[28-29],通过低温处理花药可抑制形成纺锤丝的酶活性,从而快速得到单倍体。花药培养中利用低温处理花蕾,极大提高了花药培养效率,且在多种植物上得到证实[30-32]。本研究发现通过低温预处理桃金娘花药,可以显著提高花药愈伤组织发生率,与前人研究结果一致。花药愈伤组织的形成受多种因素影响,其中激素种类和浓度至关重要。许多实验结果表明,在花药启动培养过程中,植物生长调节剂2,4-D 起主导作用[33-34],本实验与前人研究结果一致。
本试验以桃金娘花药为材料,分析了4℃低温预处理和植物生长调节剂组合对桃金娘花药愈伤组织发生率的影响,研究结果表明:低温处理24 h,桃金娘花药愈伤组织诱导率最高。2.0 mg/L 2,4-D对桃金娘花药愈伤组织诱导影响极显著,组合MS+ 2.0 mg/L 2,4-D + 1.5 mg/L 6-BA + 0.1 mg/L NAA的诱导率最高。
