藤黄健骨胶囊对PMOP大鼠RANKL/c-Fos/NFATc1通路的影响
2024-03-19安方玉颜春鲁柳颖王霞霞孙柏汪春梅常伟荣宋佳眙王玉洁张捷肖志攀高鹏
安方玉 颜春鲁 柳颖 王霞霞 孙柏 汪春梅 常伟荣 宋佳眙 王玉洁 张捷 肖志攀 高鹏
甘肃中医药大学,甘肃 兰州 730000
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是由于女性绝经后卵巢分泌雌激素的功能下降导致破骨细胞(osteoclast,OC)介导的骨吸收大于成骨细胞(osteoblast,OB)介导的骨形成而引起的一种全身代谢障碍性疾病[1-2]。其疼痛、骨折严重威胁了女性的生活质量[3]。如何有效治疗PMOP成为医学研究者关注的焦点。
中医学认为PMOP的病机多为“本虚标实”:肾虚为本,血瘀为标,治则当以“标本兼治、补肾活血”为治疗大法。本课题组前期动物实验结果已证实,补肾活血方藤黄健骨胶囊能够通过调控卵巢模型鼠OPG/RANK/RANKL调节轴去来影响其Ga2+、P代谢[4]。临床试验研究结果也进一步证实藤黄健骨胶囊能够通过明显升高老年性骨质疏松症患者BGP、OPG、BMD含量来发挥治疗作用[5],但具体机制尚未阐明。
近年来研究发现,驱动骨代谢的免疫调节分子IL-33能够通过抑制RANKL诱导的OC形成防止炎症性骨丢失的发生[6]。也有研究发现c-fos在骨代谢相关疾病中对OB-OC动态平衡产生着重要影响[7-8]。此外也发现抑制活化T细胞c1核因子(nuclear factor of activated T-cells,NFATc1)蛋白表达的同时可抑制去卵巢骨质疏松模型大鼠的OC分化[9]。由此推测免疫调节分子IL-33对RANKL/c-Fos/NFATc1骨代谢信号轴的影响可能是PMOP发生的关键机制。因此,本课题通过观察藤黄健骨胶囊对PMOP大鼠免疫调节因子IL-33、IL-1、IL-31变化及RANKL/c-Fos/NFATc1骨代谢信号轴关键调控分子OPG、RANKL、RANK、c-Fos、NFATc1的表达变化,初步探寻补肾活血方藤黄健骨胶囊防治骨质疏松寻找关键靶点,以期为中医药治疗PMOP提供科学依据。
1 材料与方法
1.1 材料
1.1.1实验动物:60只SPF级SD雌性大鼠由甘肃中医药大学科研中心供应,体重(180±20)g,动物质量合格证号为SCXK(甘)2020-0001。饲养于环境温度为20 ℃、湿度为42%~52% SPF级实验室中,常规饲养。本实验经过甘肃中医药大学动物实验伦理委员会的批准(批号:2021-809)。
1.1.2药物、试剂及仪器:藤黄健骨胶囊(甘肃省西峰制药有限责任公司,批号:210108);戊酸雌二醇片(法国DELPHARM Lille S.A.S.公司,批号:676A);IL-33、IL-1、IL-31含量测定盒(江苏菲亚生物科技有限公司,批号:2212R36、2212R31、2212R37);OPG一抗(美国GeneTex公司,批号:822005891);RANK、RANKL、c-Fos一抗(美国ImmunoWay Biotech,批号:B8101、B0401、B8401);NFATc1一抗(美国Abclonal公司,批号:0073810201)。Multiskan Sky型酶标仪(北京昊诺斯科技有限公司);EXPERT-XL型双能X线骨密度仪(美国GE公司);Chemi Doc XRS型凝胶成像仪(美国BIO-RAD公司);Ds-fi3显微镜(日本Nikon)。
1.2 方法
1.2.1分组:60只SD雌性大鼠随机分为假手术组(sham group,Sham)、模型组(postmenopausal osteoporosis model group,PMOP),阳性对照组(estradiol valerate group,ESV)、藤黄健骨胶囊高剂量(Tenghuang Jiangu capsule high-dose group,TJCH)、中剂量(Tenghuang Jiangu capsule medium-dose group,TJCM)、低剂量(Tenghuang Jiangu capsule low-dose group,TJCL)组,每组10只。
1.2.2PMOP大鼠模型构建与干预:依据参考文献[10-11],在每组动物术前禁水、禁食12 h后给予戊巴比妥钠腹腔内注射。仰卧位固定每组动物,剔除其侧腹周围毛发,常规碘伏消毒后沿背部后正中线作一1.0~1.5 cm纵形切口,逐层切开皮肤、筋膜、肌肉,钝性分离进入腹腔找到棕黄色呈菜花样的卵巢将其切除并止血,再逐层缝合切口。假手术组只切除卵巢附近的脂肪组织。术后给予每组动物青霉素以防感染,常规饲养。卵巢摘除8周后于每天上午9点开始进行灌胃干预,TJC治疗组给予TJC 0.36、0.18、0.09 g/kg灌胃(藤黄健骨胶囊剂量设置依据参考文献[12],人临床用量为2 g,按照人与大鼠的体表面积换算法:人用剂量2 g×0.018×5≈0.18 g/kg作为中剂量),ESV组给予戊酸雌二醇0.09 mg/kg灌胃,Sham组和PMOP组大鼠给予等量蒸馏水灌胃,连续干预8周[13-14]。
1.2.3体质量检测:动物干预结束后次日用电子天平测定各组动物的体质量变化。
1.2.4骨密度检测:动物干预结束后次日将其麻醉,通过双能X线吸收测量仪测量各组动物股骨的骨密度(bone mineral density,BMD),具体操作程序的设置根据仪器使用说明书进行。
1.2.5股骨组织病理形态学改变观察:BMD检测结束后通过股动脉采血处死每组动物,摘取每组动物完整的右侧股骨并剔除其股骨表面的软组织,浸润于4 %的多聚甲醛中过夜,第二日用PBS冲洗后EDTA脱钙处理,每隔24 h更换1次EDTA脱钙液,1个月后常规制作石蜡切片,切片厚度为5 μm切片,HE染色后封片并镜检,观察股骨形态改变情况。
1.2.6血清中免疫调节因子的含量检测:采集大鼠股动脉血液5 mL,3 000 r/min离心5 min,收集上层血清做ELISA检测,通过ELISA测试盒测定IL-33、IL-1、IL-31含量的表达变化。
1.2.7股骨组织OPG、RANKL、RANK、c-Fos、NFATc1基因表达检测:TRizol裂解液股骨RNA,以RNA为模板,在反应条件和时间分别为25 ℃ 5 min、55 ℃ 15 min和85 ℃ 5 min中逆转录合成cDNA,接着进行OPG、RANKL、RANK、c-Fos、NFATc1等目的基因的PCR扩增反应,反应条件设置为预变性过程95 ℃ 5 min,变性过程95 ℃ 10 s,退火过程55 ℃ 20 s和延伸过程72 ℃ 20 s。目的基因相对表达量以2-△△Ct来表示。所有引物序列见表1。

表1 RT-PCR的引物序列Table 1 Primer sequence of RT-PCR
1.2.8股骨组织OPG、RANKL、RANK、c-Fos、NFATc1蛋白表达检测:加入RIPA裂解液提取股骨组织总蛋白,将蛋白样品电泳、转膜,封闭后加入一抗OPG、RANKL、RANK、c-Fos、NFATc1等孵育过夜(设置温度为4 ℃),二抗孵育1 h(设置温度为37 ℃)后显色、曝光。最后以GAPHD蛋白为内参测定各组动物股骨组织目的蛋白表达水平。
1.3 统计学分析
2 结果
2.1 六组动物体质量和BMD指标比较
与Sham组比较,PMOP组和TJCL组大鼠体质量显著升高,BMD显著降低(P<0.05或P<0.01);与PMOP组比较,TJCH组和ESV组大鼠体质量显著减轻,TJCH、TJCM、TJCL组和ESV组大鼠BMD显著增加(P<0.05或P<0.01)。见表2。
表2 六组动物体质量和BMD指标比较
2.2 六组动物股骨组织病理形态学变化
Sham组大鼠股骨组织形态及结构正常,骨小梁排列规则,骨髓腔内有极少量脂滴沉积;PMOP组、TJCM组和TJCL组大鼠股骨组织骨小梁稀疏断裂、数目明显减少,不能连接成网,PMOP组和TJCL组骨髓腔内有大量脂滴沉积;TJCH组和ESV组大鼠骨小梁数量增加,连接完整、排列较整齐、连续性好,而TJCH组、TJCM组和ESV组骨髓腔内有脂滴沉积,但脂滴沉积数量明显减少。见图1。

图1 各组大鼠股骨组织病理形态改变(HE,×20)Fig.1 Pathological changes of femoral tissue in each group (HE, ×20)
与Sham组比较,PMOP组大鼠BMAT明显升高(P<0.01);与PMOP组比较,TJCH组、TJCM组和ESV组大鼠BMAT明显降低(P<0.01)。见表3。
表3 六组动物骨髓脂肪组织相对面积比较
2.3 六组动物血清免疫调节因子含量变化
与Sham组比较,PMOP组大鼠血清IL-33含量明显降低,IL-1和IL-31含量明显升高(P<0.01);与PMOP组比较,TJCH组和ESV组大鼠血清IL-33含量均显著增加,TJCH、TJCM、TJCL组和ESV组大鼠血清IL-1及IL-31含量均显著降低(P<0.05或P<0.01)。见表4。
表4 六组动物免疫调节因子含量比较
2.4 六组动物股骨组织OPG、RANKL、RANK、c-Fos、NFATc1基因表达变化
与Sham组比较,PMOP组大鼠股骨组织OPG基因表达显著降低,RANKL、RANK、c-Fos、NFATC1基因表达显著升高(P<0.01);与PMOP组比较,TJCH、TJCM组和ESV组大鼠股骨组织OPG基因表达均显著增加、RANK基因表达均显著降低,TJCH、TJCM、TJCL组和ESV组大鼠股骨组织RANKL、c-Fos、NFATc1的基因表达也均显著降低(P<0.01)。见图2。
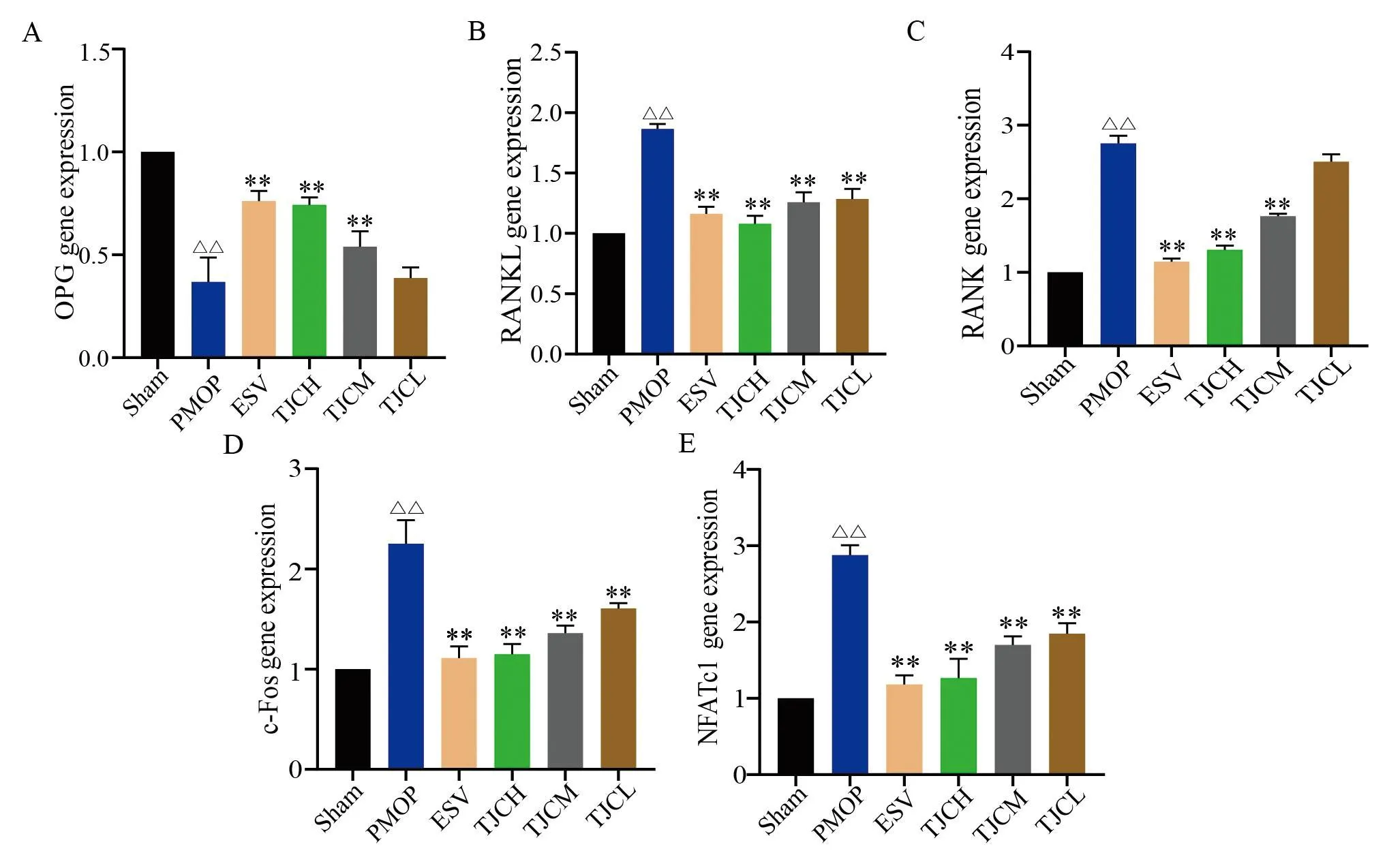
图2 六组动物OPG、RANKL、RANK、c-Fos、NFATc1基因表达结果比较Fig.2 Comparison of gene expression of OPG, RANKL, RANK, c-Fos, NFATc1 among six groups
2.5 六组动物股骨组织OPG、RANKL、RANK、c-Fos、NFATc1蛋白表达变化
与Sham组比较,PMOP组大鼠股骨组织OPG蛋白表达及蛋白表达灰度值显著降低,RANKL、RANK、c-Fos、NFATc1蛋白表达及蛋白表达灰度值显著升高(P<0.01);与PMOP组比较,TJCH、TJCM组和ESV组大鼠股骨组织OPG蛋白表达及蛋白表达灰度值均显著增加、RANK蛋白表达及蛋白表达灰度值均显著降低,TJCH、TJCM、TJCL组和ESV组大鼠股骨组织RANKL、c-Fos、NFATc1的蛋白表达及蛋白表达灰度值也均显著降低(P<0.05或P<0.01)。见图3~图4。

图3 六组动物OPG、RANKL、RANK、c-Fos、NFATc1蛋白表达变化(Western-blot)Fig.3 The protein expression changes of OPG, RANKL, RANK, c-Fos, NFATc1 among six groups (Western-blot)

图4 六组动物OPG、RANKL、RANK、c-Fos、NFATc1蛋白表达灰度值结果比较Fig.4 Comparison of the gray value radio of protein expression of OPG, RANKL, RANK, c-Fos, NFATc1 among six groups
3 讨论
祖国医学将PMOP归属于“骨痿”范畴,临床患者多以“肾虚血瘀”为主要证型。其发病主要是由于PMOP患者长期肾精亏虚致使骨髓充盈不足,后者诱发骨骼失养而致“痿”;此外,肾为先天之本,PMOP患者长期肾精不足则无以化生血而致“瘀”。因此,PMOP的防治方法侧重于“补肾活血”。
藤黄健骨胶囊主要组成是熟地黄、骨碎补、肉苁蓉、鹿衔草、淫羊藿、鸡血藤、莱菔子。诸药合用,具有“补肾壮骨,活血止痛”之效。从中医的角度来说,藤黄健骨胶囊与PMOP“肾虚精亏,瘀血阻络”的病机相契合,符合PMOP“补肾壮骨、活血通络”的治疗原则。周霖等[14]通过网络药理学GO富集分析发现藤黄健骨胶囊主要涉及炎症反应、信号转导、蛋白磷酸化等生物过程,胞质、包膜等细胞组分及酶活性、能量活性等分子功能。现代药理学研究发现,中药骨碎补可能通过下调Notch1和抑制NLRP3炎症小体介导的炎症来显著改善老年PMOP患者的血脂水平脂质状况[15]。骨碎补有效成分柚皮苷通过靶向JAK2/STAT3信号传导促进BMSC成骨分化,也可以减缓PMOP大鼠的骨丢失[16]。淫羊藿及其生物活性成分[17]均可抑制骨转换,增加鼠的骨密度,改善骨小梁厚度来逆转去卵巢大鼠诱导的骨丢失,延缓PMOP的发生发展。临床试验结果也证实藤黄健骨胶囊可显著升高肾虚血瘀型原发性骨质疏松症患者的骨密度,降低骨代谢,促进骨钙化形成,增加骨强度[18]。临床试验研究结果进一步证实藤黄健骨胶囊能够明显升高老年性骨质疏松症患者BGP、OPG含量,明显降低其ALP、U-Ca/Cr、U-HoP/Cr含量,从而通过抑制老年性骨质疏松症患者的骨吸收和促进骨生成来提高其BMD,进而发挥治疗作用[5]。本实验结果也证实藤黄健骨胶囊能够提高PMOP模型鼠的体重,降低BMD和BMAT,且TJCH组大鼠骨小梁数量、排列及髓腔内脂滴沉积接近于假手术组,提示藤黄健骨胶囊治疗PMOP是有效的,但具体机制未明。
研究发现,破骨细胞因子主要属于T辅助因子1(Th1)型,而T辅助因子2(Th2)型细胞分泌的细胞因子则可以抵消Th1型介导的炎症反应对OC功能的影响[19-20]。IL-33作为一种新发现的Th2型细胞因子,一方面通过刺激OB成熟来减少OC生成[21];另一方面还可直接促进人单核细胞前体分化为OC,独立诱导骨吸收[22]。相反,也有研究证明,IL-33还可通过激活T细胞胞质1核因子(NFATc1)的失活(FATc1是RANKL诱导的OC形成的关键调节因子)和RANKL途径对OC分化发挥抑制作用[23]。此外,另有研究发现,IL-33也可通过诱导Th2细胞分泌IL-31,抑制RANKL依赖性OC生成,从而抵消骨丢失[24]。IL-31是一种主要由偏向Th2表型的活化CD45RO+T淋巴细胞产生的促炎细胞因子,主要诱导参与OC前体募集和免疫介导的骨吸收,对细胞增殖和组织重塑发挥多种调节作用[25-26]。以上结果表明,免疫调节分子IL-33通过调控IL-31的分泌来抑制OC生成,这种作用可能是通过RANKL轴来实现的。
现代研究证明,OPG/RANK/RANKL信号轴在调节PMOP的OB-OC成熟与分化,调控OB-OC动态平衡方面发挥着重要作用[27-28]。在骨组织中,由OB分泌的OPG是抑制骨吸收,增加皮质骨和松质骨密度、面积和骨强度的关键细胞因子[29]。RANK与OC及其前体细胞表面RANKL结合,是一种能够促进OC成熟、分化和减慢其凋亡的关键细胞因子[29]。RANKL作为调控骨吸收的关键细胞因子,是OC分化、成熟的下游靶标分子[30]。而OPG作为RANKL高亲和力诱饵样受体,通过竞争结合RANKL,阻断RANK与RANKL结合,影响RANK-RANKL途径,使OC转录活化信号生成减少,从而抑制骨吸收,增加皮质骨和松质骨密度、面积和骨强度,维持骨代谢平衡[29]。绝经后女性因雌激素缺乏导致机体RANKL表达水平增高,OPG表达水平下降,促进RANKL与RANK的结合,OC收到RANK-RANKL途径产生的转录活化信号,刺激前破骨细胞分化为OC,从而促进OC的形成、分化、成熟,致使骨吸收增加、骨组织损伤,最终诱发OP[31]。
另有研究发现,c-fos/NFATc1信号通路的激活对OC分化至关重要,c-fos、NFATc1蛋白的任一缺失将导致OC前体细胞无法分化为成熟的OC[32-33]。c-fos是骨细胞生长和分化的关键调节因子,在骨代谢相关疾病中对OB-OC动态平衡产生着重要影响[7-8]。活化T细胞c1核因子(nuclear factor of activated T-cells,NFATc1)是NFAT家族成员之一,有研究证实,抑制NFATc1的蛋白表达可抑制去卵巢骨质疏松模型大鼠的OC分化,治疗骨吸收过度导致的炎症性骨病[9]。近年来研究也表明,NFATc1表达于哺乳动物的多种组织中,并发现其在免疫系统中发挥着重要调控作用[34]。
本研究结果发现,PMOP模型组大鼠体重、脂肪组织相对面积(BMAT)、血清IL-1、IL-31含量和股骨RANKL、RANK、c-Fos、NFATc1基因表达、蛋白表达及蛋白表达灰度值均明显增加,而BMD、血清IL-33含量、股骨OPG基因表达、蛋白表达及蛋白表达灰度值则均显著降低。与上述文献报道结果一致。而给予藤黄健骨胶囊干预后,结果发现,藤黄健骨胶囊能够降低PMOP大鼠的体重、BMAT、血清IL-1和IL-31含量、股骨RANK、RANKL、c-Fos、NFATc1的基因表达、蛋白表达及蛋白表达灰度值,能够升高其BMD、血清IL-33含量、股骨组织OPG基因表达、蛋白表达及蛋白表达灰度值。这些结果表明藤黄健骨胶囊通过提高PMOP模型大鼠免疫调控分子IL-33含量来抑制RANKL/c-fos/NFATc1骨代谢信号通路关键分子NFATC1的上调表达,进而抑制其破骨细胞分化,纠正骨代谢紊乱,从而促进绝经后骨质疏松的骨重塑。该项研究初步揭示了免疫调节分子IL-33对PMOP模型鼠RANKL/c-fos/NFATc1信号轴的调控机制及藤黄健骨胶囊的干预机制,并探寻了补肾活血方藤黄健骨胶囊防治骨质疏松的关键靶点IL-33和NFATc1,为藤黄健骨胶囊的临床应用提供了实验依据,也为骨质疏松症的防治和药物研发提供了新思路。
综上,藤黄健骨胶囊治疗PMOP的可能机制是免疫调节因子IL-33抑制了PMOP模型鼠RANKL/c-fos/NFATc1信号轴破骨细胞分化标志分子NFATc1的表达,从而发挥疗效。但是由于藤黄健骨胶囊是一种复方制剂,存在多成分、多靶点的调节特点,其IL-33除了通过RANKL/c-fos/NFATc1信号轴对OC的分化起调控作用外,是否还可以通过调控其他的信号轴来同时调控OB增殖及成骨形成,目前尚未见相关研究。这或许是未来OP发病机制研究的一个方向,也可能成为藤黄健骨胶囊防治机制的研究热点。
