环状RNA与m6A修饰调控恶性肿瘤作用研究进展
2024-03-18王寅格李丹秀张文尧杨桃靳海峰
王寅格,李丹秀,张文尧,杨桃,靳海峰
(1.河北工程大学 临床医学院,河北 邯郸 056009;2.中国人民解放军联勤保障部队第九八〇医院 消化内科,河北石家庄 050081;3.中国人民解放军第四军医大学 西京消化病医院/国家消化系统疾病临床医学研究中心和消化系肿瘤整合防治全国重点实验室,陕西 西安 710032;4. 贵州中医药大学第一附属医院 肛肠科,贵州 贵阳 550001)
环状RNA(circular RNA,circRNA)目前被归类为非编码RNA,其独特的共价闭合连续环结构,有效地阻止RNA 核酸外切酶降解,该结构使circRNA 集中分布在细胞质中。随着高通量RNA 测序和circRNA 计算工具的开发,circRNA 的结构、进化、功能、组织特异性特征被逐渐揭示[1]。越来越多研究[2]证实,circRNA 在恶性肿瘤发生发展中发挥重要调节作用。
N6-甲基腺嘌呤(N6-methyladenosine,m6A)是真核生物mRNA 中最丰富的内部转录修饰,通过m6A 甲基转移酶“写入器(writers) ”、m6A 去甲基化酶“擦除器(erasers)”和m6A 阅读蛋白“阅读器(readers)”三者之间动态相互作用,维持细胞内m6A 稳态。m6A 修饰失调可影响circRNA 转录后过程,包括生物合成、核输出、降解、翻译和先天免疫反应等。而circRNA 也可反向调节m6A 修饰,共同调控靶分子表达,影响肿瘤进展。本文总结分析m6A 修饰和circRNA 间的相互作用,及其对恶性肿瘤发生发展的影响,以期为肿瘤精准诊疗与药物研发提供新思路。
1 CircRNA概述
CircRNA 是一类不含5'端帽结构和3'poly(A)尾,由共价键相连的环状单链RNA[2]。根据来源不同可分为四类:外显子circRNA(ecircRNA)、内含子circRNA (ciRNA)、 外显子- 内含子circRNA(eiciRNA) 和tRNA 内含子circRNA (tricRNA)[3]。不同于线性RNA 的标准剪接模式,circRNA 是通过反向剪接方式形成。circRNA 环化机制主要有三种:套索驱动的环化、RNA 结合蛋白相关的环化和内含子配对环化[4]。目前已知circRNA 的生物学功能主要有以下四种:⑴ 充当microRNA(miRNA)分子海绵[5];⑵ 与RNA 结合蛋白互作[6];⑶ 翻译表达多肽或蛋白[7];⑷ 调控基因转录和剪接[8]。上述特殊结构与多重生物学功能使circRNA 在肿瘤诊断、治疗和预后中的作用备受关注。
2 m6A甲基化修饰机制
m6A 修饰指RNA 腺苷酸(A) 第6 个氮(N)原子甲基化。m6A 修饰酶主要分为三类:催化m6A甲基化的“写入器”、优先结合m6A 的“阅读器”,以及逆转m6A 甲基化的“擦除器”(图1)。近期,He 等[9]鉴定发现一类新型甲基化酶—外显子拼接复合体(exon junction complexes,EJCs),EJCs 作为m6A“抑制器”调控mRNA m6A 区域选择性,从而决定m6A 整体表观组分布特异性。
m6A 甲基转移酶功能主要通过甲基转移酶复合物(methyltransferase complex,MTC)实现,MTC由甲基转移酶样蛋白3 (methyltransferase-like3,METTL3)、甲基转移酶样蛋白14(methyltransferaselike14,METTL14)、肿瘤1 相关蛋白(Wilms' tumor 1-associated protein,WTAP)3 个核心成分,以及病毒样m6A 甲基转移酶相关蛋白(virus-like m6A methyltransferase-associated protein,VIRMA)、含锌指CCCH 型 13 (zinc finger CCCH domain-containing protein, ZC3H13)、 RNA 结合基序蛋白15/15B(RNA-binding motif protein15,RBM15/15B) 和环指E3 泛素连接酶(RING-finger type E3 ubiquitin ligase,HAKAI) 4 个调节亚基组成。结构分析表明,METTL14 本身不具有甲基转移能力,但能与METTL3 以1∶1 的比例,形成稳定异源二聚体与RNA 结合[10]。WTAP 能诱导METTL3-METTL14 复合物定位于核斑点上并促进催化活性[11]。RBM15/15B功能是与尿嘧啶富集区域结合,促进RNA 甲基化。VIRMA 作为支架蛋白,绑定MTC 并将其招募到特定RNA 区域[12]。METTL16 (methyltransferase-like16,METTL16)是独立m6A 甲基化酶,主要调控mRNA稳定性和剪切过程[13]。
脂肪肥胖相关蛋白(fat mass and obesityassociated protein,FTO) 和alkB 同系物5ALKBH5(alkB homolog 5,ALKBH5) 是目前鉴定出的两种独立m6A 去甲基化酶,能够识别单链DNA 和RNA分子中腺嘌呤和胞嘧啶。FTO 是第一个被发现的m6A 去甲基化酶,可调节细胞能量稳定并与肥胖有关[14]。ALKBH5 是第二个被鉴定为影响RNA 核输出和代谢的去甲基化酶,与FTO 不同的是其更具m6A 特异性。
m6A 阅读蛋白,能特异性识别RNA m6A 修饰位点信息以执行不同的生物功能。常见的阅读子包括YT521-B 同源(YT521-B homology,YTH)结构域家族成员(YTHDC1/2、YTHDF1/2/3)、胰岛素样生长因子2 mRNA 结合蛋白(insulin like growth factor 2 mRNA binding proteins,IGF2BPs)、核不均一 核 糖 核 蛋 白 C (heterogeneous nuclear ribonucleoproteins,HNRNP)家族蛋白(HNRNPA2B1、HNRNPC、 HNRNPG)、 真核生物起始因子3(eukaryotic translation initiation factor 3,eIF3)、富含脯氨酸的卷曲螺旋2A (proline rich coiled-coil 2A,Prrc2a) 和脆性X 智力低下蛋白(fragile X mental retardation protein,FMRP)等。阅读蛋白通过特异性结合m6A 位点,改变RNA 二级结构影响蛋白与RNA 互作。YTHDF1 可促进RNA 翻译[15],YTHDF2则相反,可调节RNA 降解[16],YTHDF3 与YTHDF1和YTHDF2 合作介导m6A-mRNA 降解[17]。YTHDC1有助于RNA 剪接和输出。YTHDC2 是一种RNA 解旋酶, 提高翻译效率, 降低mRNA 丰度[18]。IGF2BPs 可调节mRNA 的稳定性和翻译[19]。HNRNP家族可调节RNA 选择性剪接和结构变化,其中,HNRNPA2B1 被认为是抗病毒免疫中的核DNA 传感器[20]。Prrc2a 通过m6A 依赖性方式稳定mRNA 表达[21]。此外,FMRP 作为新型m6A 的阅读子,可促进细胞核输出[22]。
3 m6A修饰与circRNA的相互调控作用
3.1 m6A修饰介导circRNA生物发生
m6A 与circRNA 生成和高级结构的关系此前一直鲜有报道。近期报道circZNF609 的生成效率由特定m6A 控制,并且需要METTL3 和YTHDC1 来指导反向剪接[23]。Tang 等[24]在雄性生殖细胞中发现了m6A 修饰参与一些具有编码功能的circRNA 的生成过程,并且揭示这些circRNA 能稳定和持久地产生蛋白。circDDIT4 环形侧翼序列中存在多个m6A 修饰位点,MTC 介导circDDIT4 生物生成可促进前列腺癌细胞凋亡, 而FTO 通过去甲基化降低circDDIT4 水平[25]。
3.2 m6A修饰促进circRNA核输出
circRNA 核输出过程受果蝇Hel25E 的DDX 解旋酶及其哺乳动物同源物DDX39A (URH49) 和DDX39B (UAP56) 调节,URH49 和UAP56 分别调节短(<400 nt)和长(>1 200 nt)circRNA 定位[26]。研究表明,含有内含子的circRNA 常被隔离在细胞核中,细胞稳态失调可驱动其核输出,参与肿瘤转移。Chen 等[27]首次阐明circNSUN2 核输出由YTHDC1 以m6A 依赖的方式介导,使circNSUN2 在细胞质表达增加,并通过形成circNSUN2/IGF2BP2/HMGA2 RNA 三元复合物,增强HMGA2 mRNA 稳定性,导致结直肠癌肝转移。METTL14 参与circFUT8的m6A 修饰,YTHDC1 识别并促进circFUT8 转移到细胞质[28]。m6A 修饰促进circRNA 出核,是circRNA修饰研究的重要进展,其具体调控机制及潜在生物学功能还有待挖掘。
3.3 m6A修饰诱导circRNA降解
circRNA 因其闭合环状结构,不易被水解,比亲本线性RNA 更加稳定。目前只鉴定出少数circRNA 降解途径, 例如miR-671 以argonaute 2(Ago2)依赖方式诱导ciRS-7 降解[29]。RNA 结合蛋白UPF1 和G3BP1 也可与circRNA 高度结构化碱基对区域结合,直接降解circRNA[30]。
m6A 修饰是介导circRNA 降解的重要途径之一,circRNA 使用m6A 作为标记物来募集YTHDF2和HRSP12 蛋白,HRSP12 直接与circRNA 上GGUUC模式结合,并充当桥梁将YTHDF2 和核酸内切酶RNase P/MRP 结合, 从而使RNase P/MRP 启动circRNA 降解[31]。乙型肝炎蛋白x (HBx) 促进RBM15 表达增加circRNA cFAM210A 的m6A 水平,通过 YTHDF2-HRSP12-RNase P/MRP 途径诱导cFAM210A 降解[32]。Wang 等[33]发现,在肺腺癌中YTHDF2 加速circASK1 降解,抑制细胞凋亡,进一步促进吉非替尼耐药。circ3823 通过circ3823/miR-30c-5p/TCF7 轴促进结直肠癌进展,其中YTHDF3 和ALKBH5 可共同调控circ3823 降解速率[34]。
3.4 m6A修饰驱动circRNA翻译
circRNA 由于缺乏5'帽子结构一直被认为无翻译功能,随着研究深入发现circRNA 不仅能够与核糖体结合,并且含有AUG 起始密码子序列和开放阅读框序列的基本编码翻译元件[35],揭示其具有编码多肽或蛋白质潜力。circRNA 翻译模式主要包括核糖体介入位点IRES 介导的翻译、m6A 修饰后翻译、滚环扩增翻译和由UTR 激活元件诱导的翻译[36]。Yang 等[37]在m6A 基序处构建突变体,m6A驱动的翻译在热休克或METTL3/14 过表达应激条件下被激活,该过程需要eIF4G2 和YTHDF3 辅助,可被FTO 抑制,证实了m6A 修饰可以驱动circRNA 翻译。Li 等[38]报道,circARHGAP35 由HNRNPL 介导生成,翻译1289aa 蛋白,功能与ARHGAP35 相反,具有促癌作用。Zhao 等[39]发现,circE7 是人乳头状瘤病毒产生的一种编码癌蛋白的circRNA,与宫颈癌细胞增殖密切相关,而m6A 修饰是circE7 蛋白质编码能力必要基序。
3.5 m6A修饰的circRNA影响先天免疫
circRNA 是诱导抗原特异性T 细胞激活、抗体产生和体内抗肿瘤免疫强效佐剂,直接触发维甲酸诱导基因I (retinoic acid induced gene I,RIG-I)信号, 促进免疫激活。 m6A-circRNA 可招募YTHDF2 与RIG-I 形成复合物,导致circRNA 降解和先天免疫反应抑制[40-41]。Li 等[42]证实circNDUFB2 通过形成TRIM25/circNDUFB2/IGF2BPs 三元复合物促进IGF2BPs 泛素化降解,激活RIG-I-线粒体抗病毒信号蛋白(MAVS)信号级联,将免疫细胞募集到肿瘤微环境中,最终破坏IGF2BPs 稳定性和激活免疫反应抑制非小细胞肺癌进展,该研究初步明确了circRNA 激活抗肿瘤免疫的机制。免疫检查点阻断疗法(ICBs)阻断PD-1 及其配体PD-L1 显示出对晚期非小细胞肺癌治疗的巨大益处。然而,大量患者对ICBs 反应不佳,对PD-1 治疗产生耐药性。Liu 等[43]报道METTL3 介导circIGF2BP3 的m6A 修饰,以依赖于YTHDC1 方式促进其环化,circIGF2BP3 减少PD-L1 泛素化和蛋白酶体降解,加速肿瘤免疫逃逸,揭示了circIGF2BP3 在晚期肺癌抗PD-L1 治疗调控新机制。
3.6 circRNA异常表达影响m6A修饰
m6A 修饰可调控circRNA 状态和生物学功能,而circRNA 异常表达也参与调控m6A 修饰,继而影响多种肿瘤进展,该过程主要通过circRNA-miRNA轴实现。 例如, METTL3 被miR-34c-3p 抑制,circMETTL3 作为miR-34c-3p 的吸附海绵,上调miR-34c-3p 靶基因METTL3 表达抑制乳腺癌细胞增殖和转移[44]。另一项研究[45]发现,circBACH2 通过海绵吸附hsa-miR-944, 影响MAPK 信号通路刺激HNRNPC 表达,促进乳腺癌细胞增殖。Chi 等[46]证实,circMAP2K4 与hsa-miR-139-5p 结合促进YTHDF1表达,加速肝细胞癌进展。Mo 等[47]报道,hsa_circ_0072309 与miR-607 相互作用上调FTO 表达,促进非小细胞肺癌发生。上述研究揭示了circRNAmiRNA-m6A 互作调控网络,拓宽了肿瘤中其他非编码RNA 研究思路。另外,circRNA 也可通过结合m6A 修饰酶,调控m6A 修饰过程。Huang 等[48]发现circSTAG1 可结合ALKBH5 阻止其入核,影响RNA的m6A 修饰。circGPR137B 在肝细胞癌中显著下调,通过miR-4739 调控FTO 表达,而FTO 又反向影响circGPR137B 的m6A 修饰,形成正反馈通路,抑制癌细胞生长,并且circGPR137B 的下调或miR-4739的上调与患者的预后不良有关[49]。这种通过circRNA 海绵和m6A 修饰之间功能耦合执行的正反馈机制为表观遗传学研究提供了一种新模型。
综上所述,m6A 和circRNA 作为调控致癌或抑癌基因的关键因子,两者相互关联,互相调节。circRNA 既能被m6A 修饰,也可以通过miRNA 分子海绵或结合m6A 修饰酶等机制调控m6A 修饰。但目前研究表明circRNA 不能直接影响m6A 的修改,circRNA-miRNA-m6A 相互作用形成的信号反馈环值得进一步研究(图2)。
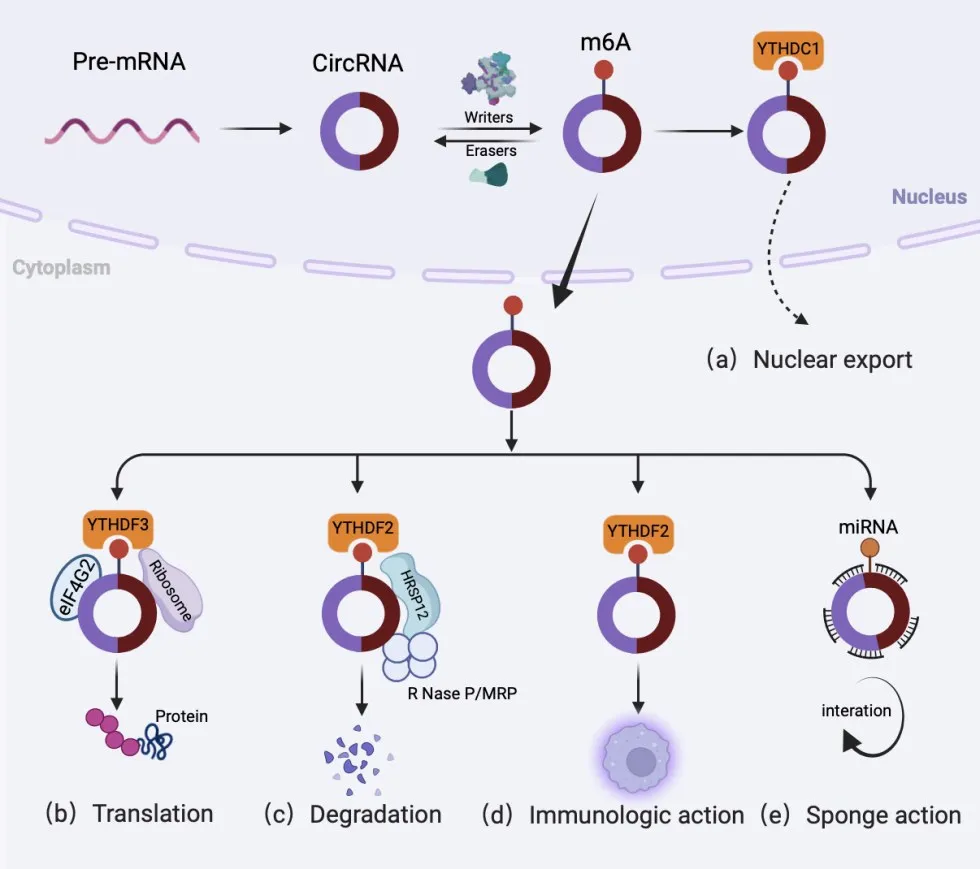
图2 肿瘤中circRNA与m6A修饰的相互作用示意图Figure 2 Illustration of the interaction between circRNAs and m6A modification in tumors
4 circRNA 与m6A 修饰相互作用调控恶性肿瘤生物学行为
circRNA-m6A 交互网络,几乎参与调控肿瘤相关恶性生物学行为所有过程,包括肿瘤增殖、迁移侵袭、转移、干性、耐药性和免疫微环境等,在癌症临床诊断和治疗中起重要作用(表1-2)。
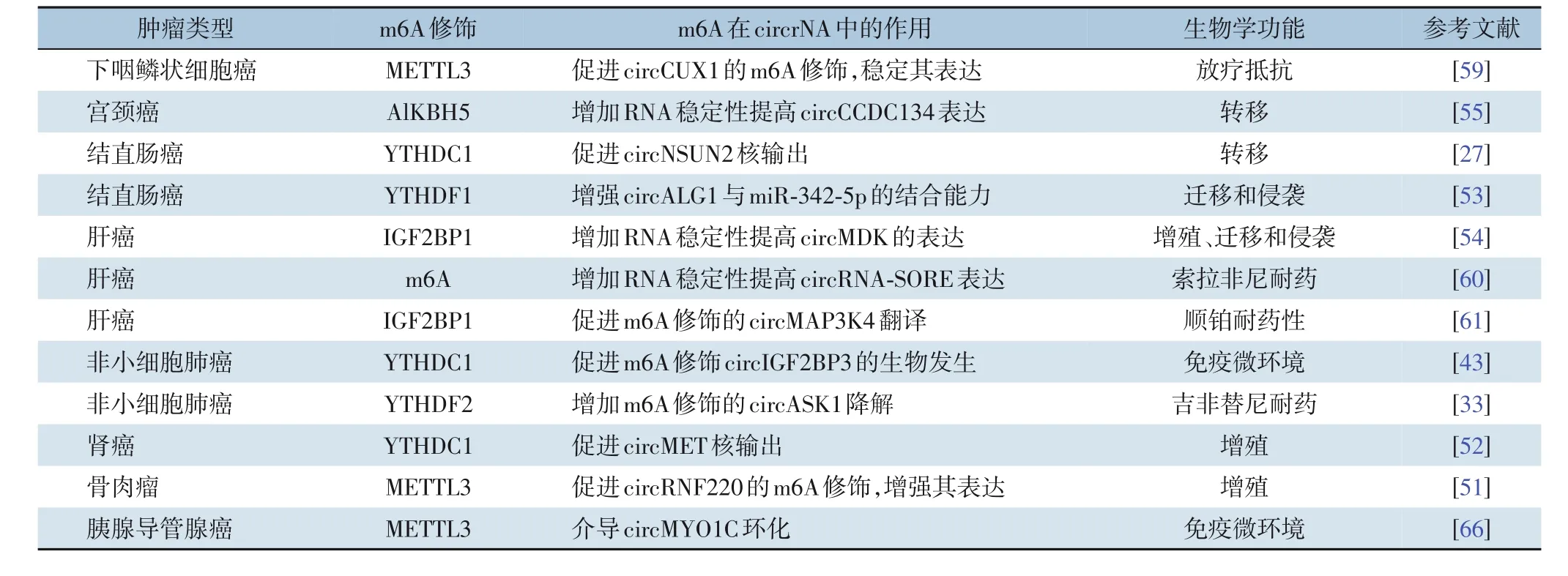
表1 m6A修饰的circRNA在癌症中的作用Table1 The role of m6A-modified circRNAs in cancer
4.1 增殖、迁移和侵袭
肿瘤的增殖、迁移和侵袭是肿瘤发生重要驱动力。 Chen 等[50]报道METTL3 过表达诱导的circ1662 通过加速YAP1 核输出促进结直肠癌细胞迁移和侵袭。另一项研究[51]发现,METTL3 介导的circRNF220 充当miR-330-5p 海绵来上调生存表达,以促进骨肉瘤进展。Yang 等[52]报道,circMET 通过m6A 依赖式方式出核,促进易位型肾癌增殖,circMET 不仅通过充当miRNA“吸附剂”调控SMAD3 表达,还可直接与mRNA 结合调控CDKN2A mRNA 稳定性。YTHDF1 通过增加ALG1 pre-mRNA的m6A 修饰水平,促进circALG1 竞争性内源性RNA 作用,增强结直肠癌细胞侵袭性,circALG1 成为结直肠癌潜在治疗靶点和预后标志[53]。Du 等[54]报道,circMDK 能招募IGF2BP1,提高转录水平稳定性,circMDK 通过海绵吸附miR-346 和miR-874-3p共同靶向ATG16L1,促进肝癌进展。该研究团队还设计了有效下调circMDK 的siRNA,并运用聚(β-氨基酯)(PAEs)阳离子纳米粒子,制备有效递送该siRNA 的PAE-siRNA 复合物,有望成为一种有前景的肝癌纳米治疗药物。
4.2 转移
在肿瘤转移过程中m6A RNA 甲基化修饰发挥双刃剑作用,其功能不同可能与不同的靶基因或信号通路有关。例如,ALKBH5 介导的m6A 修饰circCCDC134 通过增强HIF1A 转录促进宫颈癌转移[55]。然而,外显子circPTPRA 作为肿瘤抑制因子,阻断内源性IGF2BP1 对m6A 修饰的RNA 识别,抑制膀胱癌转移[56]。 同样, Ding 等[57]发现,circPDE5A 以WTAP 依赖方式降低EIF3C mRNA m6A水平和mRNA 翻译效率,WTAP/EIF3C/MAPK 途径削弱了前列腺癌细胞转移能力。
4.3 肿瘤细胞干性
m6A 修饰和circRNA 在肿瘤干细胞自我更新中的作用已有部分研究,例如ALKBH5 介导某些转录本的3'UTR m6A 甲基化,促进缺氧诱导的HIF 依赖的乳腺癌干细胞表型。近期发现了一种circRNA,称为rtcisE2F,在肝脏肿瘤起始细胞(TIC)自我更新中发挥重要作用[58], rtcisE2F 能够和E2F6/E2F3mRNA 及IGF2BP2 相互作用,促进E2F6/E2F3 mRNA 与IGF2BP2 结合,抑制其与YTHDF2 结合,通过切换不同m6A 阅读器与mRNA 结合,促进mRNA 稳定性,该研究首次发现rtcisE2F-IGF2BP2/YTHDF2-E2F6/E2F3-Wnt/β-catenin 通路驱动肝脏TIC自我更新以及肝癌发生和转移,并揭示了circRNA在“m6A mRNA-m6A 阅读器”结合过程中关键作用,提供了消除肝癌干细胞潜在策略。
4.4 耐药
耐药是癌症治疗主要障碍之一。METTL3 在稳定circCUX1 表达方面发挥关键作用,circCUX1 通过与caspase1 相互作用进一步抑制caspase 1 表达,抑制炎症因子(IL-1 和IL-18)释放,增强下咽鳞状细胞癌放疗耐受性[59]。在肝癌细胞系中,m6A 可稳定circRNA-SORE 表达,通过充当miR-103a-2-5p 和miR-660-3p 海绵,竞争性激活Wnt/β-catenin 途径来诱导索拉非尼耐药[60]。 在m6A 修饰驱动下,circMAP3K4 编码circMAP3K4-455aa,保护肝癌细胞免受顺铂影响,靶向circMAP3K4-455aa 可能对肝癌化疗耐药患者提供一种新的治疗策略,预测不良预后[61]。
与此同时,circRNA 可反向调控m6A 修饰参与肿瘤耐药。circ0008399 与WTAP 以m6A 依赖方式增加靶基因TNFAIP3 mRNA 稳定性促进其表达,抑制凋亡,降低膀胱癌对顺铂敏感性[62]。肿瘤能量代谢及氧化还原重编程作为耐药形成重要内环境机理,在circRNA-m6A 的发生发展及其耐药形成中扮演着重要角色。Ding 等[63]研究阐述,外泌体circ_0072083 可通过Warburg 效应下调ALKBH5 介导的去甲基化,调控miR-1252-5p/NANOG 轴,增加胶质瘤中替莫唑胺抗性。circRHBDD1 通过招募YTHDF1 加速PIK3R1 翻译,增强与糖酵解高度相关的PI3K/Akt 信号转导,最终影响肝癌抗PD-1 治疗疗效[64]。在前列腺癌中,EIF4A3 驱动的circARHGAP29 能够提高多西他索耐药前列腺癌的LDHA mRNA 水平。机制上,circARHGAP29 通过与IGF2BP2 相互作用,促进LDHA 介导的糖酵解,稳定LDHA 的表达,揭示了circARHGAP29 在多西他赛相关化疗耐药中的关键作用[65]。如上所述,针对肿瘤化疗和放疗耐药性,m6A RNA 甲基化修饰与糖代谢有一定联系,但在其他代谢途径(如脂肪酸、氨基酸代谢)中研究较少,这可能是未来新的研究方向。
4.5 免疫微环境
circRNA 与m6A 互作参与调节肿瘤免疫反应,部分是通过调节PD-1/PD-L1 通路完成。例如,circMYO1C 在胰腺导管腺癌中高表达,circMYO1C环化由METTL3 介导,circMYO1C 瞄准PD-L1 mRNA的m6A 位点,与IGF2BP2 合作增强其稳定性,从而加速肿瘤免疫逃逸[66]。Wang 等[67]报道卵巢癌中circNFIX 的m6A 修饰升高,其表达与m6A 修饰呈正相关,并取决于IGF2BPs 识别。此外,circNFIX 作为miR-647 竞争性内源性RNA 来上调IL-6R 表达,激活JAK/STAT3 信号和PD-L1 介导的免疫逃逸。香烟提取物(CSE) 诱导的M2 巨噬细胞外囊泡(EVs) 中的circEML4,被运输到非小细胞肺癌细胞,减少ALKBH5 在细胞核中的分布,导致m6A 修饰增加,从而导致SOCS2 的激活。简而言之,吸烟者的circEML4 上升,将会加速非小细胞肺癌的恶化,另外,研究[68]还证明了circEML4 下调,逆转了非小细胞肺癌细胞因EVs 增强的致瘤性和转移性,也就是说戒烟后,非小细胞肺癌细胞有望减缓恶化与转移,该研究揭示了肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)衍生的EVs 中circEML4 在促进非小细胞肺癌进展的生物学意义,为非小细胞肺癌(尤其有吸烟史的患者)提供了一种诊断性生物标志物。胶质瘤是最常见的恶性原发脑肿瘤,具有高免疫抑制的肿瘤微环境(tumor microenvironment,TME),预后较差。Pan等[69]发现circNEIL3 通过阻止HECTD4 介导的泛素化稳定IGF2BP3 蛋白,circNEIL3 过表达的神经胶质瘤细胞驱动巨噬细胞浸润到TME 中,circNEIL3 被hnRNPA2B1 包装成外泌体并传递给TAM,使它们能够通过稳定IGF2BP3 获得免疫抑制性,进而促进胶质瘤进展。
5 临床应用与展望
近年来,关于m6A 修饰与circRNA 在恶性肿瘤中相互作用相关报道不断出现,m6A-circRNA 互作调控网络的深入研究,有望制定个性化治疗手段。circRNA 作为下一代RNA 疗法的核心,不仅用作生物传感器,也用作治疗例如替代治疗性蛋白质和多肽。circRNA 可以解决线性RNA 的局限性,比如增加表达持续时间、稳定性以及减少免疫原性,展现了circRNA 作为一种新“程序化药物”高度稳定性和特异差异表达模式下的巨大潜力。在人工智能(AI)赋能加速mRNA 疫苗和药物研发的潮流下,Zhang 等[70]通过AI 工具来优化mRNA 疫苗序列,帮助创造更有效、更稳定mRNA,该研究开发的线性设计工具—LinearDesign,可优化编码所有治疗性蛋白的mRNA,包括单克隆抗体和抗癌药物。此外,circRNA 疫苗为未来抗肿瘤免疫治疗和逆转治疗耐药性提供了新方向。例如,circRNA 疫苗(VFLIP-X)使用脂肪质纳米颗粒(LNP)递送系统,通过肌肉注射circRNA 进行免疫,在小鼠体内能够针对Sars-CoV2 各种突变体产生强大中和抗体反应[71]。由此可见,circRNA 的应用潜力之大,为医药领域开拓全新的思路。随着m6A 检测技术如甲基化RNA 免疫沉淀测序(MeRIP-seq)、甲基化iCLIP (miCLIP)、基于m6A 标记的测序(m6Alabel-seq)和多样性阵列技术测序(DART-seq)等研发,陆续有m6A RNA 甲基化修饰小分子抑制剂被报道。研究[72]发现了一种新型FTO 抑制剂并对其进行合理设计和优化,其中FTO-43 显示出与临床化疗药物5-氟尿嘧啶相当的效力。另外,STM2457 被鉴定为具有活性的METTL3 小分子抑制剂,能够有效抑制急性髓系白血病发展,对正常造血干细胞是无毒无害,首次证明RNA 甲基转移酶的抑制剂对体内癌症的活性和治疗效果的影响[73]。研究[74]发现,m6A-circRNA 互作与患者总体生存率密切相关。METTL14 在胃癌组织样本中下调,其低表达提示胃癌患者预后不良,m6AcircRNA 表观转录组微阵列和Me-RIP 将circORC5 识别为METTL14 的下游靶标。METTL14 通过调节circORC5/miR-30c-2-3p 轴来抑制胃癌的生长和侵袭,并可能为胃癌提供潜在的治疗靶点。Liang 等[75]通过微阵列和生物信息学分析揭示了m6A 修饰的circRNA 的亲本基因与结直肠癌进展相关,并确定了TPM1 等九个潜在的预后基因,这些基因表达水平同样与结直肠癌预后呈正相关。
迄今为止,开发基于m6A-circRNA 肿瘤治疗策略仍具有挑战性,主要表现在:⑴ circRNA 的纯度、递送载体、免疫原性、药代动力学和在体内的生物分布有待进一步验证;⑵ 许多m6A 测序新技术仍停留在实验阶段,检测稳定性及实验便易程度较差,公认的RNA m6A 修饰水平检测和应用亟需确定;⑶ circRNA-m6A 对肿瘤细胞的影响错综复杂,大多研究聚焦于病理生理基础研究,两者在癌症治疗的交叉调控结果尚未进行临床转化。综上所述,目前迫切需要研发高效Vehicle 递送m6A RNA 甲基化抑制剂,如外泌体、LNP、金属纳米材料、高分子材料等。此外,寻求利用药物化学方法识别具有高活性和高选择性的特定蛋白小分子调节剂将帮助科研人员进一步探索m6A RNA甲基化相关生物学过程机制的有用工具。最后,加强基础研究与临床研究间整合,信息互通,成果共享,为临床转化和应用助力。未来,伴随研究技术的不断补充和优化,必将加速肿瘤中circRNA 与m6A 修饰之间相互作用网络详细作用机制的探明,有助于更好地提出抗癌新策略,服务临床实际治疗。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:王寅格负责选题,写作和收集文献;李丹秀、张文尧负责文章修改;杨桃、靳海峰负责审阅和指导。