茶多酚通过抑制NLRP3炎症小体改善脓毒症小鼠的急性肺损伤
2024-03-18凌旭光徐雯雯庞观来洪旭星刘凤芹
凌旭光,徐雯雯,庞观来,洪旭星,刘凤芹,李 洋
南方医科大学南方医院1健康管理科,2门诊部,广东 广州 510515;3南方医科大学珠江医院消化内科,广东 广州510280
脓毒症是由感染引起的全身炎症反应综合征,发病后进展迅速并可导致多器官功能障碍。继发于脓毒症的急性肺损伤(ALI)或急性呼吸窘迫综合征(ARDS)是脓毒症患者死亡的主要原因之一[1]。即使联合应用机械通气、液体管理和其他支持性治疗措施,脓毒症相关ARDS的死亡率仍较高,目前尚无具体有效的治疗方案[2]。因此,阐明脓毒症相关ALI的发病机制、找寻有效的治疗药物,对拓展其临床治疗策略具有重要意义。
脓毒症相关ALI的主要病理事件之一是细胞因子和其他炎症介质所介导的非受控性炎症反应。宿主来源的危险相关分子模式(DAMPs)可在ALI期间大量生成,并成为先天免疫系统和体内炎症的关键激活因子[3,4]。近年来的研究显示,炎症小体途径的激活是脓毒症相关ALI期间触发的先天免疫防御之一[5]。一旦细胞受到危险信号刺激,细胞内信号平台传感蛋白即可招募适配蛋白和效应蛋白装配形成功能性炎症小体。目前,NLR家族NLRP3 是ALI 中研究最为广泛的炎症小体,NLRP3炎症小体的活化可诱导效应蛋白caspase-1的剪切成熟并促进炎性细胞因子白细胞介素-1β(IL-1β)和IL-18(IL-18)的生成[6]。IL-1β和IL-18的升高对促进肺部炎症进展具有重要作用。此外,Caspase-1还可通过裂解Gasdermin D(GSDMD)而产生N端片段,这些片段可在质膜表面寡聚形成孔道结构,进而通过这些孔道分泌IL-1β和IL-18。质膜表面过多孔道的形成损害了质膜的完整性,可进一步导致细胞焦亡的发生。焦亡是一把双刃剑——它通过释放炎症因子将免疫细胞招募到感染部位,攻击并吞噬病原体,增强适应性免疫反应。然而,过度或不受控制的焦亡和炎症因子的释放则可导致器官损伤、循环衰竭甚至死亡等不良后果。临床研究显示,在脓毒症诱导的ALI患者中,循环IL-18水平的升高与不良的远期预后密切相关[7]。此外,对多种啮齿动物所建立的ALI模型的研究发现,中和IL-18/IL-1β或拮抗IL-1β受体可减轻肺损伤[8]。因此,以NLRP3及其相关通路组分为靶点,可能是治疗脓毒症ALI的潜在途径。
茶多酚(TP)是茶叶中多酚的总称[9],其主要成分包括儿茶素、黄酮类、黄酮醇、花青素、酚酸、酚酸和多酚等[10]。近期研究显示,TP对多种因素诱导的肺损伤及ARDS等疾病具有不同程度的治疗效果[11,12]。然而在脓毒症相关ALI方面,以TP为治疗手段的相关研究较少,其是否能够改善脓毒症相关ALI以及该过程的具体调控机制尚待进一步探索。
研究显示[13],TP对多种疾病的治疗效果与其强大的抗氧化功能密切相关。细胞内氧化应激水平的升高和活性氧代谢产物(ROS)浓度的增加对NLRP3炎症小体的装配与活化具有显著的诱导作用[14]。目前,针对TP改善NLRP3相关炎症的机制研究较少,急性肺损伤时,TP对脓毒症相关肺组织内氧化应激以及活性氧代谢产物的调控尚未见诸报道。因此,TP是否能够通过下调肺组织内氧化应激水平进而抑制NLRP3相关炎症,最终改善脓毒症相关ALI,值得深入探讨,对于找寻ALI新的治疗靶点和治疗方案具有重要意义。
1 材料和方法
1.1 实验动物与试剂
1.1.1 实验动物 8周龄雄性SPF级C57 BL/6小鼠60只,由上海南方模式生物科技股份有限公司提供。
1.1.2 实验试剂 苏木素-伊红染色试剂盒(雷根生物技术);髓过氧化物酶(MPO)、丙二醛(MDA)及过氧化氢(H2O2)检测试剂盒,IL-1β、TNF-α、IL-6酶联免疫吸附实验试剂盒(建成生物);强效RIPA 裂解液(碧云天);MPO 抗体、caspase-8 抗体、NLRP3 抗体、caspase-1 抗体、ASC抗体、NOX4抗体、GAPDH抗体(Abcam);生物素高效标记山羊抗兔IgG(碧云天);DAB显色试剂盒(中杉金桥);Cy3标记山羊抗兔荧光二抗、Alexa Fluor 488标记山羊抗小鼠荧光二抗(碧云天)。本研究经南方医院动物实验《实验动物伦理委员会》审核批准(NFYY-2020-0139)。
1.2 脓毒症肺损伤模型小鼠建立
60只C57 BL/6小鼠随机分为假手术组(Sham组)、盲肠结扎穿孔组(CLP组)和盲肠结扎穿孔+TP治疗组(CLP+TP组),每组20只。CLP组与CLP+TP组小鼠以盲肠结扎穿孔建立脓毒症肺损伤模型:盲肠结扎穿孔方法:腹腔注射戊巴比妥钠麻醉小鼠后,将小鼠固定于小动物手术台,常规备皮消毒,于鼠体正中线右侧0.5 cm处肋弓下缘水平纵行逐层切开腹壁,切口约1 cm,游离小鼠盲肠,以4-0手术缝线在距离盲段1.5 cm处结扎小鼠盲肠,随后以18号注射器针头于盲肠结扎远端做2次对穿并挤出少许粪便,最后还纳盲肠并置于腹腔前壁,逐层关腹。Sham组小鼠开腹后仅对盲肠进行暴露与探查,不进行结扎穿孔。CLP+TP组小鼠于术前1周开始,按250 mg/(kg·d)剂量给予TP灌胃处理。建模完成后,每组随机选取10只小鼠观察记录死亡时间并绘制生存曲线,其他小鼠于建模后24 h以颈椎脱臼法处死并取材进行后续研究。
1.3 标本采集与检测
1.3.1 标本采集 建模完成24 h后,以颈椎脱臼法处死小鼠,随后自胸骨正中线打开胸腔并暴露肺脏,小心将肺脏自胸腔游离后,浸入无菌PBS内漂洗以去除肺叶表面血液。剪取小鼠左肺组织置入RIPA裂解液内(按每20 mg组织配比200 μL裂解液),4 ℃环境充分匀浆后,以4 ℃,12 000 r/min条件离心15 min,取上清以备后续相关蛋白检测;剪取小鼠右上肺用于检测肺组织湿/干重比值检测;剪取小鼠右肺中叶于4%甲醛溶液中固定以制备石蜡标本进行后续病理检测;剪取小鼠右肺下叶用于MPO、MDA、H2O2检测。
1.3.2 肺组织湿/干重比检测 以滤纸吸干右肺上叶表面血液,置入电子天平称量并记录肺组织湿质量,随后将各组小鼠肺组织置于恒温箱内,设定温度60 ℃并脱水干燥过夜,再次于电子天平上称量并记录各组小鼠肺组织干质量。计算肺组织湿/干质量比。
1.3.3 肺组织病理染色及肺损伤评分 以4%甲醛固定各组小鼠右肺中叶24 h,随后肺组织行常规脱水及石蜡包埋、切片,以苏木素-伊红染色试剂盒对各组小鼠肺组织石蜡切片进行HE染色,显微镜下观察肺组织病理结构变化。肺损伤评分参考卜克等[15]文献报道,从肺泡水肿、出血、肺不张、炎性细胞浸润及透明膜形成等5方面评分(每项正常0、轻度1、中度2、重度3,最高15分)。
1.3.4 免疫组化及免疫荧光检测 石蜡切片常规脱蜡至水后,浸入枸橼酸盐内进行微波抗原修复,修复完成待玻片冷却后滴加过氧化氢以灭活内源性过氧化物酶(免疫荧光染色跳过此步骤),5%山羊血清封闭30 min后滴加一抗,4 ℃孵育过夜。一抗孵育完成后洗涤标本,滴加相应二抗(免疫荧光染色应注意避光操作),37 ℃孵育30 min后,洗涤二抗。免疫组化以苏木素染核后脱水封片;免疫荧光以DAPI染核后直接封片。
1.3.5 蛋白免疫印迹实验 提取各组小鼠左肺总蛋白并测定蛋白浓度后,将蛋白与上样缓冲液混合并于100 ℃下水浴变性5 min。随后进行SDS-PAGE凝胶电泳及转膜。转膜完成后以5%牛血清白蛋白室温封闭30 min,随后加入相关一抗于4 ℃孵育过夜。一抗孵育完成后洗涤并继续加入荧光二抗,室温孵育30 min后压干,以近红外扫描仪扫描并分析。
1.3.6 MPO、MDA、H2O2检测 取各组小鼠右肺下叶组织进行检测,相应检测步骤严格遵照各检测试剂盒说明书进行。
1.4 统计与绘图
使用Graph Pad Prism version 7.0软件,数据以均数±标准差表示,多组间数据比较采用单因素方差分析,当Ρ<0.05时认为差异具有统计学意义。
2 结果
2.1 TP缓解CLP诱导的小鼠ALI
生存曲线显示术后12~36 h CLP组小鼠存活率明显下降,术后72 h内CLP组小鼠存活率较Sham组小鼠显著降低;而与CLP组相比,CLP+TP组小鼠术后72 h内死亡率显著降低,生存曲线可见CLP+TP组小鼠于术后36~48 h呈明显下降趋势,较CLP组小鼠显著延后(图1A,Ρ<0.05)。肺湿/干质量比及MPO测定显示,与假手术组相比,CLP组小鼠肺湿/干质量比及MPO含量显著升高,而CLP+TP组小鼠肺湿/干质量比及MPO含量则较CLP组显著下降(图1B、C,Ρ<0.05)。H&E染色可见CLP组小鼠肺组织内充血、间质水肿,肺泡结构损伤,肺泡腔范围减少,淋巴细胞、中性粒细胞及巨噬细胞等炎性细胞大量浸润,而TP治疗组小鼠肺组织内病变程度较CLP组显著减轻,ALI评分提示,与CLP组小鼠相比,TP治疗组小鼠ALI评分显著降低(图1D、E,Ρ<0.05)。
2.2 TP减轻CLP小鼠肺内NLRP3相关炎症
ELISA检测结果显示,CLP术后小鼠肺组织内IL-1β、TNF-α及IL-6等炎症因子含量显著升高,而CLP+TP组小鼠肺组织内上述炎症因子水平则较CLP组显著降低(图2A,Ρ<0.05);Western blot检测结果显示,与假手术组相比,CLP组小鼠肺组织内NLRP3、ASC及caspase-1蛋白表达水平显著升高,而CLP+TP组小鼠肺组织内上述蛋白表达水平较CLP组显著降低(图2B,Ρ<0.05)。免疫组化检测结果显示,与Sham组相比,CLP组小鼠肺组织内MPO、caspase-8及NLRP3蛋白表达显著上调,而TP治疗则可显著抑制CLP所诱导的上述蛋白在肺组织内的表达(图2C)。
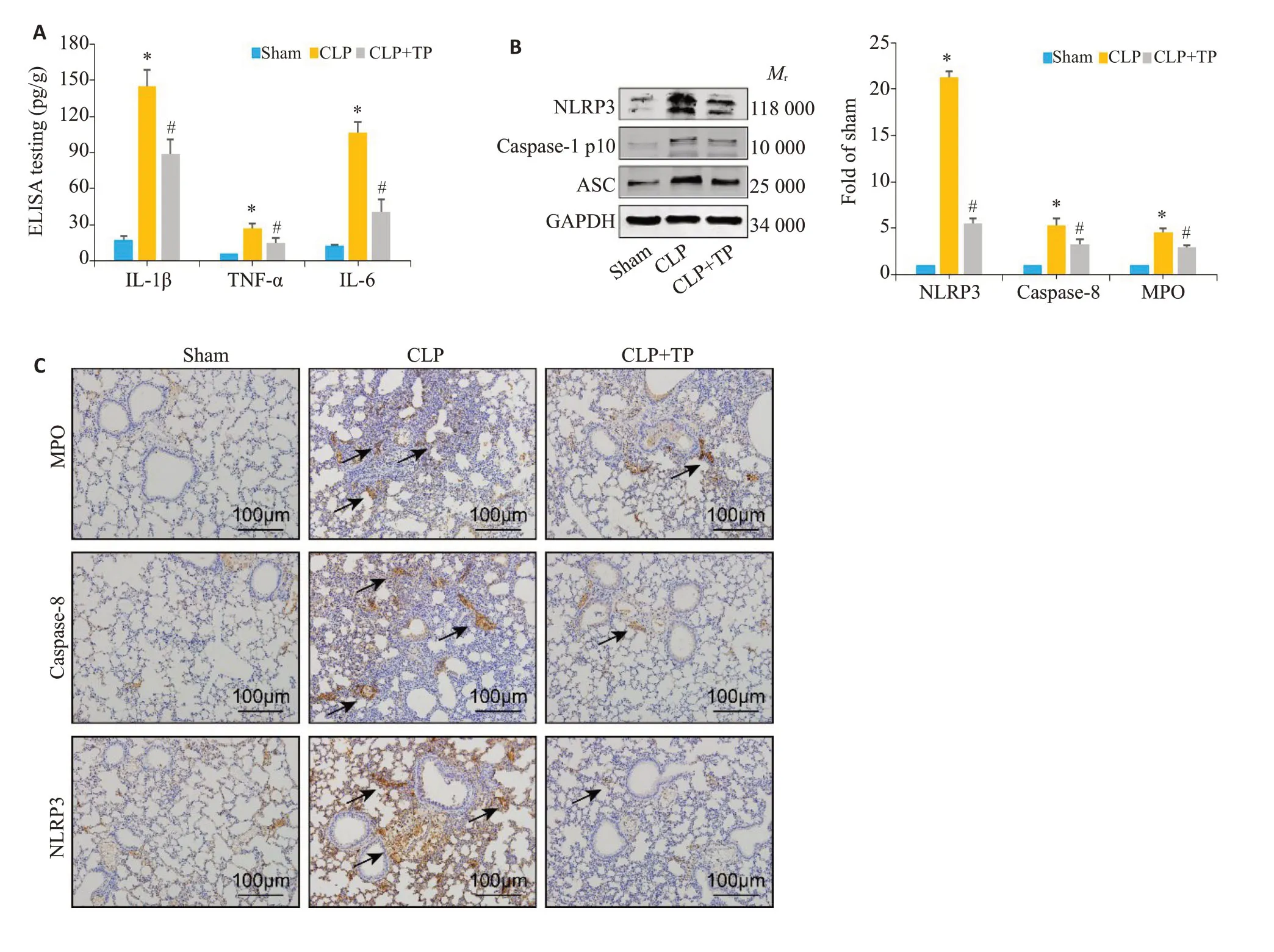
图2 TP抑制CLP小鼠肺组织内炎症相关蛋白表达Fig.2 TP inhibits expressions of inflammationrelated proteins in the lung tissues of CLP mice detected using ELISA(A),Western blotting(B)and immunohistochemistry (C).*P<0.05 vs Sham group;#P<0.05 vs CLP group.
2.3 TP抑制CLP小鼠肺内氧化应激
各组小鼠肺组织MDA及H2O2水平检测结果显示,CLP术后小鼠肺内MDA及H2O2水平较假手术组显著升高,而TP治疗组小鼠肺组织内MDA及H2O2水平则较CLP组显著降低(图3A、B,Ρ<0.05)。对氧化应激相关蛋白NOX4的免疫组化检测结果显示,TP治疗可显著抑制CLP 所诱导的小鼠肺组织内NOX4 蛋白表达(图3C)。NLRP3及NOX4蛋白的免疫荧光共染检测结果显示,CLP组小鼠肺组织内上述2种蛋白表达显著增多且具有明显共定位,而TP可抑制CLP术后小鼠肺组织内NLRP3及NOX4蛋白表达并减少二者的共定位(图3D)。
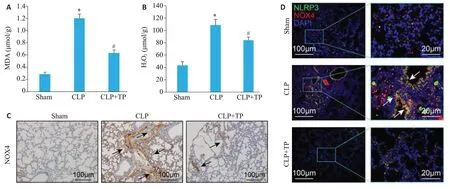
图3 TP影响CLP小鼠肺组织内氧化应激水平Fig.3 TP lowers oxidative stress level in the lung tissue of CLP mice.A:MDA level in the lung tissues.B:H2O2 level in the lung tissues.C: Immunohistochemical staining of NOX4 in the lung tissues. D: Immunofluorescence detection of NLRP3 and NOX4 in the lung tissues.*P<0.05 vs Sham group;#P<0.05 vs CLP group.
3 讨论
脓毒症相关肺损伤是一种严重的肺部疾病,以肺部毛细血管水肿为特征并可导致急性呼吸衰竭[16]。促炎细胞因子的大量生成和肺内细胞过度的炎症反应是脓毒症相关肺损伤的关键病理因素[17]。因此,探索和开发新的抗炎物质对预防和治疗脓毒症相关肺损伤至关重要。
目前,针对TP改善NLRP3相关炎症的机制研究较少,急性肺损伤时,TP对脓毒症相关肺组织内氧化应激以及活性氧代谢产物的调控尚未见诸报道。因此,TP是否能够通过下调肺组织内氧化应激水平进而抑制NLRP3相关炎症,最终改善脓毒症相关ALI,值得深入探讨。本研究利用CLP法成功建立脓毒症相关ALI小鼠模型,通过给予小鼠TP处理后,发现TP可有效减少CLP术后小鼠肺组织内炎症因子水平、减轻CLP引起的小鼠ALI并降低小鼠死亡率。同时,本研究的免疫荧光共染检测结果提示,TP改善CLP小鼠ALI的机制可能与其减轻CLP后肺内氧化应激、抑制小鼠肺组织内NLRP3炎症小体相关炎症因子释放有关。
既往研究证实,TP具有广泛的抗炎活性[18]。Li等[19]研究发现,在脂多糖诱导的脓毒血症动物模型中,TP可明显抑制内毒素诱导的TNF-α分泌,改善血流动力学状态,降低内毒素的致死率。研究显示,TP的主要有效成分之一,表没食子儿茶酚胺(EGCG)可通过调控IL-1β抑制白细胞活化,从而发挥抗炎作用[20]。由此可见,TP对感染性炎症相关的多种疾病具有一定的治疗作用。与本研究一致的,Bae等[21]通过脂多糖诱导建立小鼠ALI模型后,观察到EGCG可通过调控ERK1/2信号通路和JNK蛋白的磷酸化水平降低炎性因子表达,抑中性粒细胞在肺内的聚集,进而减轻脂多糖造成的肺损伤。因此,TP的抗炎特性使其在脓毒症相关ALI中具有良好的潜在转化价值。
有研究认为[22],NLRP3炎症小体参与了多种炎症相关疾病,可能是炎症性疾病发生发展过程中的关键调控因子。研究显示[23],胞内氧化还原失衡是NLRP3的活化的关键途径之一。研究显示,失血性休克时,高迁移率蛋白1可通过TLR4模式激活肺内皮细胞NAD(P)H氧化酶,而激活后的NAD(P)H氧化酶所生成的ROS可进一步解离与硫氧还原蛋白互作的蛋白,使之转而与NLRP3蛋白结合,而诱导NLRP3炎症小体活化和IL-1β的分泌[24]。因此,对细胞内氧化还原平衡的调控可能是抑制NLRP3炎症小体活化、改善相关疾病炎症反应的潜在有效靶点。
由于细胞内氧化应激水平升高所引起的ROS大量生成是NLRP3活化的关键诱导剂之一。多项研究证实TP具有显著的抗氧化作用[25],与本研究一致。本研究首次发现TP可抑制CLP小鼠肺组织内氧化应激相关蛋白NOX4表达并减少ROS生成;同时,对脓毒症肺损伤小鼠肺组织的免疫荧光染色检测结果显示:氧化应激相关蛋白NOX4与NLRP3蛋白在CLP小鼠肺组织内表达显著增多且具有明显的共定位,而应用TP治疗后,上述2种蛋白在小鼠肺组织内的表达下调、共定位减少,提示TP可能通过抑制NOX4相关氧化应激反应,下调肺组织内ROS含量,阻碍NLRP3炎症小体的活化,进而减少脓毒症相关肺损伤时肺内炎症因子的释放,最终改善脓毒症相关肺损伤。值得指出的是,Wang等[26]在近期研究中指出,GSDMD并非诱导焦亡的唯一途径,LPS刺激可通过caspase-3和GSDME相关信号通路诱导细胞焦亡从而替代传统的GSDMD或caspase-1信号通路而发挥NLRP3的促炎和促焦亡作用。本研究关于TP对NLRP3与氧化应激相关通路的探讨,受限于临床样本获取的困难,未能其下游对GSDMD和GSDME炎症信号通路的调控作进一步研究。此外,TP对肺内巨噬细胞炎症的调控机制可能存在多种效应,相关的挽救机制亦有待深入探讨。
综上所述,本研究明确了TP治疗可抑制NLRP3炎症小体并减轻脓毒症小鼠肺损伤,且这一作用可能依赖TP通过抑制NOX4所发挥的抗氧化效应。但由于本研究局限于动物组织和病理层面观察,因此NOX4 与NLRP3蛋白的相互作用关系及TP对脓毒症时肺组织内氧化应激与炎症小体调控的具体机制仍有待进一步探讨。
