秋水仙碱通过激活AMPK减轻小鼠心肌缺血再灌注损伤
2024-03-18陈国栋罗素新
陈国栋,罗素新
重庆医科大学附属第一医院心血管内科,重庆400016
急性心肌梗死(AMI)是一种因冠状动脉内粥样斑块破裂、管腔内血栓形成等原因引起的血管闭塞导致的心肌组织缺血梗死的急性心脏病,它在全世界有着非常高的发病率和死亡率[1,2]。随着科学技术取得长足的发展,再灌注治疗如溶栓和经皮冠状动脉介入治疗术已经在各个地区被广泛的应用和开展,并成为了AMI的常规治疗策略[3,4]。然而相关研究证实再灌注治疗也会对患者的心肌产生不利影响,导致心功能降低[5]。探索降低再灌注损伤的方法,保护心脏功能对急性心肌梗死的治疗是非常有意义的。
心肌缺血再灌注损伤(I/R)所涉及的机制非常复杂,包括线粒体功能障碍、活性氧增多、细胞凋亡、钙超载等[6,7]。线粒体功能障碍在其中扮演着非常重要的角色,线粒体是细胞的能量工厂,它的正常工作可以为细胞提供正常生理功能所需的能力物质——ATP[8]。心脏跳动伴随着生物的一生,心肌细胞无时无刻不在跳动,需要大量的能量,因此心肌细胞含有丰富的线粒体[9]。当线粒体出现功能障碍时,会停止ATP的产生,并进而产生大量的活性氧产生细胞损害[10]。同时,线粒体发生功能障碍时可以介导线粒体途径的凋亡发生,加重组织功能障碍[11]。
秋水仙碱(CCC)是一种有着悠久的使用历史的抗炎药物,其通过破坏微管蛋白,进而影响炎症反应过程和途径[12]。秋水仙碱对先天免疫系统有广泛的抑制作用,包括吞噬作用、炎症小体激活、中性粒细胞招募和功能等[13]。临床上秋水仙碱常用于急性痛风、复发性心包炎等疾病的治疗[14]。相关研究证明秋水仙碱可以通过对抗氧化应激和炎症反应改善骨骼肌缺血再灌注损伤的作用[15]。一项针对H9C2细胞进行的研究表明,秋水仙碱可以通过PI3K/AKT通路对抗缺氧复氧处理导致的H9C2凋亡增加[16],提示秋水仙碱在体外模拟心肌缺血再灌注损伤时具有保护作用,但缺乏体内实验加以验证。进一步明确秋水仙碱发挥保护作用的机制,可以为秋水仙碱用于治疗心肌缺血再灌注损伤提供坚实的理论基础。
AMPK是细胞中最重要的能量调节因子之一,与体内多种代谢调节、信号传导有关[17,18]。许多研究证实AMPK可以调节心肌线粒体功能,激活AMPK被证实可以减少心肌缺血再灌注损伤[19,20]。研究表明AMPK介导了秋水仙碱在巨噬细胞中的多种抗炎作用[21]。因此我们假设在心肌缺血再灌注损伤中,秋水仙碱治疗同样具有激活AMPK进而改善心脏功能,并从体外和体内两个层面来对此设想进行探究。
1 材料和方法
1.1 实验动物和试剂
8周龄雄性C57BL/6小鼠(体质量约20 g)购自重庆医科大学实验动物中心,本实验所涉及的动物实验方案由重庆医科大学实验动物管理和使用委员会审查并批准(批准编号:IACUC-CQMU-2023-0064)。H9C2心肌细胞系(武汉普诺赛);AMPK 抗体、NRF2 抗体(Wanleibio);p-AMPKα(T172)抗体(Bimake);秋水仙碱和DSMP(MCE);BAX 抗体、Bcl-2 抗体、NOX4 抗体、SOD2抗体、COX IV抗体、β-actin抗体、羊抗鼠二抗和羊抗兔二抗(Proteintech);cleaved caspase-3 抗体、Cytochrome c(Cyto C)(Cell Signaling Technology);8-OHdG(Santa Cruz Biotechnology,Inc.);Cy5羊抗鼠二抗和FITC羊抗兔二抗(Servicebio);LDH试剂盒(南京建成生物工程研究所);Mouse Cardiac Troponin T Elisa Kit,2% 2,3,5-氯化三苯基四氮唑(TTC)溶液(Solarbio);ATP检测试剂盒、组织线粒体分离试剂盒(Beyotime);CCK-8(Biosharp)。
1.2 方法
1.2.1 细胞培养 H9C2心肌细胞系被用于本研究体外实验,并培养在含10%胎牛血清(PAN)的DMEM高糖培养基(Gibco)中。行缺氧/复氧(H/R)处理时,首先将H9C2细胞接种培养24 h,饥饿4 h,在饥饿处理的最后1 h在H/R+CCC组加入3 nmol/L 秋水仙碱预处理1 h,在后续处理中,每更换一次培养基均在该组培养基中加入3 nmol/L秋水仙碱,秋水仙碱使用浓度参考文献[22]。然后将细胞培养基更换为不含葡萄糖和血清的DMEM(Gibco),并在低氧培养箱中培养4 h(5%CO2,1%O2和94%N2),以进行缺氧处理。再通过将缺血DMEM改变为完全培养基(含4.5 g葡萄糖和10%胎牛血清)并使用95%空气+5%CO2培养来启动复氧过程。在复氧4 h后收集细胞以用于Western blotting检测,复氧24 h小鼠后用于细胞活力检测。
1.2.2 Western blotting 配制一定体积RIPA裂解液,在RIPA裂解液(武汉赛维尔)按1∶100的比例加入PMSF、磷酸化蛋白酶抑制剂A液和磷酸化蛋白酶抑制剂B液(武汉赛维尔)。将冷冻于-80 ℃的心脏样品取出,切取心尖再灌注区域心肌组织,加入配制好的的RIPA裂解液并使用匀浆机粉碎组织取得蛋白。对于细胞蛋白,在六孔板加入配置好的RIPA裂解液刮取细胞取得蛋白。使用BCA法测定蛋白浓度并配平,加入上样缓冲液后混匀,并放置于沸水中水浴加热10 min完成样品制备。使用10%~12%SDS-PAGE凝胶分离样品中的蛋白,并将蛋白转印至PVDF 膜上。使用含5%脱脂牛奶的TBST对转印完毕的PVDF膜进行封闭。在4 ℃冰箱中孵育相应的一抗8~12 h。一抗稀释比例依次为:p-AMPK(1∶1000)、AMPK(1∶1000)、NOX4(1∶1000)、NRF2(1∶500)、SOD2(1∶5000)、BAX(1∶2000)、Bcl-2(1∶1000)、cleaved caspase-3(1∶1000)、Cyt C(1∶1000)、β-actin(1∶5000)、COX IV(1∶10 000)。一抗孵育结束后,取出PVDF膜,使用TBST洗去残留一抗,于室温中孵育对应的二抗1 h,二抗稀释比例为1∶10 000。弃去二抗,并使用TBST洗去残留二抗,使用ECL化学发光法检测蛋白表达。
1.2.3 细胞活力 细胞活力使用CCK-8的方法检测,将细胞种于96 孔板,处理同1.2.1,但复氧时间调整为24 h。到达处理终点时,弃去培养基。PBS清洗后,每孔加入100 μL无血清DMEM培养基+10 μL CCK-8溶液,于37 ℃中孵育3 h,使用酶标仪测定在450 nm处的吸光值。
1.2.4 小鼠心肌缺血再灌注损伤模型 共计32只小鼠被随机分为:假手术(SO)组,I/R组、I/R+CCC组和I/R+CCC+Dorsomorphin(DSMP)组,每组8只。各组中,再随机选取4只于再灌注开始后3 h处死取材,4只于再灌注开始后24 h处死取材。本实验方法参考先前的研究[23]。使用1%戊巴比妥钠(60 mg/kg)将小鼠麻醉后。将小鼠固定在加热毯上,保持小鼠体温在37 ℃。经口对小鼠行气管插管术并连接至小鼠呼吸机(MiniVent 845)。对其胸部剃毛,并使用碘伏进行消毒。在左胸中部皮肤切一约1 cm横切口,分离肌肉组织,暴露胸壁,在第三肋间切开肋间隙组织,暴露心脏。在左前降支处穿线,将一根直径约1 mm塑料小棒一起结扎,开始缺血。对SO组小鼠,仅在前降支处穿线,而不结扎。缺血15 min后,腹腔注射0.4 mg/kg 秋水仙碱或等体积溶剂,秋水仙碱注射剂量参考文献[24]。注射15 min后剪断绳结,并移除塑料小棒和残留线段,开始再灌注。逐层缝合切口,将小鼠放置于另一加热毯等待苏醒。3 h后再次麻醉小鼠,摘取心脏用于WB、ATP含量、荧光染色检测。为充分抑制AMPK活性,手术前2 h以20 mg/kg的剂量对相应组别小鼠注射DSMP,剂量参考文献[25]。用于评估心功能、梗死范围、血清LDH和cTnT检测的小鼠,再灌注24 h再进行,并在术后12 h再次注射1次同等剂量药物。血液收集于非抗凝管,并离心10 min(3000 r/min),收集上清液并保存于-80 ℃冰箱用于后续实验。
1.2.5 组织ATP含量 心肌组织ATP含量使用商业检测试剂盒进行,方法依照生产厂家说明书,最后检测化学发光。
1.2.6 荧光染色 将组织浸泡于4%多聚甲醛中24 h,进行石蜡包埋,并切为5 μm厚的切片置于载玻片上。染色时,使用二甲苯进行脱蜡,后在乙醇中进行再水化。切片浸泡于柠檬酸钠中放入微波炉加热以修复抗原。使用3%过氧化氢阻断内源性过氧化物酶,后使用含10%山羊血清的PBS进行封闭1 h。使用相应的一抗于4 ℃冰箱中孵育过夜,抗体稀释比例为:8-OHdG(1∶200)、cleaved caspase-3(1∶400)。然后使用相应的荧光二抗孵育1 h,8-OHdG 使用Cy3 羊抗鼠二抗,cleaved caspase-3使用FITC羊抗兔二抗,抗体稀释比例均为1∶100,随后用DAPI 染细胞核。滴加抗荧光淬灭剂封片后,使用正置荧光显微镜拍照,使用imageJ进行统计分析。
1.2.7 组织线粒体提取 使用商业试剂盒分离心肌组织线粒体和细胞胞浆蛋白,方法依照厂家说明书,使用Western blot的方法分别检测对应蛋白变化。
1.2.8 心脏超声 再灌注24 h的小鼠用于评估心脏超声,方法参考先前的研究[26]。使用1%~2%异氟烷麻醉小鼠并固定于加热毯上,使体温保持在37 ℃,心率保持在400~500 beats/min。使用L8-18i-D PROBE超声探头(GE Healthcare)在乳头肌水平的短轴视图上进行二维导向M型测量,测量包括左室射血分数(LVEF)和左室缩短系数(LVFS)。
1.2.9 心肌梗死面积评估 对再灌注24 h的小鼠心脏切片染色评估梗死面积,使用2%TTC溶液对心肌组织切片于37 ℃进行染色30 min,白色为梗死区域。使用imageJ对估计梗死区域占比。
1.2.10 血清LDH和检测 血清LDH检测使用商用试剂盒进行,方法依照生产厂家说明书,使用酶标仪对各个样品吸光度进行测定,根据说明书计算LDH活性。
1.2.11 血清cTnT 检测 血清cTnT 检测使用商用ELISA试剂盒进行检测,方法依照生产厂家说明书,使用酶标仪对各个样品吸光度进行测定,根据说明书计算血清cTnT含量。
1.3 统计学处理
本实验涉及实验数据均来自于4 次独立实验结果。使用均数±标准差表示数据。使用GraphPad Prism 8.0软件进行统计分析,比较各组间差异采用单因素方差分析后进行Turkey检验,Ρ<0.05为差异有统计学意义。使用Microsoft excel制作统计图。
2 结果
2.1 秋水仙碱对H9C2细胞H/R损伤的保护作用
与对照组组相比,H/R处理显著降低了H9C2细胞的p-AMPK(Ρ<0.05,图1B)、NRF2(Ρ<0.05,图1E)、SOD2(Ρ<0.05,图1F)和Bcl-2(Ρ<0.05,图1H)的表达和细胞活力(Ρ<0.05,图1J),并使NOX4(Ρ<0.05,图1D)、BAX(Ρ<0.05,图1G)和cleaved caspase-3(Ρ<0.05,图1I)表达上升。与H/R组相比,H/R+CCC组p-AMPK(Ρ<0.05,图1B)、NRF2(Ρ<0.05,图1E)、SOD2(Ρ<0.05,图1F)和Bcl-2(Ρ<0.05,图1H)的表达和细胞活力(Ρ<0.05,图1J)升高,而NOX4(Ρ<0.05,图1D)、BAX(Ρ<0.05,图1G)和cleaved caspase-3(Ρ<0.05,图1I)的表达部分降低。

图1 秋水仙碱对H9C2细胞缺氧复氧损伤的保护作用Fig.1 Protective effect of 3 nmol/L colchicine(CCC)against hypoxia-reoxygenation injury in H9C2 cells.A:Western blots of p-AMPK/AMPK in H9C2 cells with different treatments. B: Quantitative analysis of the p-AMPK/AMPK (n=4). C-I:Western blots of NOX4,NRF2,SOD2,BAX,Bcl-2,and cleaved caspase-3 in H9C2 cells and quantitative analysis of the protein expressions(n=4).J:Quantitative analysis of viability of H9C2 cells.*P<0.05 vs Control group;#P<0.05 vs H/R group.
2.2 秋水仙碱可以逆转I/R 手术导致的小鼠心肌p-AMPK降低
与SO组相比,I/R手术可以降低小鼠心肌p-AMPK(Ρ<0.05)的表达。与I/R组相比,I/R+CCC组p-AMPK(Ρ<0.05)表达上升(图2)。

图2 秋水仙碱可以逆转I/R手术导致的小鼠心肌p-AMPK降低Fig.2 Colchicine reverses reduction of myocardial p-AMPK expression induced by I/R in mice. A: Western blots of p-AMPK/AMPK in the myocardium of mice in sham-operated (SO),I/R,and I/R+CCC groups. B:Quantitative analysis of the protein expressions(n=4).*P<0.05 vs SO group;#P<0.05 vs I/R group.
2.3 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌线粒体功能障碍
与SO组相比,I/R手术可以降低小鼠心肌ATP含量(Ρ<0.05)。与I/R组相比,I/R+CCC组ATP含量(Ρ<0.05)上升。与I/R+CCC组相比,I/R+CCC+DSMP组ATP含量(Ρ<0.05)下降(图3)。
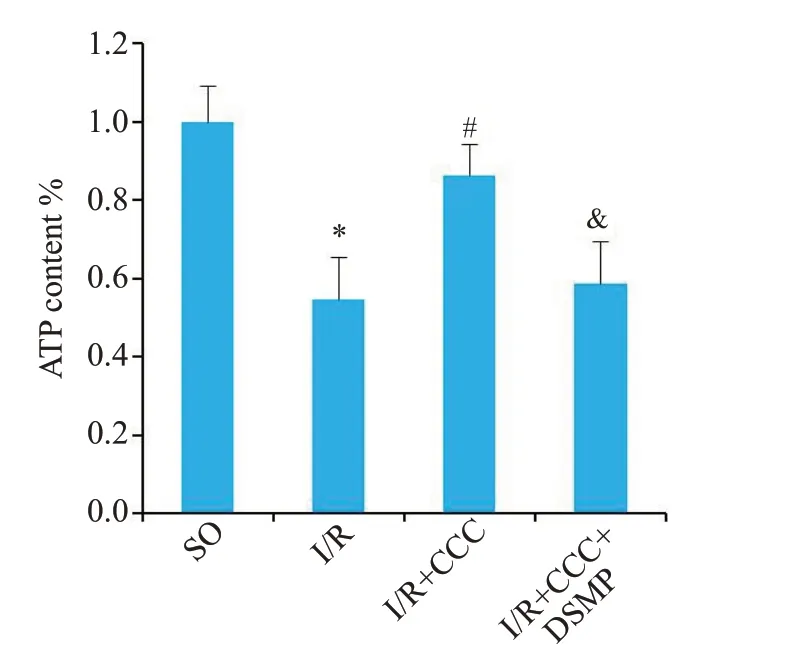
图3 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌线粒体功能障碍Fig.3 Colchicine reverses I/R injury-induced myocardial mitochondrial dysfunction in mice by activating AMPK.Myocardial ATP content is quantitatively analyzed in SO,I/R,I/R+colchicine,and I/R+colchicine+DSMP groups(n=4).*P<0.05 vs SO group;#P<0.05 vs I/R group;&P<0.05 vs I/R+colchicine group.
2.4 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌氧化应激增加
与SO组相比,I/R手术可以提高小鼠心肌NOX4(Ρ<0.05,图4B)的表达和8-OHdG阳性染色率(Ρ<0.05,图4F),降低NRF2(图4C)和SOD2(图4D)的表达。与I/R组相比,I/R+CCC组NOX4(Ρ<0.05,图4B)表达和8-OHdG 阳性染色率(Ρ<0.05,图4F)降低,NRF2(Ρ<0.05,图4C)和SOD2(Ρ<0.05,图4D)表达上升。与I/R+CCC 组相比,I/R+CCC+DSMP 组NOX4(Ρ<0.05,图4B)表达和8-OHdG阳性染色率(Ρ<0.05,图4F)升高,NRF2(Ρ<0.05,图4C)和SOD2(Ρ<0.05,图4D)表达降低(图4)。
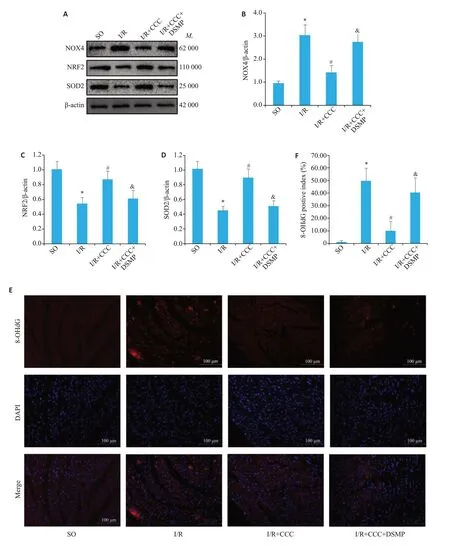
图4 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌氧化应激增加Fig.4 Colchicine reverses increased myocardial oxidative stress induced by I/R injury in mice by activating AMPK. A:Western blots of NOX4,NRF2,and SOD2 in the myocardium of mice in SO,I/R,I/R+colchicine,and I/R+colchicine+DSMP groups.B-D:Quantitative analysis of the protein expressions(n=4).E,F:Immunofluorescence staining of 8-OHdG in the myocardium of mice from SO,I/R,I/R+colchicine,and I/R+colchicine+DSMP groups.*P<0.05 vs SO group;#P<0.05 vs I/R group;&P<0.05 vs I/R+colchicine group.
2.5 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌细胞线粒体途径凋亡增加
与SO 组相比,I/R 手术可以提高小鼠心肌Mito-BAX(Ρ<0.05,图5B)和Cyt-Cyto C(Ρ<0.05,图5D)的表达。与I/R组相比,I/R+CCC组Mito-BAX(Ρ<0.05,图5B)和Cyt-Cyto C(Ρ<0.05,图5D)表达降低。与I/R+CCC组相比,I/R+CCC+DSMP组Mito-BAX(Ρ<0.05,图5B)和Cyt-Cyto C(图5D)表达升高(图5)。
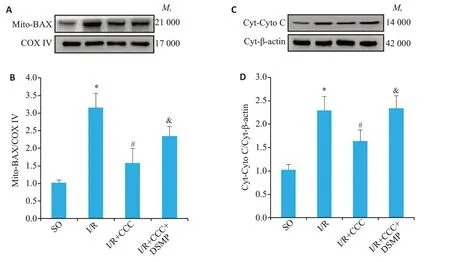
图5 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌细胞线粒体途径凋亡增加Fig.5 Colchicine reverses increased mitochondrial pathway apoptosis in mouse cardiomyocytes induced by I/R by activating AMPK.A,B:Western blotting of Mito-BAX in the myocardium of mice from SO,I/R,I/R+colchicine,and I/R+colchicine+DSMP groups(n=4).C,D:Western blotting of Cyt-Cyto C in the myocardium of the mice in the 4 groups(n=4).*P<0.05 vs SO group;#P<0.05 vs I/R group;&P<0.05 vs I/R+colchicine group.
2.6 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌细胞凋亡增加
与SO组相比,I/R手术可以提高小鼠心肌BAX(Ρ<0.05,图6B)、cleaved caspase-3(Ρ<0.05,图6D)的表达和cleaved caspase-3(Ρ<0.05,图6F)的阳性染色率,降低Bcl-2(Ρ<0.05,图6C)的表达。与I/R 组相比,I/R+CCC 组BAX(Ρ<0.05,图6B)、cleaved caspase-3(Ρ<0.05,图6D)表达和cleaved caspase-3(Ρ<0.05,图6F)的阳性染色率降低,Bcl-2(Ρ<0.05,图6C)表达上升。与I/R+CCC组相比,I/R+CCC+DSMP组BAX(Ρ<0.05,图6B)、cleaved caspase-3(Ρ<0.05,图6D)表达和cleaved caspase-3(Ρ<0.05,图6F)的阳性染色率升高,Bcl-2(Ρ<0.05,图6C)表达降低(图6)。

图6 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心肌细胞凋亡增加Fig.6 Colchicine reverses increased myocardial cell apoptosis induced by I/R in mice by activating AMPK.A-D:Western blotting of BAX,Bcl-2,and cleaved caspase-3 in the myocardium of mice in SO,I/R,I/R+colchicine,and I/R+colchicine+DSMP groups(n=4).E,F:Immunofluorescence staining of cleaved caspase-3 in the myocardium of the mice.*P<0.05 vs SO group;#P<0.05 vs I/R group;&P<0.05 vs I/R+colchicine group.
2.7 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心功能下降和心脏损伤
与SO组相比,I/R手术可以提高小鼠心肌梗死面积(Ρ<0.05,图7F)、血清LDH(Ρ<0.05,图7G)和cTnT(Ρ<0.05,图7H)含量,降低LVEF(Ρ<0.05,图7B)和LVFS(Ρ<0.05,图7C)。与I/R组相比,I/R+CCC组心肌梗死面积(Ρ<0.05,图7F)、血清LDH(Ρ<0.05,图7G)和cTnT(Ρ<0.05,图7H)含量降低,LVEF(Ρ<0.05,图7B)和LVFS(Ρ<0.05,图7C)上升。与I/R+CCC组相比,I/R+CCC+DSMP组心肌梗死面积(Ρ<0.05,图7F)、血清LDH(Ρ<0.05,图7G)和cTnT(Ρ<0.05,图7H)含量升高,LVEF(Ρ<0.05,图7B)和LVFS(Ρ<0.05,图7C)下降。各组小鼠心率之间差异无统计学意义(Ρ>0.05,图7D)。
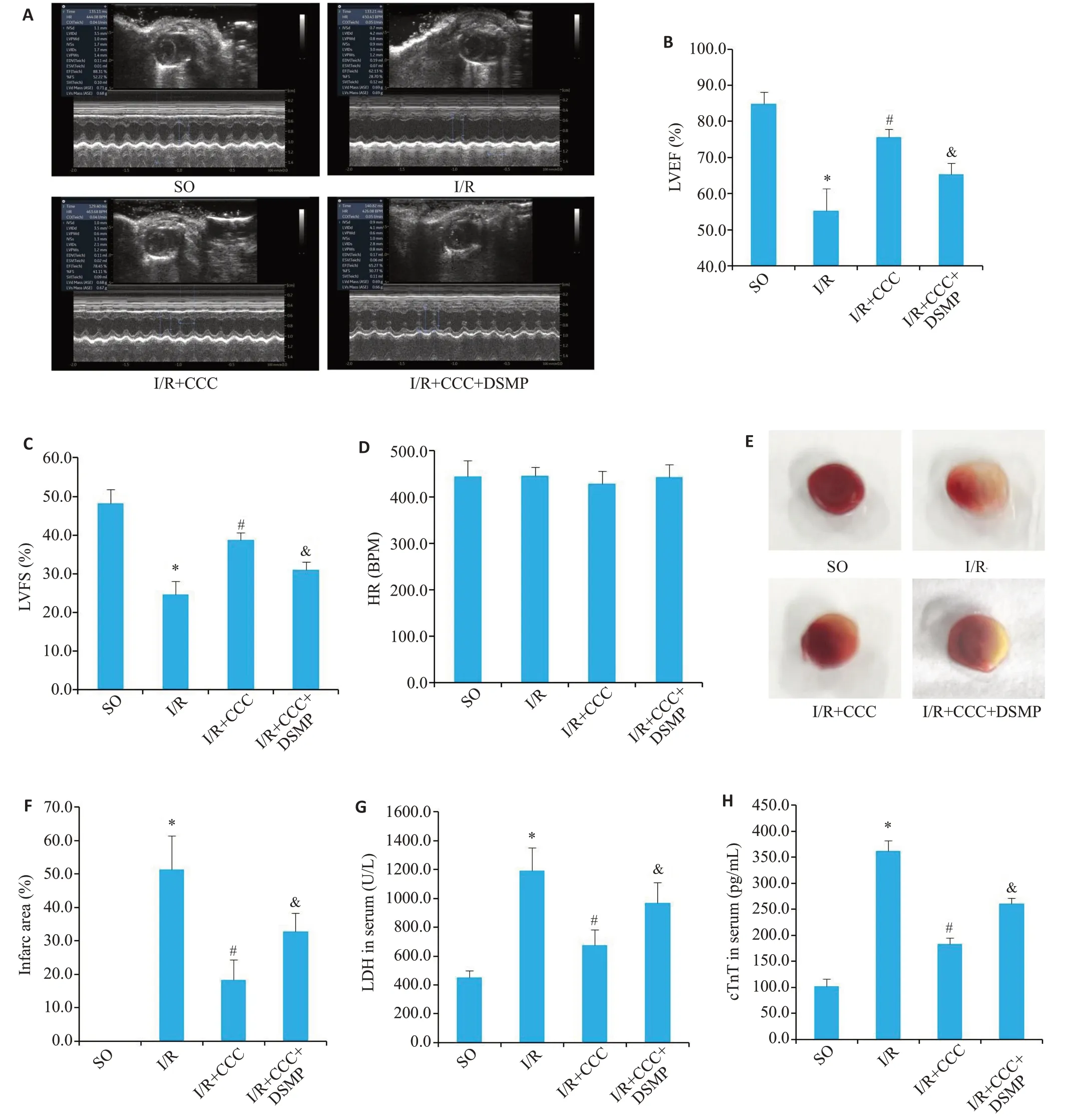
图7 秋水仙碱通过激活AMPK逆转I/R手术导致的小鼠心功能下降和心脏损伤Fig.7 Colchicine reverses reduced cardiac function and cardiac damage in mice induced by I/R by activating AMPK.A:Representative M-mode ultrasound images of the mice in each group.B-D:Quantitative analysis of the LVEF,LVFS and HR(n=4).E:Representative TTC staining images of the mice in each group.F-H:Quantitative analysis of the infarct area and serum cTnT and LDH levels(n=4).*P<0.05 vs SO group;#P<0.05 vs I/R group;&P<0.05 vs I/R+colchicine group.
3 讨论
AMI的高发病率和高死亡率已经为全球卫生事业带来巨大挑战,作为其最有要的治疗手段——再灌注治疗,在治疗AMI时,也会对心肌造成严重的,乃至不可逆的损伤[27]。本研究探讨了秋水仙碱对心肌缺血再灌注损伤的保护作用,并首次发现秋水仙碱可以通过激活AMPK来抑制缺血再灌注损伤导致的氧化应激和凋亡,并改善小鼠心脏功能。
秋水仙碱是治疗急性痛风发作的经典药物,具有强大的抗炎作用[28]。近期有研究证实秋水仙碱可以通过激活AMPK抑制胆固醇晶体引起的内皮细胞炎症[29],但在心肌细胞或者缺血再灌注研究中并未见相关报道。我们首先在H9C2细胞上,使用缺氧复氧的方式模拟缺血再灌注损伤。本研究表明秋水仙碱有助于减少H/R处理引起AMPK磷酸化水平降低,保护了H9C2细胞中AMPK的活性。AMPK是细胞内最重要的能量受体和调节因子之一,在病理情况中,AMPK磷酸化水平可能下降,其活性受到抑制,而激活AMPK有助于改善许多心血管疾病的结局[30,31]。许多研究也证实了激活AMPK可以降低心肌缺血再灌注损伤[32,33]。因此本研究结果预示着秋水仙碱可以通过激活AMPK来对抗心肌缺血再灌注损伤。
为更进一步验证本研究的观点,我们对小鼠行I/R手术以更为真实地模拟AMI后的再灌注治疗造成的损伤。首先发现秋水仙碱治疗的确可以抑制小鼠心肌再灌注区域AMPK磷酸化的降低,与细胞实验取得的结果相似。AMPK具有调节线粒体功能的作用,许多研究也证实激活AMPK可以减少I/R损伤[32,34]。推测秋水仙碱在改善再灌注导致的小鼠心肌的损伤中具有AMPK依赖性。为明确秋水仙碱是否能够在动物整体研究中同样能够发挥抗氧化应激、抗凋亡的作用,以及秋水仙碱发挥保护作用是否是通过AMPK来完成,在后续实验中使用DSMP来抑制AMPK的活性。
线粒体功能障碍是缺血再灌注损伤中的最重要的原因[35]。线粒体作为细胞的能量工厂,因再灌注损伤导致其功能损伤可以引起能量物质ATP的产生减少,并增加活性氧的产生和介导线粒体途径的细胞凋亡,导致细胞功能下降[36,37]。我们检测了心肌组织中ATP含量的变化,结果显示I/R引起心肌组织中ATP含量的下降,此时线粒体内中出现功能障碍,正常的电子传递受阻,ATP合成障碍,导致大量活性氧生成,引起氧化应激反应,造成心肌功能损伤。随后检测了氧化应激反应相关蛋白分子,并对切片进行了8-OHdG染色,证实了I/R引起了强烈的的氧化应激反应。秋水仙碱治疗可以通过AMPK依赖的方式降低与I/R有关的氧化应激反应。
正常情况下BAX驻留在细胞质中,当接收到死亡信号后,转至线粒体并促进Cyt C释放入胞质,启动线粒体途径的凋亡[38]。本研究检测到线粒体BAX表达增高,而胞浆中Cyto C表达上升,表明线粒体途径的凋亡启动。同时,也发现心肌组织整体的凋亡水平增加。而秋水仙碱可以通过激活AMPK降低心肌的线粒体凋亡和整体凋亡水平。
I/R引起的心肌氧化应激反应和凋亡水平增加,最终体现在了心脏功能下降,导致心力衰竭甚至心源性休克,威胁个体生命。我们运用超声、染色和血清学检测,分别评估了受损心脏的功能、梗死面积和损伤程度,结果提示秋水仙碱可以减少I/R导致的LVEF和LVFS降低和梗死面积、LDH、cTnT的升高,减少了心肌损伤,保护了心脏功能。而抑制AMPK则可以抵消秋水仙碱的保护作用,这意味着AMPK是秋水仙碱发挥保护作用的重要媒介。
总之,本研究首次证实秋水仙碱这一经典的抗炎药物可以通过激活AMPK来减少心肌缺血再灌注损伤,逆转心功能下降。本研究为该经典药物被创新性地应用在预防心肌再灌注损伤中提供了理论依据。
