Rho激酶抑制剂Y27632促进人诱导多能干细胞来源原始神经上皮细胞向多巴胺能神经前体细胞的转化
2024-03-18李洋洋徐佳佳姜诚诚陈子龙应梦娇马彩云王春景刘长青
李洋洋,徐佳佳,姜诚诚,陈子龙,陈 颖,应梦娇,王 澳,马彩云,王春景,郭 俣,刘长青
蚌埠医科大学1安徽省神经再生技术与医用新材料工程研究中心,2生命科学学院,安徽 蚌埠233000
帕金森病(PD)是一种进行性神经退行性疾病,是60岁以上人群中第2常见的神经退行性疾病,其主要原因是黑质致密部(SNc)多巴胺能(DA)神经元的死亡和含α-突触核蛋白的路易体的形成[1]。目前,帕金森病的主要治疗方法是药物治疗,常用药物包括DA激动剂、单胺氧化酶B抑制剂和左旋多巴等[2-4]。然而,药物治疗只能改善患者的症状,不能从根本上治愈帕金森疾病[5,6]。使用细胞移植替代损失的DA神经元以恢复神经传递,逐渐成为治疗PD 的重要手段[7-9]。
近年来,人诱导多能干细胞(hiPSC)诱导的DA神经元移植入啮齿动物和灵长类动物PD模型中,能够安全有效地改善PD模型动物的运动功能[10-13]。日本科学家将同种异体人iPSCs衍生的DA能神经元前体移植到PD患者壳核中开创临床试验[14]。将帕金森病患者来源的iPSCs诱导为中脑多巴胺能祖细胞,植入帕金森病患者的壳核,术后18~24个月帕金森病症状稳定并得到改善[15]。然而,人iPSC-NECs向iPSC-DA神经前体细胞转化过程中细胞的存活率不高,严重限制了iPSC-DA神经前体的临床应用。
IPS细胞体外培养脱离过程中容易发生凋亡现象,尤其人iPSC-NECs胶原酶消化重新接种向DA神经元诱导过程中[16-18],其原因可能是Rho/ROCK信号通路介导细胞骨架蛋白磷酸化,打破了肌动蛋白-肌球蛋白收缩力和E-钙粘蛋白依赖性细胞-细胞粘附之间的平衡,促进肌动蛋白-肌球蛋白收缩而导致细胞死亡。ROCK途径的活化[17]。而抑制ROCK 信号通路的小分子Y-27632可增加人胚胎干细胞的存活和生长,被广泛用于干细胞研究[19-21]。
此外,ROCK抑制剂Y27632可促进神经元分化和神经突生长,并减少多种干细胞类型中的神经突收缩[22-24]。ROCK抑制剂通过细胞外信号调节激酶途径强烈促进胚胎干细胞分化为神经元,并且在动物模型中抑制移植后细胞的急性凋亡[22,25]。
目前将人iPSCs进行神经分化的主要方案是“双SMAD”抑制方案,该诱导的过程中细胞死亡较多,尤其是在诱导第一阶段结束,细胞解离重新接种时细胞存活率低。因此本研究对人iPS细胞诱导DA神经前体细胞方法进行优化[26],在第一阶段将人iPSCs诱导至原始神经上皮细胞,细胞消化重新接种时尝试加入Y27632,显著提高了细胞的存活率,24 h及时去除Y27632后,未影响后续向DA神经元前体分化,提高了人iPSCs-DAPs定向分化的效率。
1 材料和方法
1.1 细胞系
人新生儿包皮细胞来源的人诱导型多能干细胞(hiPS细胞)购于中国科学院典型培养物保藏委员会干细胞库(目录号SCSP-1301)。
1.2 主要试剂
HiPSCs 培养基 mTeSRTMBasal Medium(STEMCELL)、DMH1(Tocris Bioscience),Poly-lornithine hydrobromide、Laminin、6-羟基多巴胺、阿扑吗啡(Sigma),SB431542(StemGent),Purmorphamine(Millipore),SHH(Sino Biological)、FGF8(R&D systems)、CHIR99021(Selleckchem),Y-27632、cAMP、BDNF、GDNF(PeproTech)、维生素C(BioShap)、DAPI染料、中性红染液、BCIP/NBT碱性磷酸酶(AP)显色试剂盒、CCK8 细胞增殖检测试剂盒、BeyoClick™EdU-647细胞增殖检测试剂盒(上海碧云天生物科技有限公司),Neurobasal 培养基、DMEM/F12培养基、B27(Without VitaminA)、N2、NEAA、GlutaMax、Tryple Express Enzyme、Laminin、胶原酶IV(Gibco),鼠抗Sox2、鼠抗Oct4(Santa Cruz),鼠抗Nestin、鼠抗Tuj1、兔抗Pax6、兔抗TH、兔抗FOXA2、兔抗LMX1A(Abcam),兔抗NURR1、兔抗SSEA-1(Bioss),兔抗Nanog(CST),驴抗兔Cy3、驴抗鼠Cy3(Jackson Lab),驴抗兔Alexa Fluor 488,驴抗鼠Alexa Fluor 488、抗荧光淬灭封片剂、CellTracker ™CM-DiI Dye(Invitrogen)。
1.3 人iPSCs的体外培养
将人诱导多能干细胞系(hiPSCs)接种于基质胶(Matrigel)包被1 h 的T25 培养瓶里,使用mTeSRTMBasal Medium 培养基,并加入终浓度为10 μmol/L 的Y27632。次日弃除培养基,更换mTeSRTMBasal Medium培养基培养(不加Y27632),2~3 d更换培养液,每4 d传代1次维持其未分化状态。
1.4 人iPSCs的表型鉴定
将状态良好的人iPSCs接种到基质胶包被的无菌细胞爬片(Coverslips)上,采用免疫荧光技术、RT-PCR和Western blotting对人iPSCs的多能性标记分子OCT4、SOX2、Nanog和SSEA1的表达进行特异性检测。
1.5 Y27632对人iPSCs向DAPs诱导分化的影响
1.5.1 人iPSCs诱导为原始神经上皮细胞(NECs)在人iPSCs克隆的生长过程中,当生长到约30%左右时,在基础培养基mTeSRTM中添加DMH1(10 μmol/L)、SB431542(10 μmol/L)、SHH(200 ng/mL)、FGF8(100 ng/mL)和Purmorphamine(2 μmol/L),继续培养至第3天。然后添加CHIR99021(3 μmol/L)继续培养至第5天,更换为神经诱导培养基NIM(DMEM/F12添加N2、DMH1、SHH、CHIR99021),继续培养至第7天。在第11 天时去除SHH 和Purmorphamine,继续培养。随后将细胞转移到神经分化培养基(NEM)中,其中Neurobasal培养基中添加1%N2、2%B27-A、BDNF(10 ng/mL)、GDNF(10 ng/mL)、AA、TGF-β、cAMP、1%GlutaMax和CHIR99021。继续培养至第13天。通过免疫荧光技术进行评估诱导细胞的表面特异性抗原PAX6、Nestin和SOX2的表达。
1.5.2 Y27632对人iPSCs-NECs向DAPs诱导的影响及检测 吸去hiPSCs-NECs旧培养基,PBS洗3次后,加入预热的IV型胶原酶进行消化,将细胞收集于15 mL离心管中,轻微吹散细胞后接种于PLO和Laminin包被的培养板上贴壁培养。培养基更换为Neurobasal medium,添加N2、2%B27-A、BDNF(10 ng/mL)、GDNF(10 ng/mL)、AA、TGF-β、cAMP、1%GlutaMax,并在培养基中加入不同浓度的Y27632(0、3、5、8、10 μmol/L)。24 h后更换不含Y27632的培养基,培养至第28天,每2 d半量换液,可获得DAPs,使用免疫荧光技术检测表面特异性抗原TH、Tuj1、FOXA2 与NURR1的表达。
1.6 CCK-法8检测不同浓度Y27632对解离后人iPSCs-NECs的活性影响
将诱导至13 d的人iPSCs-NECs以35×104~5×104细胞/孔的密度接种在已用PLO和Laminin包被过的96孔板上,使用不同浓度的Y27632(0、3、5、8、10 μmol/L)处理并于次日更换培养基(不含Y27632)。2 d后,吸掉旧培养基,PBS清洗3次,每孔加入100 μL细胞培养基,再将10 μLCCK-8溶液加入每个孔中孵育2 h。使用酶标仪(Multiskan Sky,Thermo Fisher Scientific)在450 nm波长下测量每孔的A值,统计数据计算细胞活力,以空白组为调零孔,各组细胞活力(%)=[加药组A450-调零组A450]/[空白对照组A450-调零组A450]×100%。
1.7 检测Y27632对人iPSCs-NECs的细胞增殖和细胞凋亡影响
1.7.1 EdU染色检测Y27632对人iPSCs-NECs的细胞增殖影响 将人iPSCs-NECs接种到24孔板中,使用不同浓度的Y27632(0、3、5、8、10 μmol/L)处理并于次日更换培养基(不含Y27632)。加入37 ℃预热终浓度为10 μmol/L的EdU,继续孵育2 h,使用4%的多聚甲醛进行固定,用洗涤液洗涤细胞3次,0.3%Triton X-100的PBS室温孵育10~15 min。使用Hoechst 33342进行细胞核染色,室温避光孵育10 min后在双光子激光共聚焦显微镜Olympus(FV-1200MPE SHARE)下观察细胞标记结果。
1.7.2 DAPI(4',6-二脒基-2-苯基吲哚)直接染色法检测Y27632 对人iPSCs-NECs 的细胞凋亡影响 将人iPSCs-NECs 接种到24 孔板中,使用不同浓度的Y27632(0、3、5、8、10 μmol/L)处理并于次日更换培养基去除Y27632。细胞生长2 d后,去除培养基,用PBS洗涤细胞3 次,0.3%Triton X-100 的PBS 室温孵育10~15 min。使用DAPI 进行细胞核染色,室温避光孵育15 min后在双光子激光共聚焦显微镜下观察凋亡小体的数量。
1.8 免疫荧光技术检测人iPSCs、NECs和DAPs细胞表面特异性抗原
将接种在coverslips 上的细胞先用4%多聚甲醛室温固定细胞18 min,然后用0.2%Triton X-100通透8 min。接下来,在2%牛血清白蛋白(BSA)和10%驴血清中继续封闭细胞1 h。之后,将含有特定抗体的溶液与样本一起置于4 ℃孵育过夜。使用的抗体包括:鼠抗OCT4,鼠抗SOX2,兔抗Nanog,兔抗SSEA1,鼠抗SOX2,兔抗PAX6,兔抗Nestin,兔抗TH,鼠抗NURR1,兔抗FOXA2和鼠抗Tuj1。次日,去除一抗后,用PBS洗涤细胞3次,然后在室温下与二抗Alexa Fluor 488或Cy3避光孵育1 h。最后,用DAPI染色细胞核,添加抗荧光淬灭剂,并使用双光子激光共聚焦显微镜观察荧光结果。
1.9 统计学分析
采用Graphpad 8.01软件进行统计学分析并生成图表,所得实验数据用均数±标准差表示,组间比较采用单因素方差分析,以Ρ<0.05认为差异具有统计学意义。
2 结果
2.1 人iPSCs形态特征及多能性的鉴定
人iPSCs呈明显的细胞团生长,克隆为扁平的岛状,边缘清晰且中央细胞变得更加紧密和密集,细胞核大浆小,高表达多能性标记物OCT4、SOX2、Nanog和SSEA1(图1A、B),内源性碱性磷酸酶活性染色呈阳性(图1C)。RT-PCR 和蛋白质印迹也证实hiPSCs 可表达多种未分化的ES 细胞的特异性标记基因OCT4、SOX2、Nanog与Klf4(图1D)。
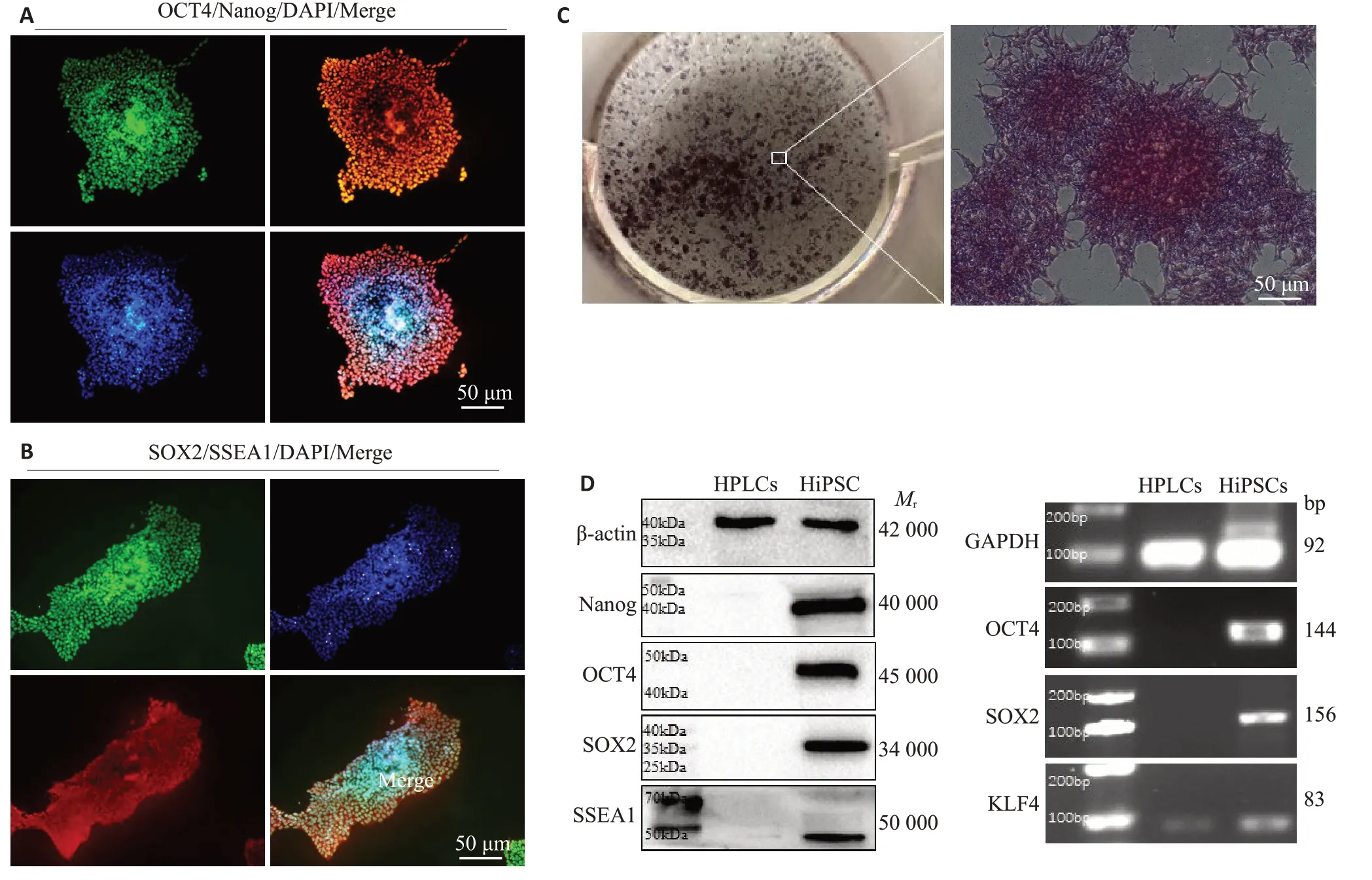
图1 人iPSCs的生物学特征鉴定Fig.1 Biological characterization of hiPSC.A,B:hiPSCs express pluripotency markers OCT4(green),Nanog(Red),SOX2(green)and SSEA1 (Red) (Original magnification: ×200). C: AP-positive dense cell colonies of hiPSCs (×200). D: Expression of pluripotency markers detected by RT-PCR and Western blotting.
2.2 人iPSCs-NECs诱导及特征鉴定
人iPSCs 诱导成DAPs 主要经历两个阶段(图2A)。第1阶段,将hiPSCs诱导分化为NECs。诱导过程中,人iPSCs的集落体积逐渐增大,且边缘细胞出现明显分化现象,诱导至第13天时,显微镜下观察细胞集落分化为典型玫瑰花结式的神经管样结构,即为人iPSCs-NECs(图2B)。经免疫荧光染色结果显示,细胞诱导成为Pax6+[(96.1±1.0)%]、Nestin+[(92.5±0.8)%]与SOX2+[(97.5±1.0)%]的原始神经上皮细胞(图2C、D)。
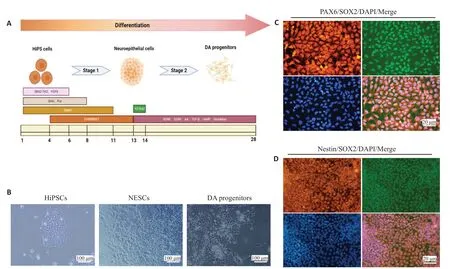
图2 人iPSCs诱导DA神经元前体细胞的时间轴以及人iPSCs-NECs标记物检测Fig.2 Induced differentiation of hiPSCs into hiPSCs-DA progenitors.A:Timeline of induced differentiation procedure,including NECs induction and DAPs induction stages.B:Morphological changes of DAPs derived from hiPSCs at the two stages during differentiation(×100). C,D:NECs derived from hiPSCs express neuroepithelial markers SOX2(green),Nestin(red)and Pax6(Red)(×200).
2.3 Y27632 促进人iPSCs-NECs 向DAPs 定向分化的研究
相比于未加Y27632的对照组,添加Y27632后可明显提高hiPSCs-NECs贴壁与存活,当Y27632浓度为5 μmol/L 时,细胞存活率显著提高(Ρ<0.01,图3A)。CCK8 检测结果表明,Y27632 的浓度为3 μmol/L 时,细胞活力较对照组的提高3.4倍,当Y27632的浓度为5 μmol/L时,细胞活力较对照组提高6.2倍(Ρ<0.01,图3B),当Y27632的浓度为8 μmol/L、10 μmol/L与5 μmol/L时无明显差异。根据这些结果,选择浓度为5µmol/L的Y-27632用于后续的体外细胞诱导分化实验。
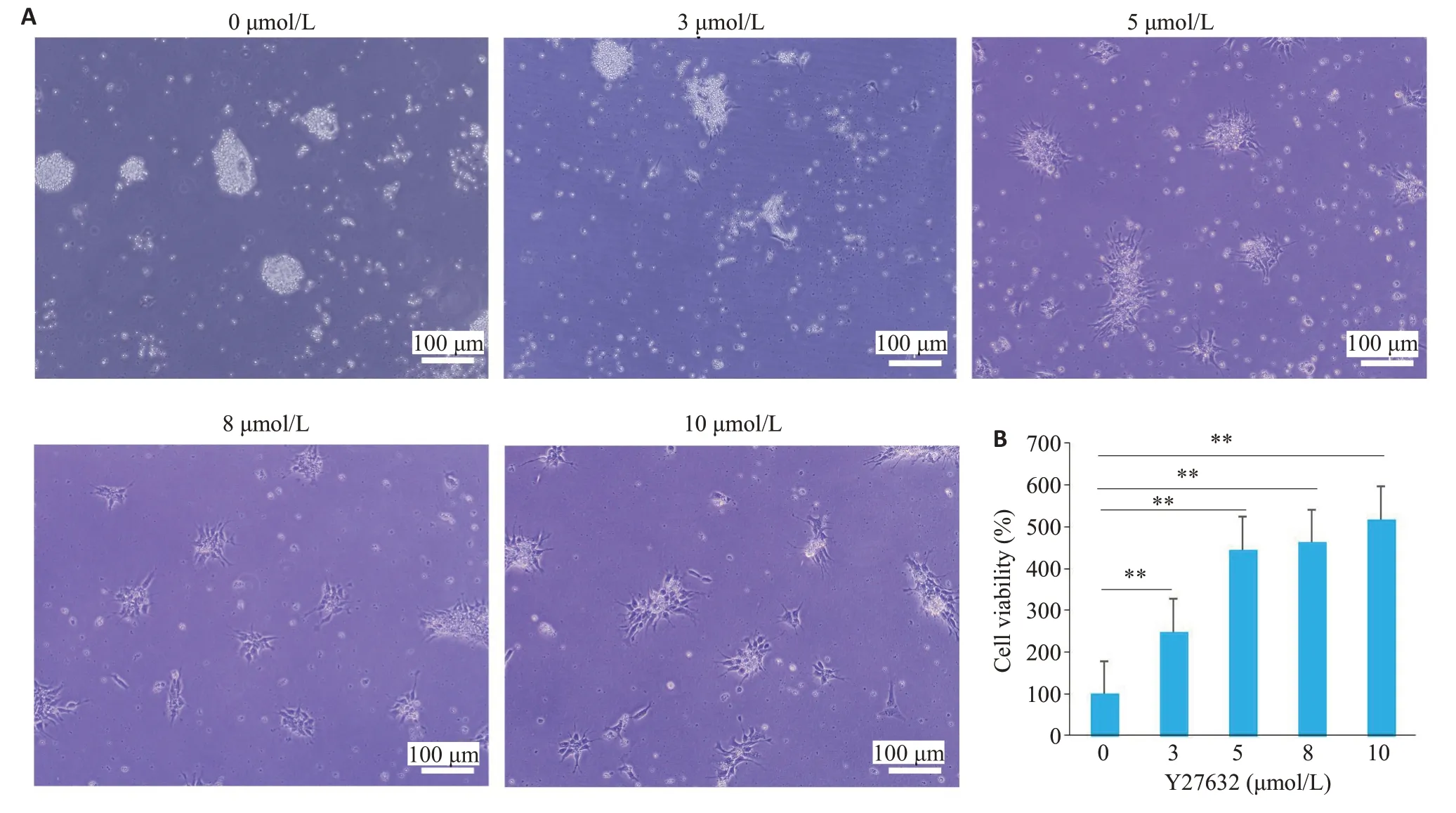
图3 Y27632对人iPSC-NECs消化后重新接种存活的影响Fig.3 Survival of hiPSCs-NECs treated with different concentrations of Y27632.A:Survival of hiPSCs-NECs treated with 0,3,5,8,and 10 μmol/LY27632 for 24 h(×100).B:Viability of the treated hiPSCs-NECs assessed using CCK8 kit.**P<0.01.
2.4 检测Y27632对人iPSCs-NECs增殖能力和细胞凋亡的影响
将hiPSCs-NECs 胶原酶IV 消化后,重新接种到PLO和Laminin包被24孔培养板中,神经分化培养基中加入不同浓度的Y27632(0、3、5、8、10 μmol/L),24 h后,EdU染色结果显示,Y27632可明显提高处于S期的细胞数量,当培养基中Y27632的浓度为5、8、10 μmol/L时,相比较0 和3 μmol/L 组,增殖细胞比例显著增加(Ρ<0.01,图4A、C)。DAPI染色结果显示,Y27632可降低hiPSCs-NECs消化重新接种后细胞凋亡率,而且当Y27632的浓度高宇5 μmol/L时,相比较低浓度组,凋亡细胞比例显著降低(Ρ<0.05,图4B、D)。
2.5 人iPSCs-DAPs的诱导及特征鉴定
将hiPSCs-NECs在神经分化培养基继续培养,诱导至第24~28天时,细胞逐渐形成菊花样结构,可见明显的轴突和树突(图5A)。免疫荧光检测结果显示,诱导细胞高表达DAPs标记物TH(97.3±1.2)%、FOXA2(97.8±1.5)%、NURR1(94.2±1.0)%和Tuj1(84.1±1.5)%(图5B、C)。
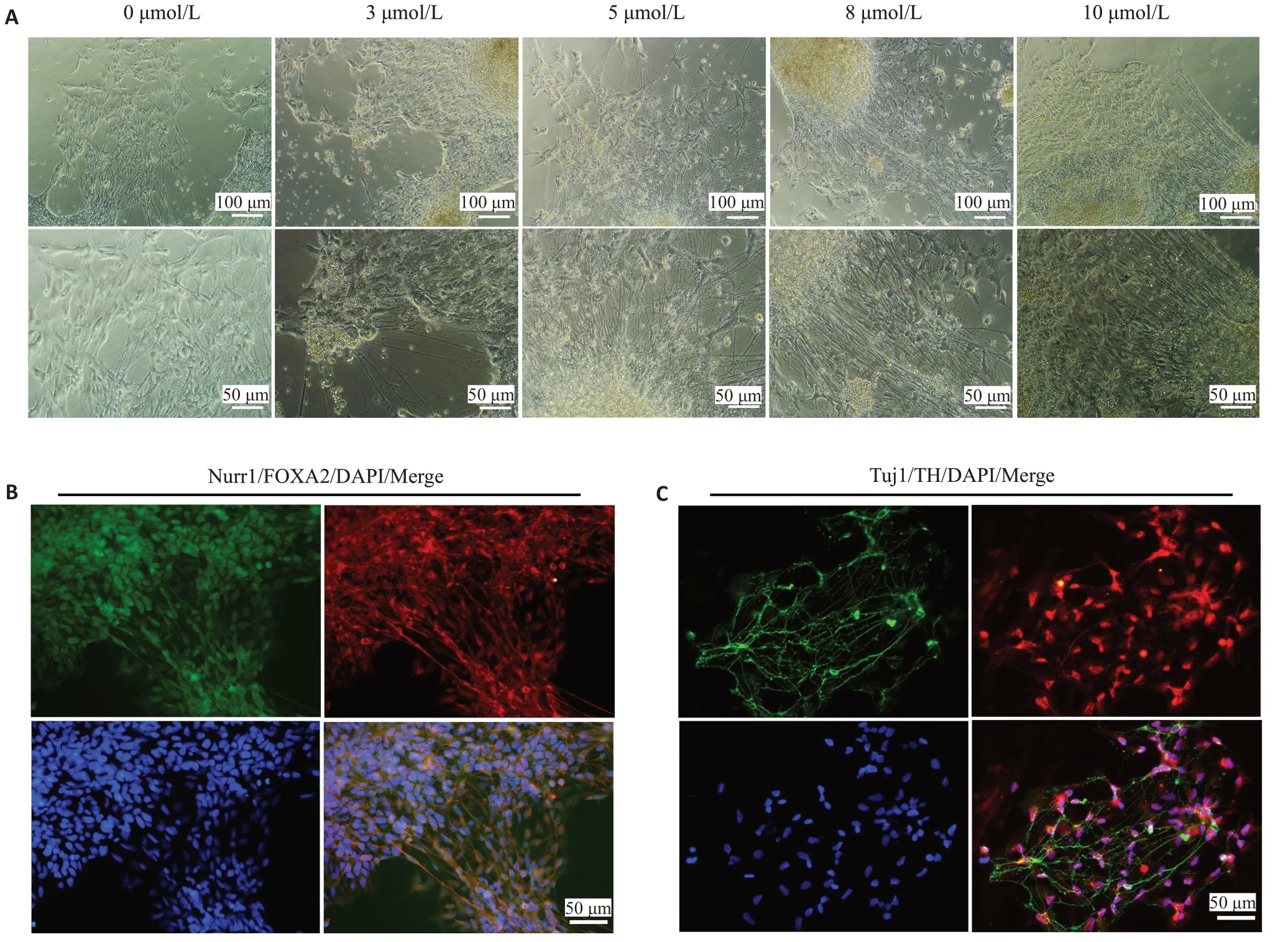
图5 人iPSCs-DAPs的表面特征标记物的表达Fig.5 Characteristics of hiPSCs-DAPs at stage 2.A:After treatment with different concentrations of Y27632(0,3,5,8 and 10 μmol/L),the morphological changes of hiPSCs-NECs were observed after further induction for 28 days. B, C: Immunofluorescence results show that hiPSCs-DAPs express the specific markers of midbrain dopamine neurons Nurr1(green),TH(Red),Tuj1(green)and FOXA2(Red)(×200).
3 讨论
多巴胺能神经元体外诱导多采用胚胎干细胞或胚状体神经球,但是胚胎干细胞的治疗面临着长期临床应用的免疫学和伦理学挑战,神经球因细胞位置不同,不能保障诱导细胞的同质性[27]。人iPS细胞为体外高效DA神经元奠定了基础,解决了免疫排斥的风险和临床应用的伦理问题[28]。本项目组前期建立一种了基于2D培养系统的高效诱导DAPs的单层细胞培养体系,通过Purmorphamine 激活Sonic Hedgehog(SHH)信号通路和CHIR99021(GSK3 抑制剂)激活WNT通路促进中脑细胞分化,并通过双重SMAD抑制(暴露于DMH1和SB431542)增强iPSCs向中脑DAPs的分化,确保产生FOXA2/LMX1A1表达的DAPs细胞[26]。然而,基于2D的单层体系亦存在hiPSCs-NECs解离过程中容易发生细胞凋亡,造成大量的细胞损失现象[29]。
Rho激酶(ROCK)小分子抑制剂Y-27632可以增加细胞之间的相互作用,并影响细胞与细胞外基质(ECM)微环境的调节,从而通过与微环境的相互通信,主动或被动地影响细胞的命运,如增殖、迁移、分化和凋亡等[30-33]。Y-27632是阻断ROCK通路Rho(GTP酶的主要下游效应物)活性的生物活性分子,调节多种细胞功能,如促进人胚胎干细胞的存活和生长,被广泛用于干细胞研究[19]。而且Y27632可提高干细胞分化与诱导效率,显著增加细胞存活和集落形成,并抑制解离后诱导细胞的死亡,并且不影响人iPSCs的多能性及其体外分化[33]。
本研究中人iPSCs衍生的DAPs的分化过程遵循两个主要阶段。首先,人iPSCs被诱导至第1阶段结束时,其特征类似于原始神经上皮(NECs),可表达SOX2、NECtin和Pax6 特异性标志物。第1阶段结束后,第2阶段是神经分化培养基中的神经谱系特异性诱导,为提高hiPSCs-NECs解离过程中存活,抑制细胞凋亡,在此阶段的前1 d加入不同浓度的Y27632,结果表明原始神经上皮细胞消化后,ROCK抑制剂Y27632可显著增加细胞粘附和增殖,提升hiPSCs-NECs 细胞存活率,抑制细胞凋亡过程[34]。而且,CCK8细胞活力检测表明当Y27632的浓度达到5 μmol/L时,与浓度为8 μmol/L、10 μmol/L无明显差异。同时,EdU染色的结果也证明,当Y27632的浓度达到5 μmol/L时,细胞的增殖能力明显提高。
然而,iPSCs体外分化过程中,Rho激酶抑制剂浓度超过10 μmol/L,可能导致其分化为所有3个胚层(即外胚层、中胚层和内胚层),极大地损害了人iPSCs定向诱导分化的能力[35]。因此,在促进细胞贴壁存活后应及时去除Y27632,以免对后续的分化产生未知的影响。本研究使用5 μmol/L浓度的Y27632促进hiPSCs-NECs解离重新接种24 h 后,更换新培养基,及时去除Y27632,持续诱导细胞至28 d后,可获得多巴胺能神经元前体细胞(DAPs),高表达DAPs标记物TH、FOXA2、NURR1和Tuj1。因此加入浓度为5 μmol/L的Y27632,未对后续iPSCs-DAPs诱导产生明显的影响。
综上所述,本研究在人iPSCs定向诱导DAPs细胞过程中,在第1阶段人iPSC-NECs解离重新接种时加入5 μmol/L的Y27632,可显著提高iPSCs-NECs解离后的贴壁、存活和增殖,并且可减少凋亡细胞的比例,从而增加了后续分化过程中的细胞数量,间接的提高了分化效率。24 h 后去除Y27632,未对后续体外定向诱导iPSCs-DAPs的分化潜能产生影响。因此,在培养系统中补充ROCK 抑制剂Y27632提供了一种简单、高效的方法,可用于获得大量高纯度人iPSCs衍生的多巴胺能神经前体细胞,这将为帕金森病的细胞移植治疗提供重要的细胞来源。
