FAK抑制剂PF-562271减轻老化血小板诱导的人脐静脉内皮细胞损伤
2024-03-18白钰婷刚保才张梦洁万子雨刘国权
白钰婷,刚保才,张梦洁,万子雨,刘国权,2,顾 玮,2
蚌埠医科大学1癌症转化医学安徽省重点实验室,2检验医学院生物化学与分子生物学教研室,安徽 蚌埠233000
输血相关急性肺损伤(TRALI)是由输血引起的呼吸窘迫和急性肺损伤(ALI),是目前输血相关死亡的主要原因[1]。TRALI的临床表现是出现呼吸困难和双侧肺水肿,病人也会出现缺氧、发热、低血压、心动过速和紫绀等并发症[2,3]。TRALI的发生率为1∶5000~1∶190 000,在输血患者中发病率约为15%[4]。TRALI可激活内皮细胞,招募和激活中性粒细胞,这些中性粒细胞会释放活性氧,导致周围肺组织的损伤、肺渗漏和TRALI的发展[5]。因此,探究TRALI在内皮细胞中的发生发展,可为临床TRALI的治疗提供新的理论依据。本研究在体外模拟TRALI 的发生发展,为进一步探究如何缓解TRALI造成的内皮细胞损伤具有潜在的应用价值。
黏着斑激酶(FAK)是一种蛋白酪氨酸激酶,已被发现可调节各种类型细胞的细胞粘附、运动、增殖和存活[6]。研究表明,在内毒素脂多糖(LPS)诱导的结肠上皮细胞模型中FAK被激活,表明FAK参与LPS诱导的炎症反应[7]。FAK还增加了内皮细胞中NFκB的表达[8]。LPS可以利用FAK诱导NFκB产生炎症反应。炎症反应发生时,FAK对内皮细胞屏障功能的调节,发挥重要作用[9]。FAK可引起NADPH激活诱导的活性氧(ROS)表达增加[10]。内皮细胞经过氧化氢(H2O2)刺激后,细胞通透性增加,促进FAK和pFAK的表达[11]。FAK抑制剂PF-562271,可降低FAK磷酸化和体内肿瘤的生长[12],目前正在进行I期临床试验。在LPS诱导的小鼠急性肺损伤(ALI)模型中,FAK抑制剂PF-573228可减轻小鼠的ALI[13]。内皮细胞屏障功能障碍导致的肺血管通透性增加是ALI的主要病理特征[14]。目前未见PF-562271在老化血小板诱导的内皮细胞损伤中的作用研究。因此,迫切需要开展进一步工作探究PF-562271对内皮细胞损伤的保护作用。
我们前期研究发现,在LPS和老化血小板诱导的TRALI小鼠模型中,FAK蛋白表达水平增高[15]。然而,抑制FAK的表达是否可以调控PECAM-1的表达,及其对内皮细胞功能的作用,目前尚无相关文献报道。本研究旨在探讨脂多糖和老化血小板对内皮细胞功能的影响,探究FAK抑制剂PF-562271在内皮损伤中的作用,为PF-562271对TRALI的治疗作用提供研究基础。
1 材料和方法
1.1 细胞及试剂
人脐静脉内皮细胞(HUVEC)实验室现有细胞库获取。DMEM(Gibco);胎牛血清(Cegrogen);7.5%SDS-PAGE 凝胶(雅酶);PCR 试剂盒(Beyotime 和Vazyme);ELISA 试剂盒(睿信生物);FAK、β-actin 抗体(Proteintech)、PECAM-1(Affinity)、二抗抗体(Beyotime)。
1.2 方法
1.2.1 细胞培养 HUVEC细胞在100 mm细胞培养皿中用加入10%的胎牛血清的DMEM培养。培养箱设置为37 ℃、5%CO2。待细胞融合度达80%左右进行传代。
1.2.2 构建人脐静脉内皮细胞(HUVEC)损伤模型 先培养HUVEC贴壁生长至70%,加入LPS预先刺激2 h后,再加入静置5 d,浓度为1×109/mL老化的血小板共孵育6 h,最后加入PF-562271(10 μg/mL)处理24 h。
1.2.3 细胞通透性实验 将培养至对数期的细胞用胰酶消化后,接种至Transwell-24小室内培养,并且根据实验需要进行分组。细胞铺满后,将小室中的液体吸出,用PBS清洗3次,将小室内加入含有FITC标记的葡聚糖(FITC-Dextran),放置细胞培养箱孵育1 h。小室底部取出100 μL液体,用荧光酶标仪检测吸光度。
1.2.4 跨内皮细胞电阻实验 将HUVEC细胞用胰酶消化后制备成细胞悬液,计数并调整细胞浓度至1×105/mL,然后将200 μL的细胞悬液接种于Transwell上室中,下室加入800 μL的细胞悬液,用Millicell ERS-2 测量每个小室的基础电阻,TEER数值按以下公式计算:TEER值(单位:Ω×cm2)=(内皮细胞电阻值-基础电阻)×Transwell上室滤膜的底面积(0.33 cm2)。
1.2.5 RT-qPCR 实验 Trizol 裂解细胞并提取细胞总RNA,逆转录后为cDNA,在PCR仪上进行实时荧光定量PCR扩增。所有引物均由生工(上海)公司合成提供(表1)。
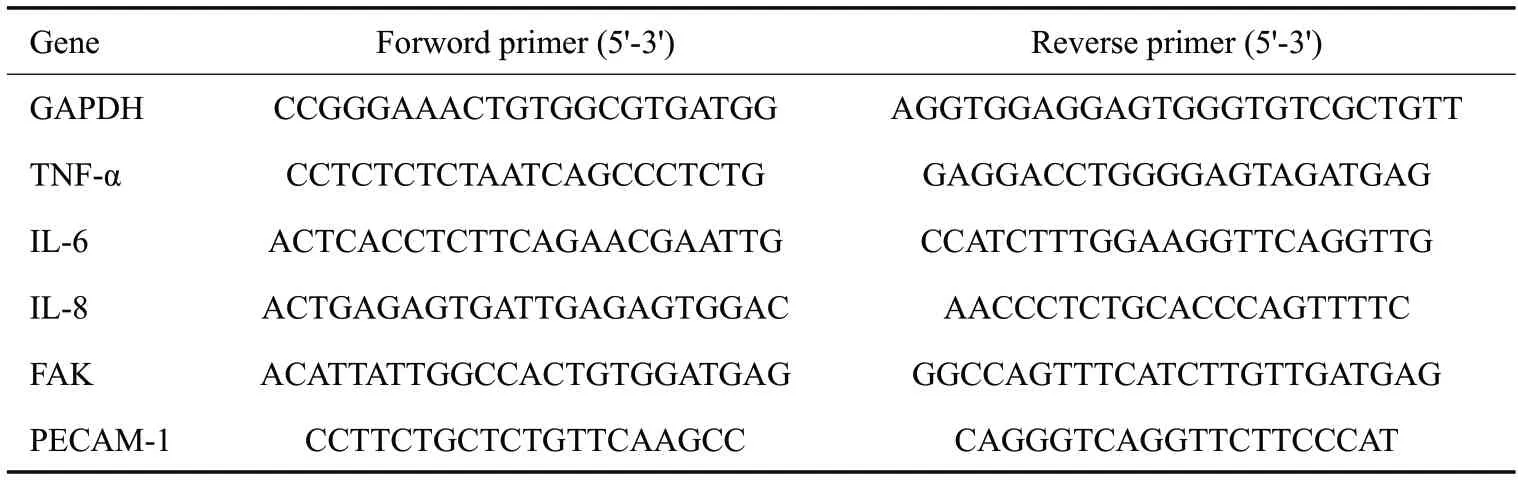
表1 本研究使用的RT-qPCR 引物序列Tab.3 RT-qPCR primer sequences used in this study
1.2.6 Western blotting实验 细胞处理后根据细胞量加入蛋白裂解液,在冰上进行充分裂解。细胞变性后进行蛋白电泳,300 mA转膜1.5 h,室温封闭2 h,一抗4 ℃孵育过夜,二抗室温孵育1.5 h,加入曝光液后显影。各抗体稀释比例:FAK(1∶1000)、pFAK(1∶1000)、PECAM-1(1∶1000)、β-actin(1∶1000)、二抗(1∶4000)。
1.2.7 免疫荧光实验 将处理好的细胞爬片,用PBS洗3遍每次3 min,再用4%多聚甲醛固定15 min,再用PBS清洗3遍后用山羊血清室温封闭30 min。一抗4 ℃孵育过夜(FAK、PECAM-1,1∶300)。次日,PBS清洗3次,与FITC二抗在室温下避光孵育2 h,PBS清洗3遍后用含DAPI的封片剂封片,荧光显微镜采集图片。
1.2.8 活性氧检测 将处理好的细胞用胰酶消化,根据活性氧检测试剂盒(Beyotime)说明书操作:1000 r/min离心3 min收集细胞,弃去上清。在每管中加入1 mL带荧光探针的培养基(DCFH-DA:不完全培养基=1∶1000)重悬细胞,置于37 ℃培养箱孵育20 min。每5 min颠倒混匀1次。再次离心弃去上清,用不完全培养基清洗3次,加PBS重悬细胞,进行流式细胞仪的观察和检测。
1.2.9 酶联免疫吸附实验(ELISA)根据试剂盒说明书收集细胞培养上清,检测TNF-α、IL-6和IL-8的分泌水平。酶标仪检测各孔的吸光度A450nm,绘制标准曲线,计算各组的含量。
1.3 统计学分析
采用Graph Pad prism9.3进行统计学分析。定量资料均显示均数±标准差,两组间比较采用了两独立样本t检验,多组间的比较采用单因素方差分析,Ρ<0.05时认为差异具有统计学意义。所有实验均独立重复3次。
2 结果
2.1 HUVEC损伤模型中,PF-562271抑制FAK、pFAK表达
免疫印记结果显示,与LPS组相比,造模组FAK、pFAK蛋白表达增高(Ρ<0.01)。加入PF-562271后,FAK和pFAK 蛋白表达水平显著降低(Ρ<0.05,图1A~C)。RT-qPCR结果显示,与LPS组相比,造模组FAK相对表达量增加(Ρ<0.01),加入PF-562271后,FAK表达显著降低(Ρ<0.01,图1D)。
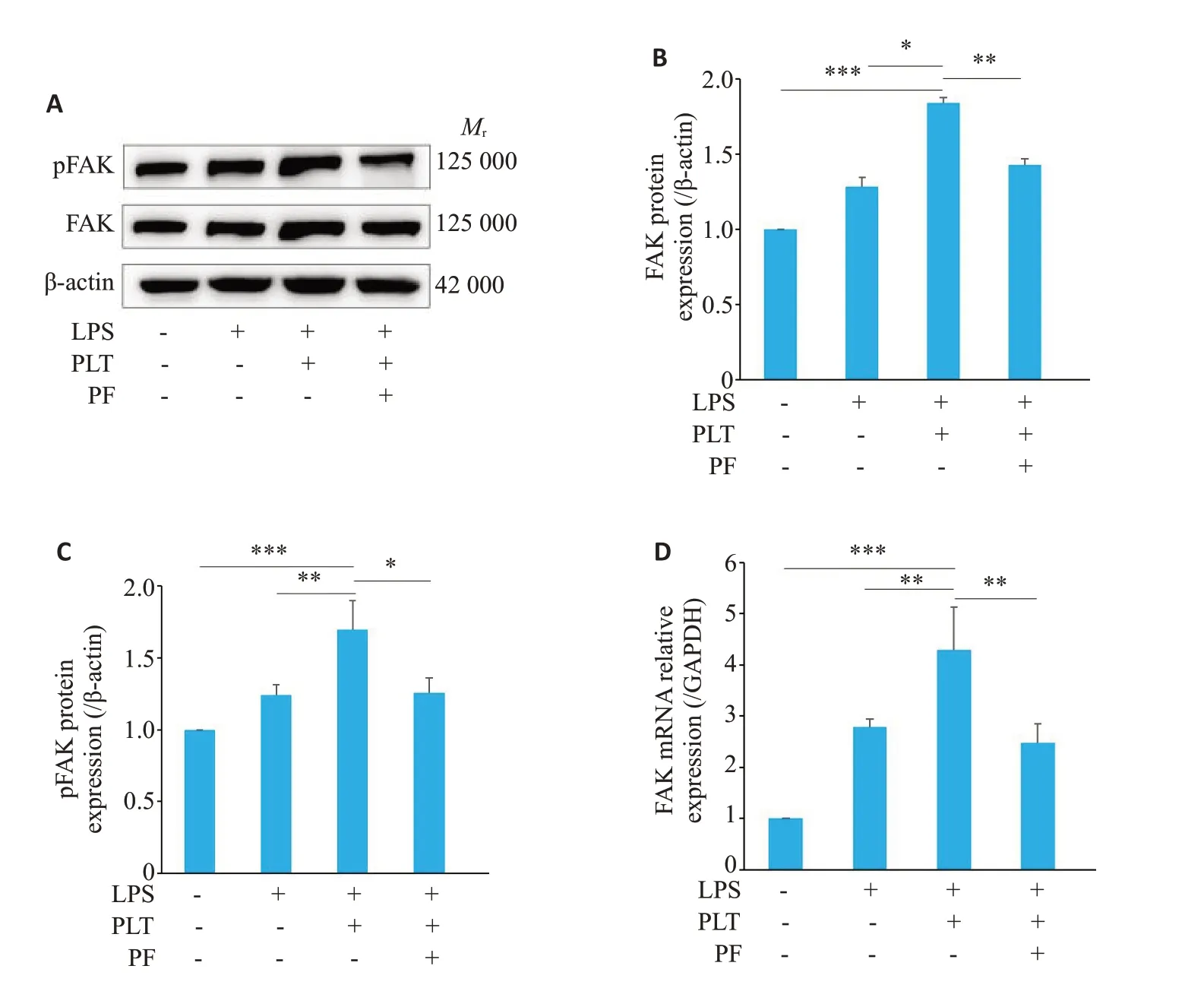
图1 PF-562271抑制FAK、pFAK表达Fig.1 PF-562271 inhibits FAK and pFAK expression in cultured HUVECs. A-C:Western blotting for detecting changes in FAK and pFAK protein expressions.D:RTqPCR for FAK mRNA expression.Data are presented as Mean±SD (n=3).*P<0.05,**P<0.01,***P<0.001.
2.2 HUVEC 损伤模型加入PF-562271 后,FAK 表达减少
免疫荧光结果显示,与LPS组相比,造模组FAK的平均荧光强度增高(Ρ<0.05),加入PF-562271后,FAK的平均荧光强度降低(Ρ<0.01,图2)。

图2 免疫荧光检测FAK表达减少Fig.2 Expression of FAK protein in the treated HUVECs detected by immunofluorescence staining(Original magnification:×40).*P<0.05,**P<0.01,***P<0.001.
2.3 PF-562271改善内皮细胞屏障功能和通透性
ROS结果显示,与对照组相比,LPS组和造模组都会导致ROS 的增加,造模组ROS 的相对荧光强度为155.86(Ρ<0.001),而加入PF-562271后,ROS降低,此时ROS的相对荧光强度为100.64(Ρ<0.001,图3A、B)。通过测量跨内皮细胞电阻(TEER)来确定细胞的屏障完整性。结果显示,与对照组相比,造模组TEER值降低(Ρ<0.01),加入PF-562271后,TEER值增高(Ρ<0.01,图3C)。通过测量FITC-dextran在Transwell小室培养的内皮细胞的渗透量分析细胞的通透性。结果显示,与LPS组相比,造模组细胞的FITC-dextran的渗透量增高(Ρ<0.01),加入PF-562271 后渗透量降低(Ρ<0.05,图3D)。
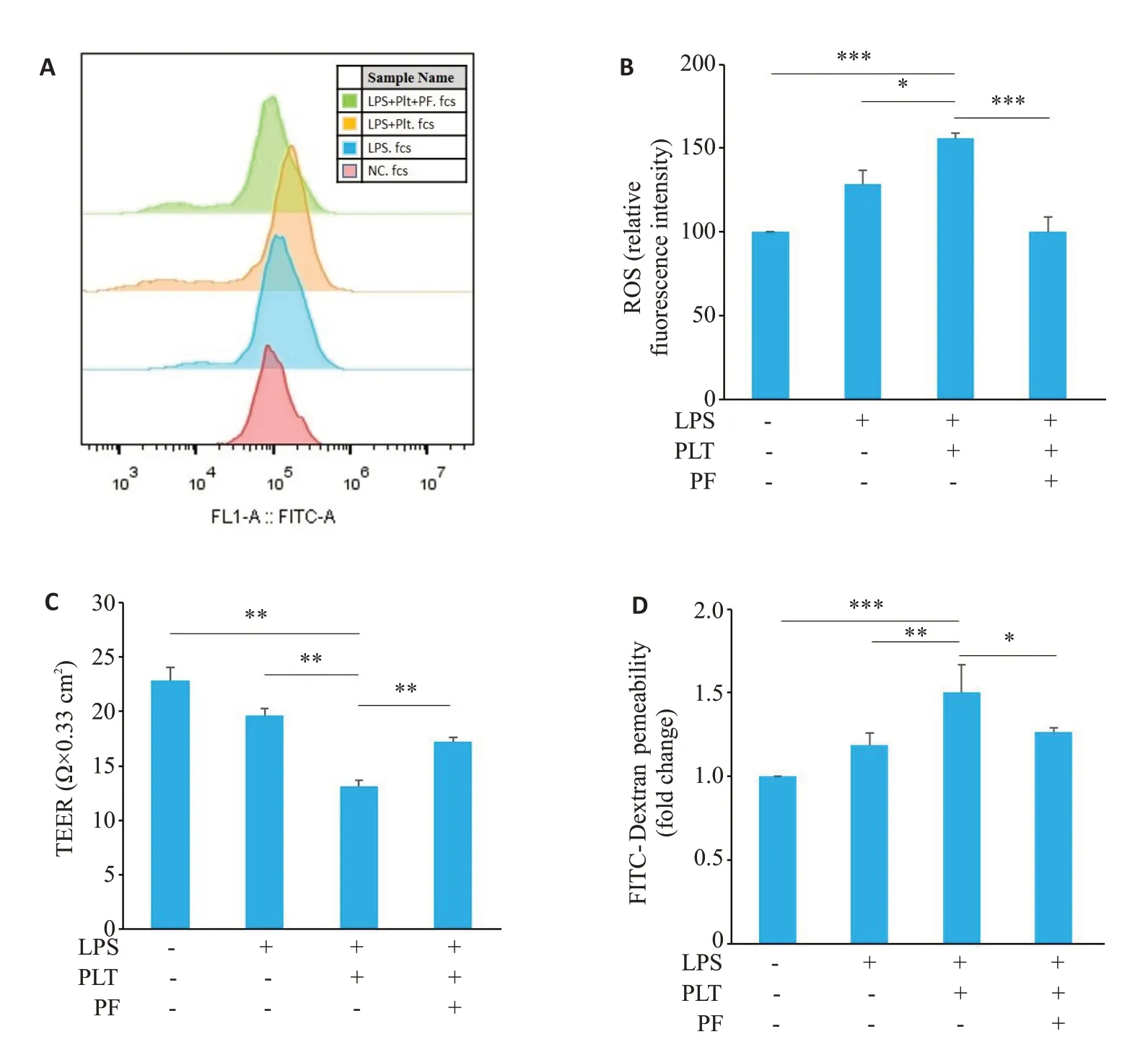
图3 PF-562271对内皮细胞屏障功能和通透性的影响Fig.3 Effect of PF-562271 on barrier function and permeability of HUVECs with different treatments. A, B: Changes in ROS levels. C: Changes in TEER levels. D: Changes in cell permeability.Data are presented as Mean±SD(n=3).*P<0.05,**P<0.01,***P<0.001.
2.4 PF-562271抑制内皮细胞炎性因子表达
通过RT-qPCR检测内皮细胞中炎症因子的表达,结果显示与对照组相比,TNF-α、IL-6、IL-8表达相对增高(Ρ<0.001),加入PF-562271后,TNF-α、IL-6、IL-8表达下降(Ρ<0.05,图4A~C)。通过ELISA检测内皮细胞炎性因子的蛋白表达,结果显示与对照组相比,TNF-α、IL-6、IL-8 表达增高(Ρ<0.01),加入PF-562271 后,TNF-α、IL-6、IL-8表达下降(Ρ<0.01,图4D~F)。
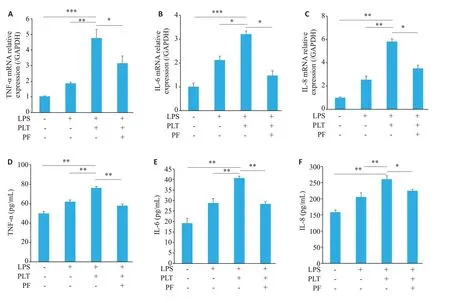
图4 PF-562271抑制TNF-α、IL-6、IL-8 的表达Fig.4 PF-562271 inhibits the expression of TNF-α,IL-6 and IL-8.A-C:TNF-α,IL-6 and IL-8 mRNA levels detected using RT qPCR.D-F:TNF-α,IL-6 and IL-8 protein levels detected using ELISA.(Mean±SD,n=3).*P<0.05,**P<0.01,***P<0.001.
2.5 HUVEC 损伤模型中,PF-562271 抑制PECAM-1表达
免疫印记结果显示,与LPS 组相比,造模组PECAM-1蛋白表达增高(Ρ<0.05),加入PF-562271后,PECAM-1表达水平降低(Ρ<0.05,图5A、B)。RT-qPCR结果显示,与LPS组相比,造模组PECAM-1表达水平增高(Ρ<0.01),加入PF-562271后,PECAM-1表达水平降低(Ρ<0.01,图5C)。
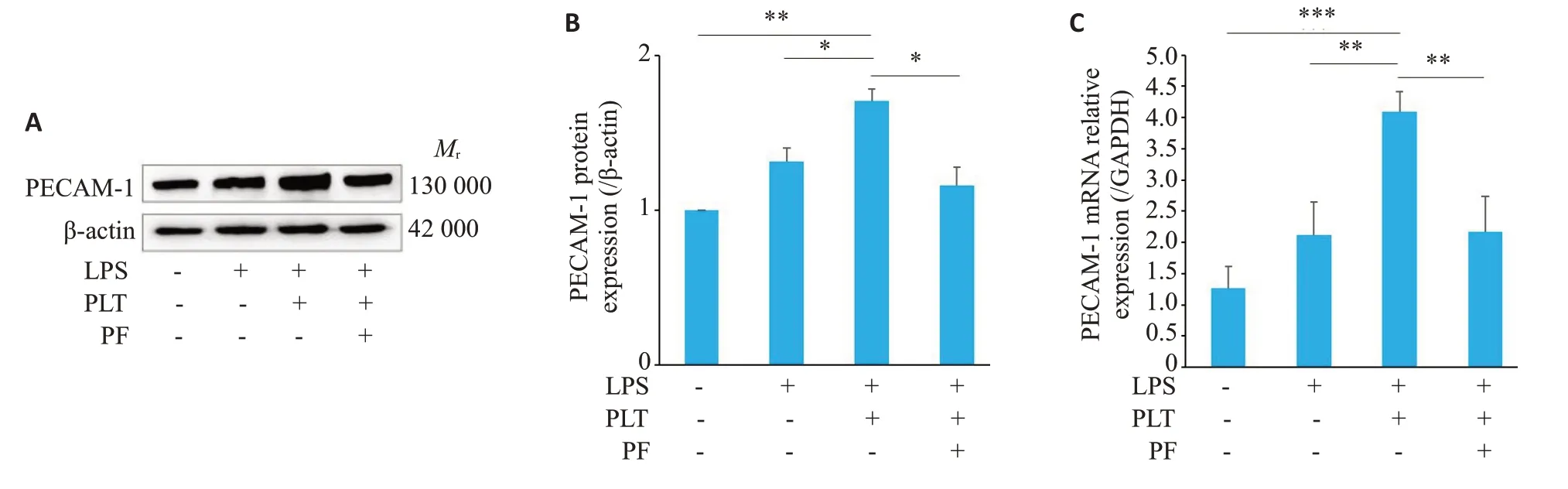
图5 PF-562271抑制PECAM-1表达Fig.5 PF-562271 inhibits PECAM-1 expression in cultured HUVECs. A-B: Western blotting for PECAM-1 protein expression changes.C:RT-qPCR for PECAM-1 mRNAexpression changes.Data are presented as Mean±SD(n=3).*P<0.05,**P<0.01,***P<0.001.
2.6 HUVEC损伤模型加入PF-562271后,PECAM-1表达减少
免疫荧光结果显示,与LPS 组相比,造模组中PECAM-1 的平均荧光强度增高(Ρ<0.01),加入PF-562271 后,PECAM-1 的平均荧光强度降低(Ρ<0.01,图6)。
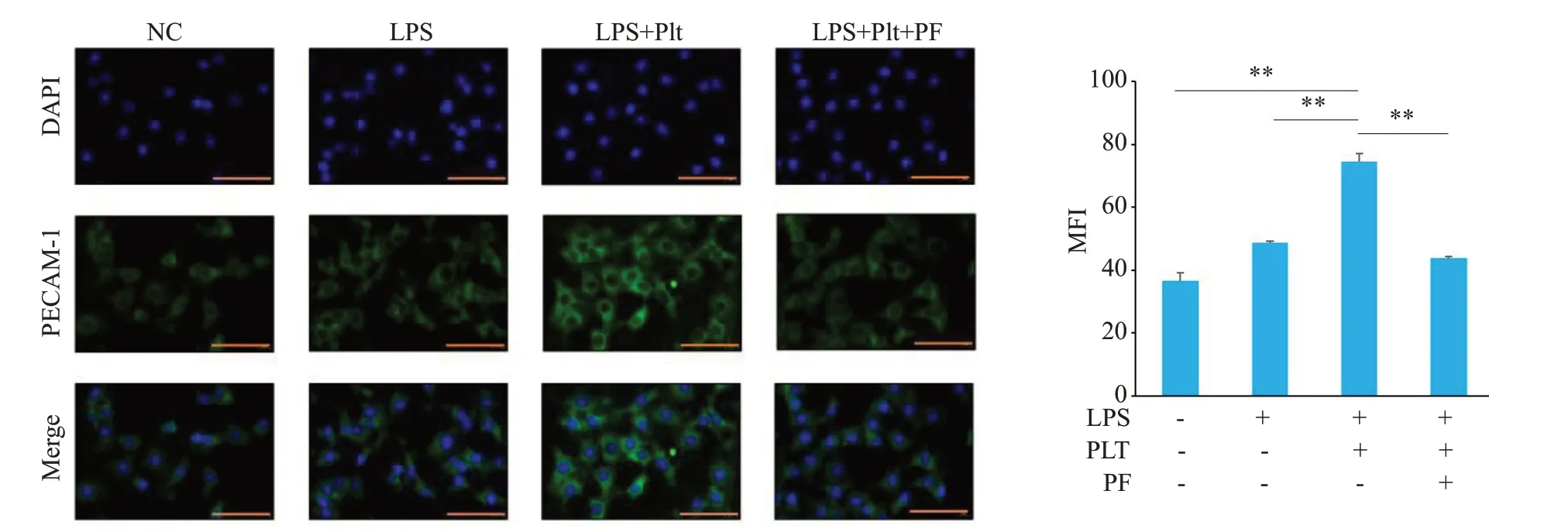
图6 免疫荧光检测PECAM-1表达降低Fig.6 Immunofluorescence staining of PECAM-1 expression in HUVECs with different treatments(×40).*P<0.05,**P<0.01,***P<0.001.
2.7 HUVEC损伤模型中,维生素C降低PECAM-1表达
免疫荧光结果显示,与LPS 组相比,造模组PECAM-1的平均荧光强度增高(Ρ<0.01)。加入ROS抑制剂维生素C 后,PECAM-1 的平均荧光强度降低(Ρ<0.01,图7)。

图7 加入维生素C后,免疫荧光检测PECAM-1蛋白表达降低Fig.7 Vitamin C decreases PECAM-1 protein expression in HUVECs with different treatments detected by immunofluorescence staining(×40).*P<0.05,**P<0.01,***P<0.001.
3 讨论
内皮细胞功能障碍是动脉粥样硬化、糖尿病、肥胖、高血压、急性肺损伤等疾病的主要促成因素[19]。血管内皮损伤机制受多种因素影响,如氧化应激、氧化低密度脂蛋白和炎症反应等[20]。在TRALI进展过程中,内皮细胞屏障功能受损,活化的内皮细胞释放趋化因子,激发中性粒细胞,高反应性的中性粒细胞会与肺内皮细胞发生黏附[21]。中性粒细胞被激活并释放ROS,会损坏内皮细胞并导致血管渗漏,引发TRALI。基于“二次打击”理论[17],我们选择脂多糖和老化血小板来建立内皮细胞损伤的体外模型。通过前期构建的TRALI小鼠模型,提取小鼠肺组织检测炎性因子的表达,结果显示TNF-α、IL-6、IL-8在模型组中显著增高,表明肺部已产生较为严重的炎症反应。与此同时,为了在体外验证TRALI的发生发展,我们将人脐静脉内皮细胞用脂多糖和老化血小板刺激建立内皮细胞损伤的体外模型。观察到ROS增加,TEER值降低,细胞通透性增高,说明此时内皮细胞屏障受损。造模组中TNF-α、IL-6、IL-8水平显著增高,这与体内实验的结果一致。综上所述,本研究成功构建体外TRALI内皮细胞损伤模型。
FAK 是一种非受体酪氨酸蛋白激酶,具有高度保守性,可调节包括内皮细胞在内的细胞的迁移、侵袭、转移和存活[22]。研究表明,在类风湿性关节炎中,FAK可以通过整合素β3增加滑膜血管生成[23]。在ALI中,FAK可通过Rho GTP酶信号转导,破坏内皮细胞屏障[24]。因此,内皮细胞中的FAK被认为是类风湿性关节炎炎症和ALI血管通透性的重要决定因素。FAK还可调节活性氧诱导的内皮细胞屏障破坏,NADPH氧化酶的激活和ROS的生成被确定为损伤内皮细胞的重要介质[25]。这些发现表明,FAK在内皮细胞中发挥了重要作用。在我们构建的脂多糖和老化的血小板诱导的内皮细胞损伤模型中,造模组FAK的mRNA和蛋白表达水平均升高,且细胞内ROS含量上升。我们的研究结果与FAK在ALI中的结果是高度一致的。在LPS诱导的ALI小鼠模型中,FAK抑制剂PND-1186可抑制巨噬细胞产生的炎症反应[26]。另一种FAK抑制剂PF-562271可抑制FAK的磷酸化,缓解内皮细胞屏障功能损伤,从而减轻LPS诱导的小鼠ALI[27]。本研究发现,脂多糖和老化血小板刺激HUVEC,TEER值降低,提示内皮细胞的屏障完整性受损。而PF-562271增加TEER值,内皮细胞屏障完整性得到改善。测定细胞的通透性时,我们发现脂多糖和老化血小板刺激HUVEC,可增加内皮细胞的通透性,加入PF-562271后,内皮细胞通透性降低。检测FAK在造模组中的表达,发现FAK和pFAK在造模组中表达水平升高,加入PF-562271后,FAK和pFAK表达水平降低,表明FAK抑制剂在内皮细胞损伤模型中同样能抑制FAK蛋白的表达及其磷酸化。
血小板-内皮细胞黏附分子-1(PECAM-1),也称为CD31,是内皮细胞与细胞连接处的黏附分子免疫球蛋白超家族的成员[28]。PECAM-1在血管生成中起主要作用,在炎症和血栓应激下维持血管完整性,并调节白细胞跨内皮迁移[29]。研究表明,针对PECAM-1的单克隆抗体可阻断急性炎症,以应对各种刺激[30]。在内毒素诱导的角膜炎模型中,阻断PECAM-1可以抑制中性粒细胞募集并防止内毒素诱导的角膜浑浊度增加[31]。在DSS诱发的结肠炎模型中,阻断PECAM-1可以减少白细胞迁移并降低疾病严重程度[32]。在糖原诱导小鼠腹膜炎的模型,阻断PECAM-1可以防止中性粒细胞聚集到腹膜腔中[33]。PECAM-1敲除小鼠表现出中性粒细胞浸润减少[34],而在异物炎症中,缺乏PECAM-1导致血管生成减少而减轻炎症[35]。因此,PECAM-1在炎症中发挥重要作用,可以促进白细胞跨内皮迁移。在子宫癌细胞模型中用FAK 抑制剂(GSK2256098)治疗肿瘤,PECAM-1蛋白表达降低,细胞增殖减少并增加细胞凋亡率[36]。我们推测,FAK抑制剂可能通过PECAM-1来缓解内皮细胞损伤。本研究结果表明,内皮细胞被脂多糖和老化血小板刺激后,PECAM-1 表达升高,加入FAK抑制剂PF-562271后,PECAM-1表达水平降低。但是FAK与PECAM-1之间的具体调控机制还不清楚,有待于进一步研究。在雌二醇诱导的血管内皮细胞损伤模型中,可以通过敲低FAK,提高细胞活力同时又抑制ROS的水平[37]。而在香烟烟雾引起血脑屏障内皮细胞炎症的模型中,应用抗氧化剂维生素C(抗坏血酸)时,可以发现炎性因子IL-6、IL-8的释放减少,PECAM-1表达水平降低和单核细胞-内皮细胞的黏附减弱[38]。在易发生卒中的大鼠模型中,维生素C和维生素E可减少氧化应激,改善血管功能和结构,并防止高血压的进展[39]。本研究结果表明,脂多糖和老化的血小板可以促进ROS的释放,加入FAK抑制剂PF-562271后可以减少ROS 的释放。在造模组中,加入维生素C 后,PECAM-1的荧光强度降低。我们发现FAK抑制剂可通过PECAM-1来抑制ROS的释放。为了进一步确定PECAM-1 在炎症状态下的作用,我们后续可考虑用siRNA 抑制内皮细胞PECAM-1 的表达,进一步验证FAK与PECAM-1的调控机制,探究PECMA-1对内皮细胞功能的影响。
综上所述,本研究发现脂多糖和老化血小板可构建内皮细胞损伤的模型,FAK抑制剂PF-562271可通过改善氧化应激水平和降低炎症反应来缓解内皮细胞损伤。为进一步探索FAK抑制剂PF-562271调节内皮细胞损伤的机理提供了理论依据,为PF-562271对TRALI的治疗作用提供了研究基础。
