异戊酸血症患儿临床特征、基因型及随访分析
2024-03-16孙宇宁梁黎黎刘宇超龚珠文邱文娟张惠文顾学范韩连书
孙宇宁 梁黎黎 丁 思 刘宇超 陈 婷 龚珠文 邱文娟 张惠文 顾学范 韩连书
上海交通大学医学院附属新华医院 上海市儿科医学研究所 儿内分泌遗传科(上海 200092)
异戊酸血症(isovaleric acidemia,IVA,OMIM 243500)是亮氨酸分解过程中的代谢产物异戊酰辅酶A脱氢酶(isovaleryl‐CoA dehydrogrnase,IVD)缺陷,导致旁路代谢生成的异戊酸、异戊酰甘氨酸和3‐羟基异戊酸及异戊酰肉碱(isovalerylcarnitine,C5)在体内蓄积,可产生特殊“旱脚味”(主要由未结合异戊酸所致),导致急性酸中毒或多种脏器功能损伤的疾病[1]。发病率在不同国家差异较大,德国约为1/62500[2],美国约为1/250000[3]。我国各地区发病率差异较大,我国台湾约为1/365000[4],浙江省约为1/234000[5],福建泉州地区的发病率为1/84469[6]。根据本院782 万新生儿串联质谱筛查数据,推测我国IVA的发病率为1/195492[7]。IVA为IVD基因变异所导致的常染色体隐性遗传病,IVD基因位于染色体15 q 14‐15,包括12 个外显子,长15 kb,编码394个氨基酸。IVA临床表现缺乏特异性,根据发病时间及临床表现,主要分为急性新生儿型、慢性间歇型和无症状型[8]。急性新生儿型患儿如不能得到及时的诊断和治疗,发病后致死致残率极高。IVA主要通过血C5、C5与乙酰肉碱(acetylcanitine,C2)比值(C5/C 2)、C 5 与丙酰肉碱(propionylcarnitine,C 3)比值(C 5/C 3)及尿异戊酰甘氨酸或3‐羟基异戊酸增高做出诊断,基因变异分析可明确基因变异类型[9]。本研究通过总结34例IVA患儿的临床资料及基因变异分析,为临床医师提高对该病的早期识别和诊断提供参考。
1 对象与方法
1.1 研究对象
选择 2012年4月至2023年10月在上海交通大学医学院附属新华医院儿内分泌遗传科明确诊断(或外院诊断复核明确),并进行治疗和随访的IVA患儿作为研究对象。纳入标准:①年龄0 天~4 岁8个月;②符合IVA 诊断标准[10];③有临床发病情况记录。排除标准:基因检测结果已经排除IVA 的患儿或确诊为其他遗传代谢病的患儿。
本研究经上海交通大学医学院附属新华医院伦理委员会审查批准(NO.XHEC‐D‐2023‐220)。所有检查获得患儿家长或监护人的知情同意。
1.2 方法
1.2.1 IVA 诊断标准 IVA 诊断依据为满足下述3 个条件中2 条:①血C 5 >0.40 μmol/L、C 5/C 2、C5/C3比值升高;②尿有机酸分析提示异戊酰甘氨酸>2.0mmol/mol肌酐,或者伴有3‐羟基异戊酸增高;③IVD基因检出复合杂合或纯合致病或可能致病变异[11]。
1.2.2 临床资料收集 包括患儿性别、起病年龄、起病症状及新生儿筛查情况,一般实验室检验包括血常规、血气、乳酸、肝功能、血氨、电解质、血糖,血液中C5、C3、C2水平,C5/C2比值及C5/C3比值,尿中异戊酰甘氨酸水平,头颅核磁共振成像(MRI)结果以及基因检测结果。
1.2.3 血酰基肉碱和尿有机酸检测 采用串联质谱技术检测患儿血中C 5、C 3 及C 2 水平,并计算C 5/C 2 及C 5/C 3 比值。标本采集用干血滤纸片法,检测方法参考文献[12]。串联质谱仪为美国生物应用系统公司产品(API 2000/API 4000型)。采用气相色谱质谱技术检测尿异戊酰甘氨酸及3‐羟基异戊酸,检测方法参考文献[13],气相色谱质仪为日本岛津公司产品(QP2010型)。
1.2.4 基因检测 应用乙二胺四乙酸(EDTA)抗凝管提取患儿及其父母外周静脉血各2 mL 进行Sanger 测序或全外显子组测序。具体方法[14]:采用全基因组DNA 提取试剂盒(Qiagen,德国)提取DNA,用Covaris S220超声破碎仪(Covaries公司,美国)将基因组DNA片段剪切为200 bp左右片段,用全外显子捕获试剂盒(IDT公司,美国)进行捕获,用Illumina NovaSeq 6000测序仪(Illumina公司,美国)对捕获片段进行双端测序,测序片段长度为150 bp。测序产生的fastq数据用BWA比对到hg19参考基因组,获得的可疑变异通过查阅本地人群数据库、千人基因组(1000 G)和人群基因组变异频率数据库(gnomAD)以及疾病数据库(HGMD)进行分析;根据最新美国医学遗传学与基因组学学会(ACMG)指南对变异位点的致病性进行分析[15]。明确基因变异患儿的父母进一步进行 Sanger测序,以明确致病变异来源。
1.2.5 随访 随访截至2023年12月。每3~6个月门诊随访1 次,对无法按时门诊随访的患儿予以电话随访患儿的预后包括治疗情况,有无疾病急性发作,智力发育水平,常规生化检测包括血常规、肝功能、电解质、血气和血糖等检测结果,血串联质谱和尿气相质谱等复查结果。<6岁患儿采用Gesell(0~6岁)发育量表评估患儿智力发育水平,结果用发育商数(DQ)表示。75 <DQ <85 为边缘水平,55≤DQ≤75为轻度发育迟缓,40≤DQ<55为中度发育迟缓,25≤DQ<40为重度发育迟缓,DQ<25为极重度发育迟缓;对无法进行上述量表评估的患儿,由有经验的临床医生评估其语言、运动、认知功能及行神经系统查体。
1.3 统计学分析
采用 SPSS 22.0统计软件进行数据分析。非正态分布计量资料以中位数(P25~P75)或中位数(全距)表示,组间比较采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料
共纳入35例IVA患儿,排除1例(新生儿筛查阳性,随访后血串联质谱正常,并通过基因诊断排除)。最后纳入分析34例,男22例、女12例,男女比例1.8:1,患儿父母均非近亲婚配。其中15例为急性新生儿型,中位发病年龄为3d(范围2~9 d),死亡4例;3例为慢性间歇型,中位发病年龄24月(范围6~56月);余16例均为新生儿筛查确诊的无症状型患儿。急性新生儿型IVA患儿首发临床表现为精神反应差(12例)、喂养困难(8例)、呕吐(5例)、皮肤可闻及特殊气味(2例)、低体温(1例);慢性间歇型均为呕吐起病(3/3),1例尿液闻及“旱脚味”。
2.2 常规实验室检测结果
急性新生儿型IVA患儿发病时三系下降5例,代谢性酸中毒7例,血氨升高7例,肝功能异常6例,肌酸激酶升高2例,低血钙2例,低血糖2例。慢性间歇型3例患儿发病时均有代谢性酸中毒。
2.3 血串联质谱及尿气相色谱质谱检测结果
34 例IVA 患儿治疗前检测结果见表1。根据有无临床表现,将IVA患儿分为有临床症状组(n=18)[包括急性新生儿型(n=15)、慢性间歇型(n=3)]及无症状型组(n=16)。与无症状型组相比,有临床症状组血中C 5 水平,C 5/C 2 比值及C 5/C 3 比值以及尿中异戊酰甘氨酸水平显著升高,差异有统计学意义(P<0.05)。
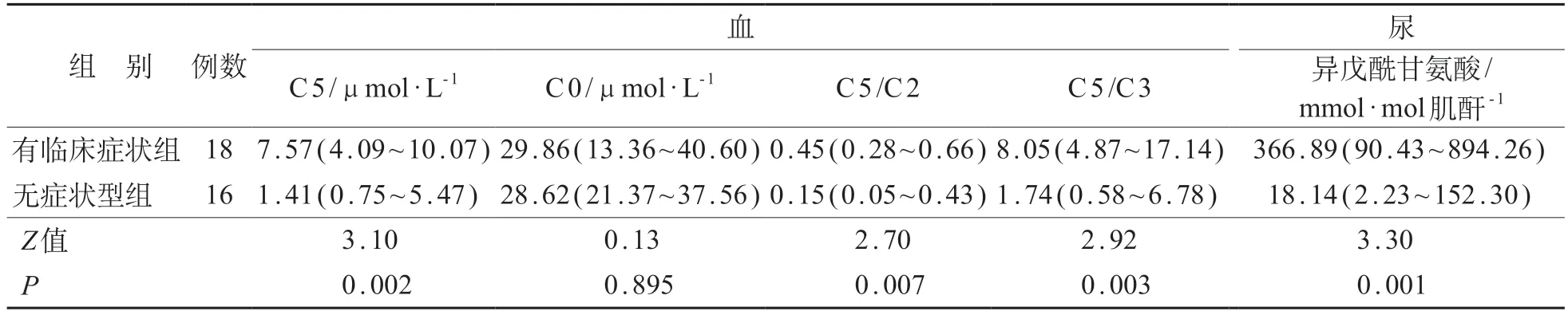
表1 IVA患儿血串联质谱及尿气相色谱质谱治疗前检测结果[M(P25~P75)]
急性新生儿型患儿中共4 例死亡,均属新生儿期起病,为发病或死亡后确诊,未行新生儿筛查。4例IVA死亡患儿血中C5、C5/C2比值、C5/C3比值以及尿中异戊酰甘氨酸水平均显著升高,分别为9.85(7.02~16.20)μmol/L、0.54(0.45~1.04)、12.01(10.97~33.95)、979.88(969.96~989.80)mmol/mol肌酐。
2.4 头颅磁共振成像检查
6 例患儿行头颅MRI 检查,4 例出现异常改变,2 例未见明显异常。其中3 例为急性新生儿期型,1例为无症状型。受累部位无明显特异性:1例为基底节多发异常信号,1 例脑白质容积偏小,1 例双侧大脑脚及内囊受累,呈对称性斑片状改变,1例两侧脑室三角区异常信号。
2.5 基因变异检测结果
34 例患儿全部进行基因检测,其中28 例为复合杂合突变,4 例为纯合子突变,2 例仅携带1 种突变。共检出40 种IVD基因突变位点,其中错义突变30 种(75.00%),12 种为新发错义突变,分别为:c.958 G>A、c.1174 C>T、c.458 T>C、c.994 A>T、c.919C>T、c.380T>C、c.1012G>T、c.1061A>G、c.476G>C、c.1016G>A、c.1195G>C、c.1232A>C。另还有1种缺失突变(c.724_726del),1种基因内重复(chr15:40699822‐40708584,hg19),大小为8.76 kb,1种缺失插入突变(c.466‐3_466‐2delinsGG)。最常见的突变位点为:c.1208A>G(n=8)。临床表现与基因变异类型未见明显相关性。
2.6 治疗
IVA 患儿急性期治疗主要为维持内环境稳定和对症处理,限制亮氨酸摄入,10%葡萄糖补充能量,静脉滴注碳酸氢钠纠酸,给予左卡尼汀(每日100~300 mg/kg)和甘氨酸(每日250~600 mg/kg)促进异常代谢物排出,伴严重高氨血症患儿给予苯丁酸钠或苯甲酸钠,1例患儿发病时因高氨血症行血液透析治疗。
间歇期治疗给予去除亮氨酸营养粉治疗。29例患儿根据病情严重程度,每天将普通食物与去除亮氨酸营养粉按1∶(1~3)比例喂养,或限制天然蛋白质的摄入,每日蛋白总摄入量至少达到同年龄同性别健康儿童推荐量的最小值;1例因病情较轻,未予去除亮氨酸营养粉治疗。30 例口服左卡尼汀,剂量为每天50~100 mg/kg,分3~4次给予。29例口服甘氨酸,剂量为每天150~200 mg/kg,分3~4次给予;1例患儿因病情较轻,未用甘氨酸治疗。摄入蛋白量及相关药物剂量根据患儿临床表型、生化指标、血串联质谱、尿气相色谱监测行个性化治疗。
2.7 随访
中位随访时间为5年8个月(范围1年3个月~7年9个月)。随访至2023年12月,急性新生儿型患儿共4例死亡,中位死亡年龄为8 d(范围4~50 d),死因中均有失代偿性代谢性酸中毒;其余11例中9 例出现智力发育落后(4 例患儿因家长拒绝行智力测试,仅由有经验的临床医生综合评估),2 例(例10、例13)智力发育边缘水平。3例慢性间歇型患儿发育落后,其中2例(例18、例19)表现为智力发育落后,1例(例17)表现为运动发育落后,活动耐力差,肌力下降。见表2。16例新筛检出无症状型患儿未见明显临床症状。

表2 IVA部分患儿发育评估结果
30例存活IVA患儿最近1次随访时与治疗前质谱检测结果详见表3。与治疗前相比,最近1次随访时尿中异戊酰甘氨酸水平显著下降,差异有统计学意义(P<0.05),血中C 5 水平、C 5/C 2 比值和C 5/C3比值差异无统计学意义(P>0.05)。
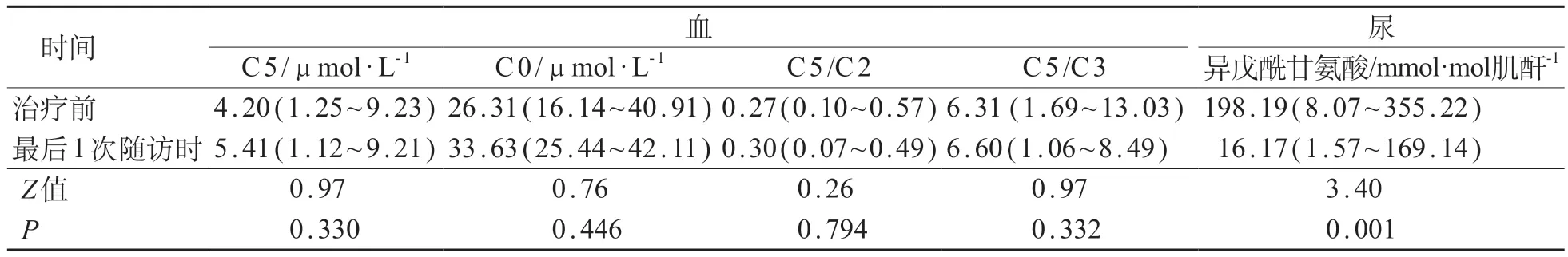
表3 IVA存活患儿30例最后1次随访与治疗前质谱指标比较
3 讨论
IVA 是最早明确诊断的常染色体隐性遗传的有机酸血症[1],该病缺乏特异性临床表现,新生儿期有喂养困难、呕吐、脱水、嗜睡、昏迷、抽搐等非特异性临床表现,可发生急性脑病、代谢性酸中毒、高氨血症,慢性间歇期有反复呕吐、喂养困难、生长迟缓及智力障碍等,也有罕见的胰腺炎发作、肝纤维化、视神经萎缩等[11]。如不及时处理急性分解代谢异常,预后则不佳。本研究中死亡的4 例患儿均于新生儿期急性发病,未行新生儿筛查。有3例急性新生儿型患儿在出具新生儿筛查结果后明确诊断为IVA,患儿得到早期诊断与治疗,随访至今,该3例患儿中有2 例生长发育正常,1 例有生长发育落后,常规生化检测结果未见异常。随着新生儿筛查的应用,越来越多的无症状IVA 患儿得到诊断。本研究中超过半数患儿通过新生儿筛查检出,16例无症状患儿随访至今,均无明显临床症状,常规生化结果均未见异常。研究表明,异戊酸等代谢产物通过诱导氧化应激抑制大脑皮层钠钾 ATP酶活性从而引起神经系统损伤[16]。IVA的代谢危象发生时间、早期诊断与良好的神经认知结局相关。一项对155 例有症状IVA 患儿的分析表明,在出生后5周内诊断的患儿中,在初始代谢危象期间的病死率占1/3,而此后诊断的患儿病死率仅为3%;出生后5周内明确诊断并获得治疗的IVA患儿仅有15%出现神经系统损伤,而后期诊断的IVA患儿45%会出现神经系统损伤,神经系统的受损程度与诊治早晚有关,与疾病的急性发作次数及严重程度无关[17]。故新生儿筛查有助于疾病早诊断、早治疗,降低IVA患儿病死率,改善IVA患儿预后[18]。
随着血串联质谱和尿气相色谱技术在新生儿筛查的广泛应用,越来越多的患儿在临床症状出现前已获得明确诊断。一项纳入160 万德国新生儿的大型研究发现,新生儿筛查检测到的IVA病例中,近一半(11/24)被定义为“轻度或中度代谢异常”,随访这些患儿,可能终生无症状[2]。这也与本研究结果相一致。血C5是IVA的生物标志物之一,但由于C5和2‐甲基丁酰肉碱是同分异构体,还需结合C5/C3和C 5/C 2 比值升高以及尿中异戊酰甘氨酸升高综合判断,与新生儿短链酰基辅酶A 脱氢酶缺乏症相鉴别。此外,有些抗菌药物如匹氨西林、头孢菌素及特戊酸酯软膏含特戊酰肉碱,其使用会导致血中C5水平暂时性增高[19]。因此,尿异戊酰甘氨酸增多被认为是诊断 IVA 的特征性指标。一项来自西班牙的研究分别将血C 5 浓度6 μmol/L、尿异戊酰甘氨酸浓度195 mmol/mol肌酐作为切值,将IVA分为代谢轻型和代谢严重型,并以此长期随访代谢严重型患儿[20]。监测尿异戊酰甘氨酸浓度相比血C 5 水平更能评估疾病进展及预后情况。在本研究随访的30例存活IVA患儿中,经过治疗,尿异戊酰甘氨酸浓度显著下降,但本研究纳入各组患儿数量较少,无法用统计学方法分析出各组指标与疾病严重程度及预后的相关性。在长期的随访治疗中,仍缺乏确定的实验室检测指标监测疾病控制状态[21],可能需要通过扩大样本数量及长期随访得以进一步明确。
目前已报道超过90 余种IVD基因变异(http://www.hgmd.org),其中多为错义突变[22]。本研究有2例患儿仅携带1 个突变位点,这可能与基因检测方法有关,也许存在小片段的基因缺失或重复序列未检测出,或是基因内含子区域的变异导致基因剪接异常,或存在特殊的基因修饰,对该2 例患儿,将继续采用不同方法验证上述猜想。关于IVD基因变异,不同国家或地区的热点变异有地域差异:美国及德国为c.932C>T (p.A282V)[21],南非为c.367 G>A (p.G123R)[8],韩国为c.457‐3_2CA>GG[23],泰国为c.457‐3_2CA>GG[24],中国台湾地区为c.1208A>G(p.Y403C)[4]。相关研究报道了3例不典型IVA的儿童患者[25],检测到6 种基因突变位点:c.157 C>T、c.214G>A、c.1183C>G、c.1208A>G、c.1039G>A和c.1076 A>G。另有研究报道了8 例IVA 患者,发现14种基因突变类型,其中c.1208A>G占比最多[22]。中国柳州地区对2 095 名正常新生儿进行了高通量测序,检测到了10例IVD基因携带者,其中多达5例为c.1208 A>G 突变位点携带者[26]。根据本研究和其他国内研究中检测到的IVA患儿的IVD基因变异类型,推测c.1208A>G突变在中国具有较高的频率。目前尚无关于中国IVA 患者突变谱和热点的报告。然而,该变异位点是否是中国人群的热点突变,可能需要通过扩大样本量进一步验证。在基因型与临床表现或生化代谢相关性方面,有文献报道c.932C>T(p.A282V)突变与无症状型IVA最为相关[2],而在本研究中,无症状型IVA患儿无发现携带此突变。文献报道的2例携带c.640A>G(p.T214A)突变的IVA患儿为无症状型[27]。本研究中有2例携带同一突变位点的患儿同样无明显临床症状,但按照生化代谢型分类分别属于“代谢轻型”及“代谢严重型”,中国浙江省新生儿筛查检出携带这一变异的2例患儿,有1例曾发生高氨血症[5]。这提示IVD基因变异具有临床表现异质性,基因型与临床表型和生化表型的关系还须进一步探索。
综上,本研究发现IVA 患儿临床表现无明显特异性,血C5、C5/C2比值和C5/C3比值及尿异戊酰甘氨酸增高对诊断异戊酸血症具有特异性。新生儿期急性发病的患儿病情危重,病死率高。未发现基因变异类型与临床表现有明显相关性。新生儿筛查有助于该疾病的早期诊断、治疗及预后。此外,因新生儿筛查检出仅有轻微生化异常的“无症状”患儿,其发生严重分解代谢风险及远期结局仍不明确,还需进行长期随访观察。
